Masrazza
Die Informationen Auf Dieser Website Stellen Keine Medizinische Beratung Dar. Wir Verkaufen Nichts. Die Richtigkeit Der Übersetzung Wird Nicht Garantiert. Haftungsausschluss
Drogenzusammenfassung
Was ist Afrezza?
Afrezza -Inhalationspulver (Insulin -menschliches) Inhalationspulver ist ein schnell wirkendes inhaliertes Insulin, das zur Verbesserung der glykämischen Kontrolle bei erwachsenen Patienten mit Diabetes mellitus angezeigt wird.
Was sind Nebenwirkungen von Afrezza?
Afrezza kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
- Nesselsucht
- Schwierigkeiten beim Atmen
- Schwellung Ihrer Gesichtslippen Zunge oder Hals
- ungewöhnliche Muskelschmerzen
- kalt fühlen
- Schwindel
- Benommenheit
- Müdigkeit
- Schwäche
- Magenschmerzen
- Erbrechen
- langsame oder unregelmäßige Herzfrequenz
- rosa oder roter Urin
- schmerzhaftes oder schwieriges Urinieren
- neuer oder verschlechterender Drang zum Urinieren
- Änderungen in Ihrer Sicht
- Schwellung
- Schnelle Gewichtszunahme
- Kurzatmigkeit
- Appetitverlust
- Brechreiz
- Erbrechen
- Magenschmerzen
- Müdigkeit
- dunkler Urin
- Gelben der Haut oder Augen (Gelbsucht)
- blasse Haut
- ungewöhnliche Müdigkeit
- Kurzatmigkeit Und
- kalte Hände und Füße
Holen Sie sich sofort medizinische Hilfe, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigen Nebenwirkungen von Afrezza gehören:
- Niedriger Blutzucker (Hypoglykämie)
- Husten
- Halsschmerzen
- Kopfschmerzen
- Durchfall
- Ermüdung
- Brechreiz
- Bronchitis
- Harnwegsinfektion und
- Gewichtszunahme.
Suchen Sie medizinische Versorgung oder rufen Sie auf einmal 911 an, wenn Sie die folgenden schwerwiegenden Nebenwirkungen haben:
- Schwerwiegende Augensymptome wie plötzlicher Sehverlust verschwommenes Sehen Tunnel Sehschmerzen oder Schwellungen oder Halos in der Umgebung des Lichts;
- Schwerwiegende Herzsymptome wie schnelle unregelmäßige oder pochende Herzschläge; Flattern in deiner Brust; Kurzatmigkeit; und plötzliche Schwindel -Benommenheit oder ohnmächtig;
- Starke Kopfschmerzen Verwirrung verwirrt Spracharm oder Bein Schwäche Schwierigkeiten beim Verlust der Koordination unstabil sehr steifes Muskeln hoher Fieber problemlos Schwitzen oder Zittern.
Dieses Dokument enthält nicht alle möglichen Nebenwirkungen und andere können auftreten. Wenden Sie sich an Ihren Arzt nach zusätzlichen Informationen zu Nebenwirkungen.
Dosierung für Afrezza
AFREZZA -Inhalationspulver ist als 4 -Einheiten -Kartuschen mit einer einzelnen Verwendung von 4 Einheiten erhältlich, die über orale Inhalation unter Verwendung einer einzelnen Inhalation pro Patrone verabreicht werden sollen.
Welche Drogensubstanzen oder Nahrungsergänzungsmittel interagieren mit Afrezza?
Afrezza kann mit Antidiabetik -Arzneimittel -ACE -Inhibitoren Angiotensin II -Rezeptorblocker interagieren. Isoniazid Niacin orale Kontrazeptiva Phenothiazine Progestogene Protease Inhibitoren Somatropin Sympathomimetiker Schilddrüsenhormone Alkohol Beta-Blocker Clonidin Lithiumsalze Pentamidin Clonidin Guanethidin und Reserpin. Sagen Sie Ihrem Arzt alle Medikamente und Nahrungsergänzungsmittel, die Sie verwenden.
Afrezza während der Schwangerschaft und des Stillens
Während der Schwangerschaft sollte Afrezza nur angewendet werden, wenn sie verschrieben werden. Dieses Medikament kann in Muttermilch übergehen. Wenden Sie sich vor dem Stillen an Ihren Arzt.
Weitere Informationen
Unser Afrezza (Insulin Human) Inhalation Pulver Side Effects Drug Center bietet einen umfassenden Überblick über die verfügbaren Arzneimittelinformationen über die potenziellen Nebenwirkungen bei der Einnahme dieses Medikaments.
FDA -Drogeninformationen
- Drogenbeschreibung
- Indikationen
- Nebenwirkungen
- Wechselwirkungen mit Arzneimitteln
- Warnungen
- Überdosis
- Klinische Pharmakologie
- Medikamentenhandbuch
WARNUNG
Risiko eines akuten Bronchospasmus bei Patienten mit chronischer Lungenerkrankung
- Akuter Bronchospasmus wurde bei Patienten mit Asthma und COPD unter Verwendung von Afrezza beobachtet. [Siehe Warnung und VORSICHTSMASSNAHMEN ].
- Afrezza ist bei Patienten mit chronischer Lungenerkrankung wie Asthma oder COPD kontraindiziert. [sehen Kontraindikationen ].
- Vor der Initiierung von Afrezza führen Sie eine detaillierte medizinische Vorgeschichte durch körperliche Untersuchung und Spirometrie durch (FEV1) um potenzielle Lungenerkrankungen bei allen Patienten zu identifizieren [siehe Dosierung und Verwaltung WARNUNG AND VORSICHTSMASSNAHMEN ].
Beschreibung für Afrezza
Afrezza -Patronen
Afrezza besteht aus Einweg-Plastikpatronen, die mit einem weißen Pulver gefüllt sind, das Insulin (Mensch) enthält, das nur über orale Inhalation unter Verwendung des Afrezza-Inhalators verabreicht wird.
Afrezza-Patronen enthalten menschliches Insulin, das durch rekombinante DNA-Technologie unter Verwendung eines nicht pathogenen Laborstamms von Escherichia coli (K12) produziert wird. Chemisch menschliches Insulin hat die empirische Formel C.257H383N65O77S6 und ein Molekulargewicht von 5808. Humanes Insulin hat die folgende primäre Aminosäuresequenz:
 |
Insulin wird an Trägerpartikeln adsorbiert, die aus Fumaryl -Diketopiperazin (FDKP) und Polysorbat 80 bestehen.
Afrezza -Inhalationspulver ist ein trockenes Pulver, das als 4 -Einheits- oder 12 -Einheiten -Patronen geliefert wird. Die 4 -Einheiten -Patrone enthält 0,35 mg Insulin. Die 8 -Einheiten -Patrone enthält 0,7 mg Insulin. Die 12 -Einheiten -Patrone enthält 1 mg Insulin.
Afrezza -Inhalator
Der Afrezza-Inhalator wird vom Patienten atemberaubend. Wenn der Patient durch das Gerät einatmet, wird das Pulver aerosolisiert und in die Lunge geliefert. Die Menge an Afrezza, die an die Lunge abgegeben wird, hängt von einzelnen Patientenfaktoren ab.
Verwendung für Afrezza
AFREZZA® ist ein schnell wirkendes inhaliertes menschliches Insulin, das zur Verbesserung der glykämischen Kontrolle bei erwachsenen Patienten mit Diabetes mellitus angezeigt wird.
Einschränkungen der Nutzung
- Afrezza wird nicht für die Behandlung von diabetischer Ketoacidose empfohlen [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
- Die Sicherheit und Wirksamkeit von Afrezza bei Patienten mit Rauch wurde nicht festgestellt. Die Verwendung von Afrezza wird bei Patienten, die rauchen oder kürzlich aufgehört haben, nicht zu rauchen, nicht empfohlen.
Dosierung für Afrezza
Lungenfunktionsbewertung vor der Verabreichung
Afrezza ist bei Patienten mit chronischer Lungenerkrankung aufgrund des Risikos für akutes Bronchospasmus bei diesen Patienten kontraindiziert. Vor der Initiierung von Afrezza führen Sie eine medizinische Untersuchung und Spirometrie durch (FEV1) Bei allen Patienten, um potenzielle Lungenerkrankungen zu identifizieren [siehe Kontraindikationen Und WARNUNG AND VORSICHTSMASSNAHMEN ].
Wichtige Verwaltung und Verwerfen von Anweisungen
Verwenden Sie nur Afrezza über orale Inhalation unter Verwendung des Afrezza -Inhalators. Afrezza zu Beginn jeder Mahlzeit verabreichen. Afrezza unter Verwendung einer einzelnen Inhalation pro Patrone verabreichen (wenn die Dosis größer ist als der Inhalt einer einzelnen Patrone mehr als eine Patrone ist erforderlich) [siehe Dosierung und Verwaltung ]. For additional administration instructions on how to use the Afrezza -Inhalator [see Dosierung und Verwaltung ] und sehen Sie die Anweisungen zur Verwendung.
Der Afrezza -Inhalator kann ab dem Datum der ersten Verwendung bis zu 15 Tage verwendet werden. Nach 15 Tagen der Verwendung muss der Inhalator verworfen und durch einen neuen Inhalator ersetzt werden.
Empfohlene Dosierung der Mahlzeitenzeit
Für Insulin -Na ¯ve -Patienten beginnen Patienten zu Beginn jeder Mahlzeit mit 4 Einheiten Afrezza.
Für Patienten, die subkutane Mahlzeiten (prandiale) Insulin verwenden:
- Bestimmen Sie die entsprechende Afrezza -Dosis für jede Mahlzeit, indem Sie mit Abbildung 1 aus der injizierten Insulindosis umwandeln.
- Beim Umschalten von einem anderen Insulin auf Afrezza kann eine andere Insulin -Dosis erforderlich sein, bei der eine erhöhte Häufigkeit der Blutzuckerüberwachung erforderlich ist WARNUNG AND VORSICHTSMASSNAHMEN ].
Für Patienten, die subkutane vorgefertigtes Insulin verwenden:
- Schätzen Sie die injizierte Dosis mit der Mahlzeit, indem die Hälfte der gesamten täglichen vorgefertigten Insulindosis gleichermaßen unter den drei Mahlzeiten des Tages geteilt wird. Beim Umschalten von einem anderen Insulin zu Afrezza kann eine andere Insulindosis erforderlich sein. Beim Umschalten des Insulinregimes eines Patienten erhöht die Häufigkeit der Blutzuckerüberwachung [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
- Konvertieren Sie jede geschätzte injizierte Mahlzeitdosis in eine geeignete Afrezza -Dosis unter Verwendung von Abbildung 1.
- Verwalten Sie die Hälfte der vorgefertigten Dosis der gesamten täglichen Injektion als injizierte basale Insulindosis.
Für Afrezza -Dosen, die den Inhalt einer einzelnen Patrone bei Inhalationen von Mahlzeiten von mehr als einer Patrone überschreiten, sind erforderlich. Um die erforderliche Gesamtdosis der Mahlzeit zu erzielen, verwenden Sie eine Kombination aus 4 -Einheiten -8 -Einheiten- und 12 -Einheiten -Patronen. Beispiele für Patronenkombinationen für Dosen von bis zu 24 Einheiten sind in Abbildung 1 dargestellt. Für Dosen über 24 Einheiten verwenden Kombinationen verschiedener mehrerer Patronen.
Abbildung 1: Mahlzeit Afrezza Startdosis -Conversion -Tabelle
 |
Mahlzeit -Dosierungsmodifikation
- Ändern Sie die Afrezza -Dosierung basierend auf dem Stoffwechselbedarf des Patienten Blutzuckerüberwachungsergebnisse und glykämisches Kontrollziel.
- Dosierungsmodifikationen können bei Änderungen der körperlichen Aktivitätsänderungen in den Essensmustern (d. H. Makronährstoffgehalt oder Timing der Nahrungsaufnahme) Änderungen der Nieren- oder Leberfunktion oder während der akuten Krankheit erforderlich sein [siehe WARNUNG AND VORSICHTSMASSNAHMEN Und Verwendung in bestimmten Populationen ].
- Überwachen Sie sorgfältig die Blutzuckerkontrolle bei Patienten, die hohe Afrezza -Dosen benötigen. Wenn die Blutzuckerkontrolle bei diesen Patienten nicht mit erhöhten Afrezza -Dosen erreicht wird, in denen sie in Betracht ziehen, AFREZZA abzubauen.
Dosierungsmodifikationen für Arzneimittelwechselwirkungen
Dosierungsänderung kann erforderlich sein, wenn:
- Afrezza wird gleichzeitig mit bestimmten Arzneimitteln verwendet, die die Glukoseabsenkung beeinträchtigen und/oder verringern [siehe Wechselwirkungen mit Arzneimitteln ].
- Wechsel von einem anderen Insulin nach Afrezza [siehe Dosierung und Verwaltung Und WARNUNG AND VORSICHTSMASSNAHMEN ]
Verwaltungsanweisungen
Verweisen Sie Patienten für die Verwendung von Anweisungen für detaillierte Anweisungen und Visuals zur Vorbereitung und Speichern von AFREZZA. Verwenden Sie die Afrezza -Patronen; und benutze den Afrezza -Inhalator. Kritische Verabreichungsanweisungen sind wie folgt:
- Halten Sie den Inhalatorspiegel mit dem weißen Mundstück oben und der lila Basis auf der Unterseite, nachdem eine Patrone in den Inhalator eingeführt wurde. Der Verlust des Arzneimitteleffekts kann auftreten, wenn der Inhalator auf den Kopf gestellt wird, der nach dem Einsetzen der Patrone geschüttelt oder fallen gelassen wurde, bevor die Dosis verabreicht wurde. Wenn eines der oben genannten vorliegt, ersetzen Sie die Patrone vor dem Gebrauch.
- Halten Sie den Inhalator vom Mund fern und atmen voll aus.
- Nachdem der Inhalator in den Mund gelegt wurde und die Lippen eine Dichtung bilden, neigen Sie den Inhalator nach unten zum Kinn, während der Kopfniveau hält.
- Mit dem Mund um den Mundstück geschlossen und tief durch den Inhalator einatmen.
- Halten Sie den Atem so lange an und entfernen Sie gleichzeitig den Inhalator aus dem Mund.
- Nachdem er den Atem gehalten hat, atme das Atem aus und atme normal weiter.
Wie geliefert
Dosierungsformen und Stärken
Inhalationspulver: Einwegpatronen mit 4 Einheiten 8 Einheiten oder 12 Einheiten von Insulin menschlich als weißes Pulver, die nur durch orale Inhalation mit dem Afrezza-Inhalator verabreicht werden sollen [siehe Wie geliefert / Lagerung und Handhabung ].
Lagerung und Handhabung
Afrezza (Insulin-menschliches) Inhalationspulver ist als 4-Einheit-Einweg-Kassetten mit 4 Einheiten 8 und 12 Einheiten erhältlich. Drei Patronen sind in einem einzigen Hohlraum eines Blasenstreifens enthalten. Jede Karte enthält 5 Blasenstreifen (jeweils drei Patronen enthält), die durch Perforationen für insgesamt 15 Patronen getrennt sind. Zwei Karten derselben Patronenstärke werden in einem Folienlaminatüberschoben (30 Patronen pro Folienpaket) verpackt.
Die Patronen sind farbcodiert blau für 4 Einheiten grün für 8 Einheiten und gelb für 12 Einheiten. Jede Patrone ist mit Afrezza und 4 Einheiten 8 Einheiten oder 12 Einheiten gekennzeichnet.
Der Afrezza -Inhalator wird individuell in einem klaren Überschreiben verpackt. Der Inhalator ist vollständig mit einer abnehmbaren Mundstücksabdeckung zusammengesetzt. Der Afrezza -Inhalator kann ab dem Datum der ersten Verwendung bis zu 15 Tage verwendet werden. Nach 15 Tagen der Verwendung muss der Inhalator verworfen und durch einen neuen Inhalator ersetzt werden.
Afrezza (Insulin -menschliches) Inhalationspulver ist in den folgenden Konfigurationen erhältlich:
| NDC | Kartuschenstärke | Kassettenmenge pro Stärke | Gesamtmenge an Patronen pro Kit | Gesamteinheiten im Kit | Anzahl der Inhalatoren |
| 47918-874-90 | 4 Einheiten | 90 | 90 | 360 Einheiten | 2 |
| 47918-878-90 | 8 Einheiten | 90 | 90 | 720 Einheiten | 2 |
| 47918-891-90 | 12 Einheiten | 90 | 90 | 1080 Einheiten | 2 |
| 47918-898-18 | 8 Einheiten 12 Einheiten | 90 | 180 | 1800 Einheiten | 2 |
| 47918-880-18 (Titrationspaket) | 4 Einheiten 8 Einheiten | 90 | 180 | 1080 Einheiten | 2 |
| 47918-902-18 (Titrationspaket) | 4 Einheiten 8 Einheiten 12 Einheiten | 60 | 180 | 1440 Einheiten | 2 |
Lagerung
Nicht verwendet: Kühlspeicher 2-8 ° C (36-46 ° F)
| Versiegelte (ungeöffnete) Folienpaket | Kann bis zum Ablaufdatum gespeichert werden* |
| Versiegelte (ungeöffnete) Blasenkartenstreifen | Muss innerhalb von 1 Monat* verwendet werden* |
| * Wenn eine Folienpaket -Blisterkarte oder ein Streifen nicht gekühlt wird, muss der Inhalt innerhalb von 10 Tagen verwendet werden. |
In Verwendung: Raumtemperaturlager 25 ° C (77 ° F) Exkursionen zulässig 15-30 ° C (59-86 ° F)
| Versiegelte (ungeöffnete) Blasenkartenstreifen | Muss innerhalb von 10 Tagen verwendet werden |
| Geöffnete Streifen | Muss innerhalb von 3 Tagen verwendet werden |
Legen Sie keine Blasenkarte und streifen Sie nicht wieder in den Kühlschrank, nachdem Sie bei Raumtemperatur gelagert wurden.
Inhalatorspeicherung
Kühlstöcke oder bei Raumtemperatur 2-25 ° C (36-77 ° F); Exkursionen erlaubt. Der Inhalator kann gekühlt werden, sollte jedoch vor der Verwendung bei Raumtemperatur liegen.
Handhabung
Vor dem Gebrauch sollte die Patronen 10 Minuten bei Raumtemperatur sein.
Hergestellt von: Mannkind Corporation Danbury CT 06810. Überarbeitet: Februar 2023
Nebenwirkungen for Afrezza
Die folgenden schwerwiegenden Nebenwirkungen werden nachstehend und anderswo in der Kennzeichnung beschrieben:
- Akuter Bronchospasmus bei Patienten mit chronischer Lungenerkrankung [siehe WARNUNG AND VORSICHTSMASSNAHMEN ]
- Hypoglykämie [siehe WARNUNG AND VORSICHTSMASSNAHMEN ]
- Rückgang der Lungenfunktion [siehe WARNUNG AND VORSICHTSMASSNAHMEN ]
- Lungenkrebs [siehe WARNUNG AND VORSICHTSMASSNAHMEN ]
- Diabetische Ketoacidose [siehe WARNUNG AND VORSICHTSMASSNAHMEN ]
- Überempfindlichkeitsreaktionen [siehe WARNUNG AND VORSICHTSMASSNAHMEN ]
Klinische Studien Erfahrung
Da klinische Studien unter stark unterschiedlichen Bedingungen durchgeführt werden, die in den klinischen Studien eines Arzneimittels beobachtet werden, können in den klinischen Studien eines anderen Arzneimittels nicht direkt mit den Raten verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die nachstehend beschriebenen Daten spiegeln die Exposition von 3017 Patienten gegenüber AFREZZA wider und umfassen 1026 Patienten mit Typ -1 -Diabetes und 1991 Patienten mit Typ -2 -Diabetes. Die mittlere Expositionsdauer betrug 8,2 Monate für Patienten mit Typ -1 -Diabetes und Patienten mit Typ -2 -Diabetes. In der Gesamtbevölkerung:
- 1874 Patienten wurden 6 Monate lang Afrezza und 724 Patienten mehr als ein Jahr ausgesetzt.
- 620 und 1254 Patienten mit Typ 1 bzw. Typ -2 -Diabetes wurden bis zu 6 Monate AFREZZA ausgesetzt.
- 238 und 486 Patienten mit Typ 1- bzw. Typ -2 -Diabetes wurden mehr als ein Jahr AFREZZA ausgesetzt (mediane Exposition = 1,8 Jahre).
Afrezza wurde in Placebo- und aktiv kontrollierten Versuchen (n = 3 bzw. n = 10) untersucht.
Das Durchschnittsalter der Bevölkerung betrug 50,2 Jahre und 20 Patienten waren älter als 75 Jahre. 51% der Bevölkerung waren Männer; 83% waren weiß 5% waren schwarz oder afroamerikanisch und 2% waren asiatisch; 10% waren hispanisch. Zu Studienbeginn hatte die Typ -1 -Diabetes -Population durchschnittlich 16,6 Jahre Diabetes und hatte einen durchschnittlichen Hba1c von 8,3% und die Typ -2 -Diabetes -Population durchschnittlich 10,7 Jahre und hatte einen durchschnittlichen HbA1c von 8,8%. Zu Studienbeginn gaben 33% der Bevölkerung an, dass 32% eine periphere Neuropathie angaben, und 20% hatten eine Vorgeschichte von Herz -Kreislauf -Erkrankungen.
Tabelle 1 zeigt die Häufigkeit häufiger unerwünschter Reaktionen im Zusammenhang mit der Hypoglykämie im Zusammenhang mit der Verwendung von Afrezza im Pool kontrollierter Studien bei Typ -2 -Diabetes -Patienten. Diese unerwünschten Reaktionen traten zu Studienbeginn nicht häufiger auf AFREZZA auf als auf Placebo und/oder dem Vergleicher und traten bei mindestens 2% der mit AFrezza behandelten Patienten auf.
Tabelle 1: Häufige Nebenwirkungen, die bei ≥ 2% bei Patienten mit Typ -2 -Diabetes mellitus (ohne Hypoglykämie) auftraten, die mit Afrezza behandelt wurden
| Masrazza (n = 1991) | Placebo* (n = 290) | Nicht-Placebo-Komparatoren (n = 1363) | |
| Husten | 25,6% | 19,7% | 5,4% |
| Rachenschmerzen oder Reizung | 4,4% | 3,8% | 0,9% |
| Kopfschmerzen | 3,1% | 2,8% | 1,8% |
| Durchfall | 2,7% | 1,4% | 2,2% |
| Produktiver Husten | 2,2% | 1,0% | 0,9% |
| Ermüdung | 2,0% | 0,7% | 0,6% |
| Brechreiz | 2,0% | 0,3% | 1,0% |
| *Trägerteilchen ohne Insulin wurde als Placebo verwendet [siehe BESCHREIBUNG ]. |
Tabelle 2 zeigt die Häufigkeit häufiger unerwünschter Reaktionen im Zusammenhang mit der Hypoglykämie im Zusammenhang mit der Verwendung von Afrezza im Pool von aktiv kontrollierten Studien bei Typ-1-Diabetes-Patienten. Diese unerwünschten Reaktionen traten zu Studienbeginn nicht häufiger auf Afrezza auf als auf den Komparator und traten bei mindestens 2% der mit Afrezza behandelten Patienten auf.
Tabelle 2: Häufige Nebenwirkungen, die bei ≥ 2% bei Patienten mit Typ -1 -Diabetes mellitus (ohne Hypoglykämie) mit Afrezza auftraten
| Masrazza (n = 1026) | Subkutanes Insulin (n = 835) | |
| Husten | 29,4% | 4,9% |
| Rachenschmerzen oder Reizung | 5,5% | 1,9% |
| Kopfschmerzen | 4,7% | 2,8% |
| Der Lungenfunktionstest nahm ab | 2,8% | 1,0% |
| Bronchitis | 2,5% | 2,0% |
| Harnwegsinfektion | 2,3% | 1,9% |
Hypoglykämie
Hypoglykämie is the most commonly observed adverse reaction in patients using insulin including Masrazza [see WARNUNG AND VORSICHTSMASSNAHMEN ]. The incidence of severe Und non-severe hypoglycemia in Masrazza-treated patients versus placebo-treated patients with type 2 diabetes is shown in Table 3. A hypoglycemic episode was recorded if a patient reported symptoms of hypoglycemia with or without a blood glucose value consistent with hypoglycemia. Severe hypoglycemia was defined as an event with symptoms consistent with hypoglycemia requiring the assistance of another person Und associated with either a blood glucose value consistent with hypoglycemia or prompt recovery after treatment for hypoglycemia.
Tabelle 3: Inzidenz einer schweren und nicht höheren Hypoglykämie in einer placebokontrollierten Studie an Patienten mit Typ-2-Diabetes
| Masrazza (N = 177) | Placebo (N = 176) | |
| Schwere Hypoglykämie | 5,1% | 1,7% |
| Nicht-höhere Hypoglykämie | 67% | 30% |
Husten
Ungefähr 27% der mit Afrezza behandelten Patienten berichteten über Husten, verglichen mit ungefähr 5% der mit dem Vergleich behandelten Patienten. In klinischen Studien war Husten der häufigste Grund für den Absetzen der Afrezza-Therapie (3% der mit AFrezza behandelten Patienten).
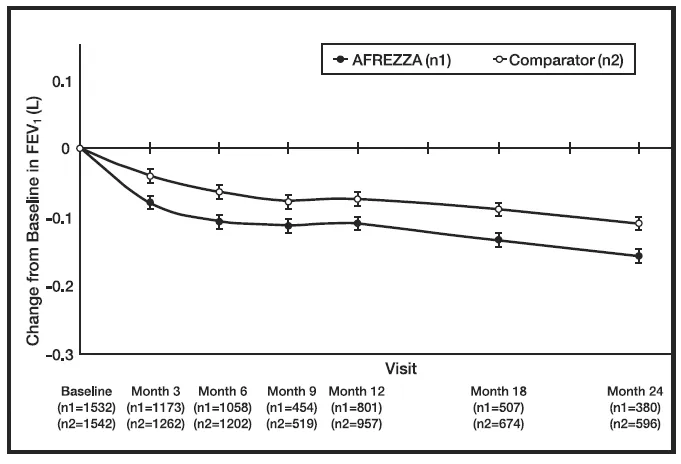
Lungenfunktion sinkt
In klinischen Studien, die bis zu 2 Jahre dauerten, ohne Patienten mit Patienten mit chronischer Lungenerkrankung, die mit AFREZZA behandelt wurden1) im Vergleich zu Patienten, die mit Vergleichs-Anti-Diabetes-Behandlungen behandelt wurden. Der Rückgang trat während der ersten 3 Monate der Therapie auf und bestand über 2 Jahre lang bestehen (Abbildung 2). Ein Rückgang der FEV1 von ≥ 15% traten bei 6% der mit AFrezza behandelten Patienten im Vergleich zu 3% der mit vergleicher behandelten Patienten auf [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Abbildung 2: Mittelwert ( /-se) Änderung der FEV1 (Liter) aus dem Ausgangswert für Diabetes -Patienten vom Typ 1 und Typ 2
 |
Gewichtszunahme
Bei einigen Insulintherapien, einschließlich Afrezza, ist eine Gewichtszunahme aufgetreten. Die Gewichtszunahme wurde auf die anabolen Wirkungen von Insulin und die Abnahme der Glykosurie zurückgeführt. In einer klinischen Studie mit Patienten mit Typ -2 -Diabetes [siehe Klinische Studien ] Bei mit AFrezza behandelten Patienten gab es eine durchschnittliche Gewichtszunahme von 0,49 kg im Vergleich zu einem durchschnittlichen Gewichtsverlust von 1,13 kg bei mit Placebo behandelten Patienten.
Nachmarkterfahrung
Die folgende nachteilige Reaktion wurde während der Verwendung von Afrezza nach der Genehmigung identifiziert. Da diese Reaktionen freiwillig aus einer Population unsicherer Größe berichtet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder ein kausales Verhältnis zur Arzneimittelexposition herzustellen: Bronchospasmus.
Wechselwirkungen mit Arzneimitteln for Afrezza
Medikamente, die das Risiko einer Hypoglykämie erhöhen können
Das Risiko einer Hypoglykämie im Zusammenhang mit der Verwendung von Afrezza kann mit Antidiabetikern ACE -Inhibitoren Angiotensin II -Rezeptorblocker erhöht werden. Die Dosisänderung und eine erhöhte Häufigkeit der Glukoseüberwachung können erforderlich sein, wenn Afrezza gleichzeitig mit diesen Medikamenten verabreicht wird.
Medikamente, die die Blutzuckerabsenkung von Afrezza verringern können
Die Glukoseabsenkung von Afrezza kann verringert werden, wenn sie gleichzeitig mit atypischen Antipsychotika (z. B. Olanzapin und Clozapin) Corticosteroiden Danazol Diuretika Östrogene Glucagon Isoniazid Niacin oralalal -Discoppitin -Progestogene (E.g.g.g. -In -Oralalalalalalalalalalalalalalalalalalalalalalalalalalalalalalalalalalceptives) Progestogene (E.g. -E.g. -E -in -oralalalalaler -Discoutstoffe) Progestogene (E.g. -E.g. Sympathomimetika (z. B. Albuterol -Adrenalin -Terbutalin) und Schilddrüsenhormone. Die Dosisanpassung und eine erhöhte Häufigkeit der Glukoseüberwachung können erforderlich sein, wenn Afrezza gleichzeitig mit diesen Medikamenten verabreicht wird.
Medikamente, die die Blutzuckerabsenkung von Afrezza erhöhen oder verringern können oder verringern können
Die Glukoseabsenkungseffekt von Afrezza kann erhöht oder verringert werden, wenn sie mit Alkohol-Beta-Blockern Clonidin und Lithiumsalzen zusammengefasst werden. Pentamidin kann zu einer Hypoglykämie führen, auf die manchmal eine Hyperglykämie folgen kann. Die Dosisänderung und eine erhöhte Häufigkeit der Glukoseüberwachung können erforderlich sein, wenn Afrezza gleichzeitig mit diesen Medikamenten verabreicht wird.
Medikamente, die Hypoglykämiezeichen und Symptome beeinflussen können
Die Anzeichen und Symptome einer Hypoglykämie können abgestumpft werden, wenn Beta-Blocker-Clonidin-Guanethidin und Reserpin gleichzeitig mit Afrezza verabreicht werden.
Warnungen für Afrezza
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Abschnitt.
Vorsichtsmaßnahmen für Afrezza
Akuter Bronchospasmus bei Patienten mit chronischer Lungenerkrankung
Aufgrund des Risikos eines akuten Bronchospasmus -Afrezza ist bei Patienten mit chronischer Lungenerkrankung wie Asthma oder COPD kontraindiziert [siehe Kontraindikationen ]. Before initiating therapy with Masrazza evaluate all patients with a medical history physical examination Und spirometry (FEV1) potenzielle zugrunde liegende Lungenerkrankung zu identifizieren.
Akuter Bronchospasmus wurde bei mit Afrezza behandelten Patienten mit Asthma und COPD beobachtet. In einer Studie an Patienten mit Asthma, deren Bronchodilatatoren vorübergehend zur Bewertung der Beurteilung der Bronchokonstriktion und der Keuchen nach der Afrezza -Dosierung zurückgehalten wurden, wurde in 29% (5 von 17) und 0% (0 von 13) von Patienten mit und ohne Diagnose von Asthma berichtet. In dieser Studie ein mittlerer Rückgang der FEV1 von 400 ml wurden 15 Minuten nach einer einzigen Afrezza -Dosis bei Patienten mit Asthma beobachtet. In einer Untergruppenstudie an Patienten mit COPD (n = 8) ist ein durchschnittlicher Rückgang der FEV1 von 200 ml wurden 18 Minuten nach einer einzigen Afrezza -Dosis beobachtet.
Hypoglykämie Or Hyperglycemia With Changes In Insulin Regimen
Die Glukoseüberwachung ist für Patienten, die eine Insulintherapie erhalten, von wesentlicher Bedeutung. Änderungen der Insulinstärke -Herstellertyp oder -verwaltungsmethode können die glykämische Kontrolle beeinflussen und für Hypoglykämie prädisponieren [siehe WARNUNG AND VORSICHTSMASSNAHMEN ] oder Hyperglykämie. Diese Änderungen sollten unter enger medizinischer Aufsicht vorgenommen werden, und die Häufigkeit der Blutzuckerüberwachung sollte erhöht werden. Bei Patienten mit Typ -2 -Diabetes -Dosierungsmodifikationen einer gleichzeitigen oralen antidiabetischen Behandlung kann erforderlich sein [siehe Wechselwirkungen mit Arzneimitteln ].
Hypoglykämie
Die Glukoseüberwachung ist für Patienten, die eine Insulintherapie erhalten, von wesentlicher Bedeutung. Hypoglykämie ist die häufigste Nebenwirkungen, die mit Insulinen einschließlich Afrezza verbunden ist. Eine schwere Hypoglykämie kann zu Anfällen führen, die lebensbedrohlich sein oder zum Tod führen können. Hypoglykämie kann die Konzentrationsfähigkeit und die Reaktionszeit beeinträchtigen; Dies kann in Situationen, in denen diese Fähigkeiten wichtig sind (z. B. Fahren oder Betrieb anderer Maschinen), eine Person und andere gefährdet sind.
Der Zeitpunkt der Hypoglykämie spiegelt normalerweise das Zeit-Action-Profil der verabreichten Insulinformulierung wider. Afrezza hat ein ausgeprägtes Zeitaktionsprofil [siehe Klinische Pharmakologie ] was den Zeitpunkt der Hypoglykämie beeinflusst. Eine Hypoglykämie kann plötzlich auftreten und die Symptome können sich bei den Patienten bei demselben Patienten im Laufe der Zeit ändern. Das symptomatische Bewusstsein für Hypoglykämie kann bei Patienten mit langjährigem Diabetes bei Patienten mit Diabetika bei Patienten bei Patienten mit bestimmten Medikamenten weniger ausgeprägt sein [siehe Wechselwirkungen mit Arzneimitteln ] oder bei Patienten mit einer rezidivierenden Hypoglykämie.
Faktoren, die das Risiko einer Hypoglykämie erhöhen können Wechselwirkungen mit Arzneimitteln ]. Patients with renal or hepatic impairment may be at higher risk of hypoglycemia [see Verwendung in bestimmten Populationen ].
Risikominderungsstrategien für Hypoglykämie
Patienten und Betreuer sollten gebildet werden, um Hypoglykämie zu erkennen und zu behandeln. Die Selbstüberwachung von Blutzucker spielt eine wesentliche Rolle bei der Prävention und Behandlung von Hypoglykämie. Bei Patienten mit höherem Risiko für Hypoglykämie und Patienten, die das symptomatische Bewusstsein für eine Hypoglykämie verringert haben, wird eine erhöhte Häufigkeit der Blutzuckerüberwachung empfohlen.
Rückgang der Lungenfunktion
Masrazza causes a decline in pulmonary function over time as measured by FEV1. In klinischen Studien ohne Patienten mit chronischer Lungenerkrankung und bis zu 2 Jahren mit AFrezza -behandelten Patienten hatten eine kleine [40 ml (95% CI: -80 -1)], aber größere FEV1 Rückgang als mit Vergleich behandelte Patienten. Der Fev1 Der Rückgang wurde innerhalb der ersten 3 Monate festgestellt und bestand über die gesamte Therapiedauer (bis zu 2 Jahre Beobachtung). In dieser Bevölkerung die jährliche FEV -Rate1 Der Rückgang schien sich mit einer erhöhten Nutzungsdauer nicht zu verschlechtern. Die Auswirkungen von Afrezza auf die Lungenfunktion für die Behandlungsdauer länger als 2 Jahre wurden nicht festgestellt. In Langzeitstudien gibt es nicht genügend Daten, um Schlussfolgerungen hinsichtlich der Umkehrung der Auswirkungen auf FEV zu ziehen1 Nach Abbruch von Afrezza. Die beobachteten Veränderungen in FEV1 waren bei Patienten mit Typ 1 und Typ -2 -Diabetes ähnlich.
Bewerten Sie die Lungenfunktion (z. B. Spirometrie) zu Studienbeginn nach den ersten 6 Monaten der Therapie und danach jährlich selbst in Abwesenheit von Lungensymptomen. Bei Patienten mit einem Rückgang von ≥ 20% bei FEV1 Aus dem Ausgangswert berücksichtigen Sie Afrezza. Betrachten Sie eine häufigere Überwachung der Lungenfunktion bei Patienten mit Lungensymptomen wie dem Keuchen von Bronchospasmus -Atemschwierigkeiten oder anhaltend oder wiederkehrenden Husten. Wenn die Symptome Afrezza bestehen [siehe Nebenwirkungen ].
Lungenkrebs
In klinischen Studien wurden bei Patienten, die AFrezza ausgesetzt waren, zwei Fälle von Lungenkrebs, die in kontrollierten Studien und einer in unkontrollierten Studien (2 Fälle in 2750 Patientenjahre der Exposition) beobachtet wurden, während bei Patienten, die den Vergleichen ausgesetzt waren, keine Fälle von Lungenkrebs beobachtet wurden (0 Fälle bei 2169 Patientenjahre). In beiden Fällen wurde eine Vorgeschichte des starken Tabakkonsums als Risikofaktor für Lungenkrebs identifiziert. Zwei weitere Fälle von Lungenkrebs (Plattenepithelzellen- und Lungenblastom) traten bei Nichtrauchern, die Afrezza ausgesetzt waren, auf und wurden nach Abschluss klinischer Studien von den Forschern gemeldet. Diese Daten reichen nicht aus, um festzustellen, ob Afrezza Auswirkungen auf Lungen- oder Atemwegstumoren hat.
Bei Patienten mit aktivem Lungenkrebs berücksichtigen eine Vorgeschichte von Lungenkrebs oder bei Patienten mit dem Risiko für Lungenkrebs, ob die Vorteile des Afrezza -Gebrauchs dieses potenzielle Risiko überwiegen.
Diabetische Ketoacidose
In klinischen Studien, die Patienten mit Diabetes-Ketoazidose vom Typ 1-Diabetes (DKA) einschreiben, war bei mit AFrezza behandelten Patienten (0,43%; n = 13) häufiger als bei mit vergleicher behandelten Patienten (0,14%; n = 3). Patienten mit Typ -1 -Diabetes sollten Afrezza immer in Kombination mit Basalinsulin verwenden. Bei Patienten, bei denen ein Risiko für DKA wie Patienten mit einer akuten Erkrankung oder Infektion besteht, erhöhen die Häufigkeit der Glukoseüberwachung und in Betracht, Afrezza abzubauen und Insulin mithilfe eines alternativen Verabreichungswegs zu geben.
Überempfindlichkeitsreaktionen
Bei Insulinprodukten, einschließlich Afrezza, können schwere lebensbedrohliche verallgemeinerte Allergien einschließlich Anaphylaxie auftreten.
Wenn Überempfindlichkeitsreaktionen auftreten Nebenwirkungen ]. Masrazza is contraindicated in patients who have had hypersensitivity reactions to Masrazza or any of its excipients [see Kontraindikationen ].
Hypokaliämie
Alle Insulinprodukte, einschließlich Afrezza, führen zu einer Verschiebung des Kaliums vom extrazellulären zum intrazellulären Raum, der möglicherweise zu einer Hypokaliämie führt. Eine unbehandelte Hypokaliämie kann zu einer ventrikulären Arrhythmie und dem Tod von Atemwegslähmung führen.
Überwachen Sie den Kaliumspiegel bei mit Afrezza behandelten Patienten mit dem Risiko einer Hypokaliämie (z. B. Patienten mit Kaliumlower-Medikamenten, die Medikamente einnehmen, die für Serumkaliumkonzentrationen empfindlich sind, und Patienten, die intravenös verabreichtes Insulin erhalten).
Flüssigkeitsretention und Herzinsuffizienz mit gleichzeitiger Verwendung von PPAR-Gamma-Agonisten
Thiazolidinierte (TZDs), die Peroxisom-Proliferator-aktivierte Rezeptor (PPAR) -Gamma-Agonisten sind, können eine dosisbedingte Flüssigkeitsretention verursachen, insbesondere wenn sie in Kombination mit Insulin verwendet werden. Die Flüssigkeitsretention kann zu Herzinsuffizienz führen oder verschärfen.
Patienten, die mit Insulin behandelt wurden, einschließlich Afrezza und ein PPAR-Gamma-Agonist, sollten für Anzeichen und Symptome einer Herzinsuffizienz beobachtet werden. Wenn sich Herzinsuffizienz entwickelt, sollte dies gemäß den aktuellen Pflegestandards verwaltet werden, und die Abnahme oder Dosisreduktion des PPAR-Gamma-Agonisten sollte berücksichtigt werden.
Patientenberatungsinformationen
Raten Sie dem Patienten, die von der FDA zugelassene Patientenkennzeichnung zu lesen ( Medikamentenhandbuch Und Instructions for Use ).
Weisen Sie die Patienten an, Afrezza nur mit dem Afrezza -Inhalator zu verwenden.
Häufige Nebenwirkungen
Informieren Sie die Patienten, dass die häufigsten Nebenwirkungen, die mit der Verwendung von Afrezza verbunden sind, Hypoglykämie -Husten- und Rachenschmerzen oder Reizungen sind.
Schwangerschaft
Beraten Sie Frauen mit Diabetes, ihren Arzt zu informieren, ob sie schwanger sind oder planen, während der Verwendung von Afrezza schwanger zu werden.
Akuter Bronchospasmus bei Patienten mit chronischer Lungenerkrankung
Beraten Sie den Patienten, dass sie ihren Gesundheitsdienstleister sofort zur Beurteilung melden sollten, wenn sie nach Einatmen von Afrezza Schwierigkeiten haben.
Hypoglykämie
Weisen Sie Patienten über Selbstmanagementverfahren ein, einschließlich der ordnungsgemäßen Inhalationstechnik der Glukose und der ordnungsgemäßen Inhalationstechnik und der Behandlung von Hypoglykämie und Hyperglykämie, insbesondere bei der Einleitung einer Afrezza-Therapie. Weisen Sie die Patienten über die Behandlung von besonderen Situationen wie interkürze Erkrankungen (Krankheitsstress oder emotionale Störungen) an, eine unzureichende oder übersprungene Insulindosis versehentlich verabreichte Verabreichung einer erhöhten Insulindosis unzureichende Nahrungsaufnahme oder übersprungene Mahlzeiten.
Weisen Sie die Patienten über die Behandlung von Hypoglykämie an. Informieren Sie die Patienten, dass ihre Fähigkeit, sich zu konzentrieren und zu reagieren, aufgrund einer Hypoglykämie beeinträchtigt werden kann. Beraten Sie Patienten mit häufiger Hypoglykämie oder reduzierter oder fehlender Warnzeichen von Hypoglykämie, um beim Fahren oder Betriebsmaschinen Vorsicht zu verwenden [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Rückgang der Lungenfunktion
Informieren Sie die Patienten, dass Afrezza einen Rückgang der Lungenfunktion verursachen kann [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Lungenkrebs
Informieren Sie die Patienten, um sofort Anzeichen oder Symptome zu melden, die möglicherweise mit Lungenkrebs zusammenhängen [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Diabetische Ketoacidose
Weisen Sie die Patienten an, ihren Blutzucker während der Krankheitsinfektion und in anderen Risikosituationen für diabetische Ketoacidose sorgfältig zu überwachen und ihren Gesundheitsdienstleister zu kontaktieren, wenn sich ihre Blutzuckerkontrolle verschlimmert [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Überempfindlichkeitsreaktionen
Beraten Sie den Patienten, dass Überempfindlichkeitsreaktionen bei der Insulintherapie einschließlich Afrezza auftreten können. Patienten über die Symptome von Überempfindlichkeitsreaktionen informieren [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Nichtklinische Toxikologie
Karzinogenese -Mutagenese -Beeinträchtigung der Fruchtbarkeit
In einer 104-wöchigen Karzinogenitätsstudie erhielten Ratten Dosen von bis zu 46 mg/kg/Tag des Trägers und bis zu 1,23 mg/kg/Tag Insulin durch Naseninhalation. Es wurde keine erhöhte Inzidenz von Tumoren bei systemischen Expositionen beobachtet, die dem Insulin in einer täglichen Afrezza -Dosis von 99 mg entspricht, basierend auf einem Vergleich der relativen Körperoberflächen zwischen den Arten.
In einer 26-wöchigen Karzinogenitätsstudie bei transgenen Mäusen (TG-Ras-H2) wurde keine erhöhte Inzidenz von Tumoren beobachtet, die Dosen von bis zu 75 mg/kg/Tag des Trägers und bis zu 5 mg/kg/Tag Afrezza beobachtet haben.
Masrazza was not genotoxic in Ames bacterial mutagenicity assay Und in the chromosome aberration assay using human peripheral lymphocytes with or without metabolic activation. The carrier alone was not genotoxic in the in vivo mouse micronucleus assay.
In der Fruchtbarkeitsstudie an männlichen und weiblichen Ratten bei subkutanen Dosen von 10 30 und 100 mg/kg/Tag des Trägers (Fahrzeug ohne Insulin) hatten keine nachteiligen Auswirkungen auf die männliche Fruchtbarkeit bei Dosen von bis zu 100 mg/kg/Tag. Bei weiblichen Ratten, die 2 Wochen vor der Paarung bis zum Schwangerschaftstag 7 dosierten, gab es einen Verlust vor und nach der Implantation bei 100 mg/kg/Tag, jedoch nicht bei 30 mg/kg/Tag (21-mal bzw. 6-mal die menschliche systemische Exposition bei einer täglichen Dosis von 99 mg AFrezza).
Verwendung in bestimmten Populationen
Schwangerschaft
Risikozusammenfassung
Begrenzte verfügbare Daten mit Afrezza-Anwendung bei schwangeren Frauen reichen nicht aus, um die drogenassoziierten Risiken für unerwünschte Entwicklungsergebnisse zu bestimmen. Verfügbare Informationen aus veröffentlichten Studien mit menschlichem Insulin während der Schwangerschaft haben keinen klaren Zusammenhang mit menschlichem Insulin und unerwünschten Entwicklungsergebnissen berichtet (siehe Daten ). There are risks to the mother Und fetus associated with poorly controlled diabetes in pregnancy (see Klinische Überlegungen ). In animal reproduction studies there were no adverse developmental outcomes with subcutaneous administration of carrier particles (vehicle without insulin) to pregnant rats during organogenesis at doses 21 times the human daily dose of 99 mg Masrazza based on AUC (see Daten ).
Das geschätzte Hintergrundrisiko für größere Geburtsfehler beträgt 6-10% bei Frauen mit vorkleinernem Diabetes mit Hba1c> 7 und wurde bei Frauen mit Hba1c> 10 bis zu 20 bis 25% berichtet. Das geschätzte Hintergrundrisiko einer Fehlgeburt für die angegebene Bevölkerung ist unbekannt. In der US-allgemeinen Bevölkerung beträgt das geschätzte Hintergrundrisiko für größere Geburtsfehler und eine Fehlgeburt bei klinisch anerkannten Schwangerschaften 2-4% bzw. 15 bis 20%.
Klinische Überlegungen
Krankheitsassoziierte mütterliche und/oder embryo/fetale Risiko
Schlecht kontrollierter Diabetes in der Schwangerschaft erhöht das mütterliche Risiko für diabetische Ketoazidose vor der Eklampsie spontane Abtreibungen Frühgeborene Stille und Entbindungskomplikationen. Schlecht kontrollierter Diabetes erhöht das fetale Risiko für schwere Geburtsfehler, die noch Geburt und Makrosomie-verbundene Morbidität.
Daten
Menschliche Daten
Bei schwangeren Frauen gibt es nur begrenzte Daten mit Afrezza. Veröffentlichte Daten berichten nicht über eine klare Assoziation mit menschlichem Insulin und schwerwiegenden Geburtsfehlern Fehlgeburt oder unerwünschten Ergebnisse der Mutter oder des Fötus, wenn das menschliche Insulin während der Schwangerschaft verwendet wird. Diese Studien können jedoch nicht definitiv das Fehlen eines Risikos aufgrund methodischer Einschränkungen, einschließlich kleiner Stichprobengröße und mangelnder Verblindung, feststellen.
Tierdaten
Bei schwangeren Ratten, die subkutane Dosen von 10 30 und 100 mg/kg/Tag der Trägerpartikel (Vehikel ohne Insulin) von Schwangerschaftstag 6 bis 17 (Organogenese) verabreicht wurden, wurden bei Dosen bis zu 100 mg/kg/Tag (21 -fache der menschlichen systemischen Exposition bei einer täglichen Dosen von 99 mg AFREZCA) keine Hauptfehlbildungen beobachtet.
Bei schwangeren Kaninchen, die subkutane Dosen von 2 10 und 100 mg/kg/Tag der Trägerpartikel (Vehikel ohne Insulin) von Schwangerschaftstag 7 bis 19 (Organogenese), wurden in allen Dosisgruppen (bei der menschlichen systemischen Exposition nach einer täglichen Dosis von 99 mg Afreza basierend auf AUC) unerwünschte mütterliche Auswirkungen beobachtet.
Bei schwangeren Ratten, die subkutane Dosen von 10 30 und 100 mg/kg/Tag mit Trägerpartikeln (Vehikel ohne Insulin) von Schwangerschaftstag 7 bis zum Laktationstag 20 (Absetzen) gegeben wurden, verringerten die Epididymis, und die Testergewichte wurden bei F1 -männlichen Nachkommen jedoch keine Abnutzung des Fruchtbarkeits. Das Human wurde beobachtet. Das Lernen von F1 wurde bei F1 beobachtet. systemische Exposition bei einer täglichen Dosis von 99 mg Afrezza basierend auf AUC).
Stillzeit
Risikozusammenfassung
Es gibt keine Daten zum Vorhandensein von Afrezza in der Muttermilch die Auswirkungen auf das gestillte Kind oder die Auswirkungen auf die Milchproduktion. Eine kleine veröffentlichte Studie berichtete, dass exogenes subkutanes Insulin in der Muttermilch vorhanden war. Es wurden keine nachteiligen Auswirkungen bei Säuglingen festgestellt. Die Trägerpartikel sind in Rattenmilch vorhanden (siehe Daten ). Potential adverse reactions that are related to inhalational administration of Masrazza are unlikely to be associated with potential exposure of Masrazza through breast milk. The developmental Und health benefits of breastfeeding should be considered along with the mother’s clinical need for Masrazza Und any potential adverse effects on the breastfed infant from Masrazza or from the underlying maternal condition.
Daten
Die subkutane Verabreichung des Trägerpartikels bei laktierenden Ratten führte zu einer Ausscheidung des Trägerpartikels in Rattenmilch bei Konzentrationen, die ungefähr 10% der Mütterexposition betrugen. Angesichts der Ergebnisse der Rattenstudie ist es sehr wahrscheinlich, dass Insulin und Träger in Afrezza in der Muttermilch ausgeschieden werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Afrezza zur Verbesserung der glykämischen Kontrolle bei pädiatrischen Patienten mit Diabetes mellitus wurde nicht festgestellt. Afrezza wurde bei pädiatrischen Patienten nicht untersucht.
Geriatrische Verwendung
In den afrezza klinischen Studien waren 671 (12%) Patienten älter als 65 Jahre, von denen 42 (0,8%) 75 Jahre oder älter waren. In diesen Studien waren 381 (13%) der mit AFrezza behandelten Patienten 65 Jahre oder älter, von denen 20 (0,7%) 75 Jahre oder älter waren. Es wurden keine allgemeinen Unterschiede in Bezug auf die Wirksamkeit von Afrezza zwischen den Patienten von 65 Jahren und älteren und jüngeren erwachsenen Patienten beobachtet [siehe Klinische Studien ]. Clinical studies of Masrazza did not include sufficient numbers of patients 65 years of age Und older to determine whether there were differences in safety between these patients Und younger adult patients.
Pharmakokinetische und pharmakodynamische Studien zur Bewertung der Auswirkung des Alters auf die Pharmakokinetik oder Pharmakodynamik auf den Insulin -Menschen wurden nicht durchgeführt.
Hepatische Beeinträchtigung
Die Wirkung einer Leberbeeinträchtigung auf die Pharmakokinetik von Afrezza wurde nicht untersucht. Bei mit Afrezza behandelten Patienten mit Leberbeeinträchtigung kann eine häufige Glukoseüberwachung und eine niedrigere Dosierung erforderlich sein [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Nierenbehinderung
Die Auswirkung der Nierenbeeinträchtigung auf die Pharmakokinetik von Afrezza wurde nicht untersucht. Einige Studien mit menschlichem Insulin haben bei Patienten mit Nierenversagen erhöhte Zirkulationsspiegel von Insulin gezeigt. Bei mit Afrezza behandelten Patienten mit Nierenbeeinträchtigung kann eine häufige Glukoseüberwachung und eine niedrigere Dosierung erforderlich sein [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Überdosierungsinformationen für Afrezza
Überschüssige Insulinverabreichung kann Hypoglykämie und Hypokaliämie verursachen [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
Leichte Hypoglykämie -Episoden aufgrund von Insulinüberdosierung können normalerweise mit oraler Glukose behandelt werden. Es können Anpassungen der Drogendosis -Mahlzeiten oder der Bewegung erforderlich sein.
Schwere Hypoglykämie -Episoden (aufgrund von Insulinüberdosis) mit Koma -Anfalls oder neurologischer Beeinträchtigung können mit intramuskulärem oder subkutanem Glucagon oder konzentrierter intravenöser Glucose behandelt werden. Nach einer offensichtlichen klinischen Erholung durch die fortgesetzte Beobachtung der Hypoglykämie und eine zusätzliche Kohlenhydrataufnahme können erforderlich sein, um ein Wiederauftreten einer Hypoglykämie zu vermeiden. Hypokaliämie sollte angemessen korrigiert werden.
Kontraindikationen für Afrezza
Masrazza is contraindicated:
- Während Episoden von Hypoglykämie [siehe WARNUNG AND VORSICHTSMASSNAHMEN ].
- Chronische Lungenerkrankungen wie Asthma oder chronisch obstruktive Lungenerkrankung (COPD) aufgrund des Risikos eines akuten Bronchospasmus WARNUNG AND VORSICHTSMASSNAHMEN ]
- Überempfindlichkeit gegen normales menschliches Insulin oder einen der Hilfsstoffe in Afrezza [siehe WARNUNG AND VORSICHTSMASSNAHMEN ]
Klinische Pharmakologie for Afrezza
Wirkungsmechanismus
Insulin senkt den Blutzuckerspiegel bei erwachsenen Patienten mit Diabetes mellitus durch Stimulierung der peripheren Glukoseaufnahme durch Skelettmuskel und Fett und durch Hemmung der Leberglukoseproduktion. Insulin hemmt die Lipolyse in Adipozyten die Proteolyse und verbessert die Proteinsynthese.
Pharmakodynamik
Der zeitliche Verlauf der Insulinwirkung (d. H. Glukoseabsenkung) kann bei verschiedenen Patienten oder innerhalb desselben Patienten erheblich variieren. Das durchschnittliche pharmakodynamische Profil [d.h. Glukoseabsenkungseffekt, gemessen durch Glukoseinfusionsrate (GIR) im Laufe der Zeit in einer euglykämischen Klemmstudie] nach Verabreichung einer einzelnen Afrezza -Dosis von 4 12 und 48 Einheiten bei 30 Patienten mit Typ -1 -Diabetes ist in Abbildung 3 (a) dargestellt. Die Schlüsselmerkmale in Bezug auf das Timing der Effekte sind in Tabelle 4 beschrieben.
Tabelle 4: Zeitpunkt des Insulin -Effekts (d. H. Mittelwert Pharmakodynamikeffekt) nach Verabreichung einer einzelnen Afrezza -Dosis bei Patienten (n = 30) mit Typ -1 -Diabetes mellitus
| Parameter für den Insulineffekt | Masrazza 4 Einheiten | Masrazza 12 Einheiten | Masrazza 48 Einheiten |
| Zeit bis zum ersten messbaren Effekt | ~ 12 Minuten | ~ 12 Minuten | ~ 12 Minuten |
| Zeit bis zum Spitzenffekt | ~ 35 Minuten | ~ 45 Minuten | ~ 55 Minuten |
| Zeit für die Rückkehr zur Basislinie | ~ 90 Minuten | ~ 180 Minuten | ~ 270 Minuten |
Abbildung 3: Ergebnisse nach Verabreichung von Afrezza 4 12 und 48 Einheiten bei Patienten mit T1DM (n = 30) a) mittlerer Insulineffekt (basic-korrigierte Glukose-Infusionsrate); und b) pharmakokinetisch (gradlinienkorrigierte Seruminsulinkonzentrationsprofile)
 |
Im Durchschnitt stieg der pharmakodynamische Effekt von Afrezza, gemessen als Fläche unter der Glukose -Infusionsrate - Zeitkurve (AUC GIR) mit Dosen bis zu 48 Einheiten (106 387 bzw. 1581 mg/kg für 4 12 bzw. 48 Einheiten Dosen) linear.
Die intrapatienten Variabilität von AUC GIR und GIRRAX betrug ungefähr 28% (95% CI 21-42%) bzw. 27% (95% CI 20- 40%).
Pharmakokinetik
Die Fläche unter der Plasmakonzentration gegenüber der Zeitkurve (AUC) von Insulin erhöhte die Dosis proportional bis zu 48 Einheiten. Die intrapatienten Variabilität der AUC- und Spitzenkonzentration (CMAX) von Insulin betrug ungefähr 16% (95% CI 12-23%) bzw. 21% (95% CI 16-30%).
Absorption
Die pharmakokinetischen Profile für oral inhalierte Afrezza 4 12 und 48 Einheiten aus einer Studie an 30 Patienten mit Typ -1 -Diabetes sind in 5 (b) dargestellt. Die Zeit bis zur maximalen Seruminsulinkonzentration (TMAX) lag zwischen 10 und 20 Minuten nach oralem Einatmen von 4 bis 48 Afrezza-Einheiten.
Beseitigung
Die scheinbare terminale Halbwertszeit lag zwischen 120 und 206 Minuten. Die Seruminsulinkonzentrationen nahmen um ungefähr 60 bis 240 Minuten auf die Grundlinie ab.
Stoffwechsel und Ausscheidung
Der Stoffwechsel und die Ausscheidung von Afrezza sind vergleichbar mit normalem menschlichem Insulin.
Trägerpartikel
Klinische Pharmakologiestudien zeigten, dass Trägerpartikel [siehe BESCHREIBUNG ] werden nicht metabolisiert und im Urin nach der Lungenabsorption unverändert. Nach oralem Einatmen von Afrezza wurde ein Mittelwert von 39% der inhalierten Dosis von Trägerpartikeln auf die Lunge verteilt und ein Mittelwert von 7% der Dosis verschluckt. Die verschluckte Fraktion wurde nicht aus dem GI -Trakt absorbiert und in den Kot unverändert unverändert.
Arzneimittelinteraktionsstudien
Bronchodilatoren und inhalierte Steroide
Albuterol erhöhte das AUC -Insulin nach der Verabreichung von Afrezza bei Patienten mit Asthma um 25% [siehe Wechselwirkungen mit Arzneimitteln ]. Masrazza is contraindicated in patients with asthma.
In einer Studie an gesunden Freiwilligen wurde keine signifikante Änderung der Insulinexposition beobachtet, wenn nach der Verabreichung von Afrezza Fluticason verabreicht wurde.
Immunogenität
Die beobachtete Inzidenz von Anti-Drogen-Antikörpern hängt stark von der Empfindlichkeit und Spezifität des Assays ab. Unterschiede in den Assay-Methoden schließen aussagekräftige Vergleiche der Inzidenz von Anti-Drogen-Antikörpern in den nachstehend beschriebenen Studien aus, die mit der Inzidenz von Anti-Drogen-Antikörpern in anderen Studien beschrieben wurden, einschließlich der von Insulin- oder anderen Insulin-menschlichen Produkten.
Bei Patienten, die mit Afrezza behandelt wurden, wurden eine Erhöhung der Anti-Insulin-Antikörperkonzentrationen beobachtet. Bei Patienten, die mit AFREZZA behandelt wurden, wurden erhöhter Anstieg der Anti-Insulin-Antikörper beobachtet als bei Patienten, die mit subkutan injiziertem Insulin von Mahlzeiten behandelt wurden. Es gab keine klinisch signifikante Wirkung von Anti-Drogen-Antikörpern auf die Sicherheit oder Wirksamkeit (gemessen durch Hba1c- und Nüchternplasmaglucose) von Afrezza über die Behandlungsdauer der Studien, die sich um 3 bis 24 Monate ausspazieren.
Klinische Studien
Überblick über klinische Studien von Afrezza bei Erwachsenen für Diabetes mellitus
Masrazza has been studied in adults with type 1 diabetes in combination with basal insulin. The efficacy of Masrazza in combination with basal insulin in type 1 diabetes patients was compared to insulin aspart in combination with basal insulin.
Masrazza has been studied in adults with type 2 diabetes in combination with oral antidiabetic drugs. The efficacy of Masrazza in type 2 diabetes patients was compared to placebo inhalation.
Erwachsene mit Typ -1 -Diabetes
Patienten mit unzureichend kontrollierter Typ-1-Diabetes nahmen an einer 24-wöchigen aktiv gesteuerten Studie mit offenem Label teil, um den Glukoseabsenkungseffekt von Mahlzeiten-Afrezza zu bewerten, die in Kombination mit einem basalen Insulin verwendet wurden. Nach einer 4-wöchigen basalen Insulin-Optimierungsperiode wurden 344 Patienten durch orale Inhalation (n = 174) oder Insulin-Aspart bei jeder Mahlzeit des Tages durch orale Inhalation (n = 174) oder Insulin-Aspart randomisiert. Alle Patienten erhielten Basalinsulin. In den ersten 12 Wochen wurden Insulindosen von Mahlzeiten auf glykämische Ziele titriert und in den letzten 12 Wochen der Studie stabil gehalten.
Ergebnisse
In Woche 24 lieferte die Behandlung mit Mahlzeiten mit AFREZZA und Basalinsulin eine durchschnittliche Verringerung des Hba1c, die die vorgegebene Nicht-Unfertigungsmarge von 0,4%erfüllte. Afrezza und Basalinsulin lieferten eine weniger HbA1c -Reduktion als Insulin -Aspart und Basalinsulin, und der Unterschied war statistisch signifikant. Weitere Patienten in der Insulin -Aspart- und Basalinsulingruppe erreichten das HbA1c -Ziel von ≤ 7% (Tabelle 5).
Tabelle 5: Ergebnisse in Woche 24 in einer aktiv gesteuerten Studie über Mahlzeiten-Afrezza plus Basalinsulin bei Erwachsenen mit Typ-1-Diabetes
| Wirksamkeitsparameter | Masrazza + Basal Insulin (N = 174) | Insulin -Aspart -Basalinsulin (N = 170) |
| Halc (%) | ||
| Grundlinie (angepasstes Mittelwerta) | 7.94 | 7.92 |
| Wechseln Sie vom Ausgangswert (angepasste Mittelwertb) | -0.21 | -0.40 |
| Unterschied zum Insulin -Aspart (angepasster Mittelwertab) (95%) | 0,19 (0,02 0,36) | |
| Prozentsatz der Patienten, die Hbalc ≤ 7% erreichenc | 14% | 27% |
| Fastenplasma -Glukose (Mg/DL) | ||
| Grundlinie (angepasstes Mittelwerta) | 153.9 | 151.6 |
| Wechseln Sie vom Ausgangswert (angepasster Mittelwerta b) | -25.3 | 10.2 |
| Unterschied zum Insulin -Aspart (angepasster Mittelwerta b) (95%) | -35.4 (-56,3 -14.6) | |
| a Der angepasste Mittelwert wurde unter Verwendung eines gemischten Modells wiederholten Messungen (MMRM) mit Hba1c oder FPG als abhängige Variable und Behandlungsbesuchsregion Basalinsulinschicht und Behandlung durch Besuch der Wechselwirkung als feste Faktoren und entsprechende Basislinie als Kovariate erhalten. Eine Autoregression (1) [Ar (1)] Kovarianzstruktur wurde verwendet. b Daten at 24 weeks were available from 131 (75%) Und 150 (88%) patients rUndomized to the Masrazza Und insulin aspart groups respectively. c Der Prozentsatz wurde basierend auf der Anzahl der Patienten berechnet, die in die Studie randomisiert wurden. |
Erwachsene mit Typ -2 -Diabetes
Insgesamt 479 erwachsene Patienten mit Typ-2-Diabetes, die auf optimaler/maximal tolerierter Dosen von nur 2 oder mehr oralen Antidiabetikern (OAD) ausgelöst wurden, nahmen an einer 24-wöchigen Doppelblind-Placebo-kontrollierten Studie teil. Nach einer 6-wöchigen Laufzeit wurden 353 Patienten durch orale Inhalation (n = 177) oder ein inhaliertes Placebo-Pulver ohne Insulin (n = 176) in Afrezza randomisiert. Insulindosen wurden in den ersten 12 Wochen titriert und in den letzten 12 Wochen der Studie stabil gehalten. OADS -Dosen wurden in der Studie stabil gehalten.
Ergebnisse
In Woche 24 lieferte die Behandlung mit AFREZZA Plus OADs eine durchschnittliche Verringerung der HbA1c, die statistisch signifikant höher war als die in der Placebo plus OADS -Gruppe beobachtete Hba1c -Reduktion (Tabelle 6).
Wofür werden Lisinopril -Medikamente verwendet?
Tabelle 6: Ergebnisse in Woche 24 in einer placebokontrollierten Studie von Afrezza bei Erwachsenen mit Typ-2
| Wirksamkeitsparameter | Masrazza + Oral Anti-Diabetic Agents (N = 177) | Placebo + Oral Anti Diabetic Agents (N = 176) |
| Halc (%) | ||
| Grundlinie (angepasstes Mittelwerta) | 8.25 | 8.27 |
| Wechseln Sie vom Ausgangswert (angepasster Mittelwertab) | -0.82 | -0.42 |
| Unterschied zum Placebo (angepasster Mittelwertab) (95%) | -0.40 (-0,57 -0,23) | |
| Prozentsatz (%) der Patienten, die HbAIC ≤ 7%erreichenc | 32% | 15% |
| Fastenplasma -Glukose (Mg/DL) | ||
| Grundlinie (angepasstes Mittelwerta) | 175.9 | 175.2 |
| Wechseln Sie vom Ausgangswert (angepasster Mittelwertab) | -11.2 | -3.8 |
| Unterschied zum Placebo (angepasster Mittelwertab) (95%) | -7,4 (-18.0 3.2) | |
| a Der angepasste Mittelwert wurde unter Verwendung eines gemischten Modells wiederholten Messungen (MMRM) mit Hba1c oder FPG als abhängige Variable und Behandlungsbesuchsregion und Behandlung durch Besuchswechselwirkung als feste Faktoren und entsprechende Grundlinie als Kovariate erhalten. Eine Autoregression (1) [Ar (1)] Kovarianzstruktur wurde verwendet. b Daten at 24 weeks without rescue therapy were available from 139 (79%) Und 129 (73%) patients rUndomized to the Masrazza Und placebo groups respectively. c Der Prozentsatz wurde basierend auf der Anzahl der Patienten berechnet, die in die Studie randomisiert wurden. |
Patienteninformationen für Afrezza
Masrazza®
(uh-frezz-uh)
(Insulin -menschliches) Inhalationspulver für den oralen Inhalationsgebrauch
Was sind die wichtigsten Informationen, die ich über Afrezza wissen sollte?
Masrazza can cause serious side effects including:
- Plötzliche Lungenprobleme (Bronchospasmen). Verwenden Sie keine Afrezza, wenn Sie langfristige (chronische) Lungenprobleme wie Asthma oder chronisch obstruktive Lungenerkrankung (COPD) haben. Bevor Sie mit AFREZZA beginnen, gibt Ihnen Ihr Gesundheitsdienstleister einen Atemtest, um zu überprüfen, wie Ihre Lungen funktionieren.
Was ist Afrezza?
- Masrazza is a man-made insulin that is breathed-in through your lungs (inhaled) Und is used to control high blood sugar in adults with diabetes mellitus.
- Masrazza is not for use to treat diabetic ketoacidosis. Masrazza must be used with basal insulin in people who have type 1 diabetes mellitus.
- Es ist nicht bekannt, ob Afrezza sicher und effektiv für Menschen ist, die rauchen. Afrezza ist nicht für Menschen, die rauchen oder kürzlich aufgehört haben (weniger als 6 Monate).
- Es ist nicht bekannt, ob Afrezza bei Kindern unter 18 Jahren sicher und wirksam ist.
Wer sollte Afrezza nicht verwenden?
Verwenden Sie Afrezza nicht, wenn Sie:
- Haben chronische Lungenprobleme wie Asthma oder COPD.
- Sind allergisch gegen normales menschliches Insulin oder einen der Zutaten in Afrezza. Eine vollständige Liste von Zutaten in Afrezza finden Sie im Ende dieses Medikamentenleitfadens.
- Haben eine Episode von niedrigem Blutzucker (Hypoglykämie).
Was soll ich meinem Gesundheitsdienstleister sagen, bevor ich Afrezza benutze?
Bevor Sie Afrezza verwenden, teilen Sie Ihrem Gesundheitsdienstleister alle Ihre medizinischen Erkrankungen mit, einschließlich, wenn Sie:
- Lungenprobleme wie Asthma oder COPD haben
- Lungenkrebs haben oder hatte
- Verwenden inhalierte Medikamente
- Rauch oder kürzlich aufgehört zu rauchen
- Nieren- oder Leberprobleme haben
- Planen schwanger, schwanger zu werden oder stillen. Afrezza kann Ihrem ungeborenen oder stillenden Baby schaden.
Teilen Sie Ihrem Gesundheitsdienstleister von allen Medikamenten mit, die Sie einnehmen, einschließlich verschreibungspflichtiger und rezeptfreier Medikamente Vitamine oder Kräuterpräparate.
Bevor Sie anfangen, Afrezza zu verwenden, sprechen Sie mit Ihrem Gesundheitsdienstleister über niedrigen Blutzucker und wie man damit umgeht.
Wie soll ich Afrezza verwenden?
- Lesen Sie die detaillierten Anweisungen zur Verwendung, die mit Ihrer Afrezza geliefert wird.
- Nehmen Sie Afrezza genau so, wie Ihr Gesundheitsdienstleister es Ihnen sagt. Ihr Gesundheitsdienstleister sollte Ihnen sagen, wie viel Afrezza zu verwenden ist und wann Sie es verwenden sollen.
- Kennen Sie die Stärke von Afrezza, die Sie verwenden. Ändern Sie nicht die Menge an Afrezza, die Sie verwenden, es sei denn, Ihr Gesundheitsdienstleister sagt es Ihnen.
- Nehmen Sie Afrezza zu Beginn Ihres Essens.
- Überprüfen Sie Ihren Blutzuckerspiegel. Fragen Sie Ihren Gesundheitsdienstleister, wie Ihr Blutzucker aussehen sollte und wann Sie Ihren Blutzuckerspiegel überprüfen sollten.
- Halten Sie Afrezza und alle Medikamente außerhalb der Reichweite der Kinder.
Ihre Dosis Afrezza muss sich möglicherweise ändern, weil:
- Veränderung des Maßes der körperlichen Aktivität oder der Gewichtszunahme oder des Verlusts von Bewegung erhöhte die Änderung der Ernährung oder aufgrund anderer Medikamente, die Sie einnehmen.
Was soll ich bei der Verwendung von Afrezza vermeiden?
Während der Verwendung von Afrezza nicht:
- Fahren oder betreiben Sie schwere Maschinen, bis Sie wissen, wie sich Afrezza auf Sie auswirkt
- Alkohol trinken oder rezeptfreie Medikamente verwenden, die Alkohol enthalten
- Rauch
Was sind die möglichen Nebenwirkungen von Afrezza?
Masrazza may cause serious side effects that can lead to death including:
Sehen Sie, was die wichtigsten Informationen über Afrezza wissen sollte?
- Niedriger Blutzucker (Hypoglykämie). Anzeichen und Symptome, die auf niedrigen Blutzucker hinweisen können, umfassen:
- Schwindel oder Leuchtenblatt schwitzen Verwirrung Kopfschmerzen verschwommenes Sehvermögen geschlossene Sprache Schütteln Schneller Herzschlag Angst Irritabilität oder Stimmungsänderung Hunger.
- Verringerte Lungenfunktion. Ihr Gesundheitsdienstleister sollte überprüfen, wie Ihre Lungen arbeiten, bevor Sie 6 Monate nach der Verwendung von Afrezza anfangen, sie und danach jährlich zu verwenden.
- Lungenkrebs. In Studien von Afrezza bei Menschen mit Diabetes -Lungenkrebs traten bei einigen weiteren Menschen, die Afrezza einnahmen, bei Menschen, die andere Diabetes -Medikamente einnahmen. Es gab zu wenige Fälle, um zu wissen, ob Lungenkrebs mit Afrezza zusammenhängt. Wenn Sie Lungenkrebs haben, sollten Sie und Ihr Gesundheitsdienstleister entscheiden, ob Sie Afrezza verwenden sollten.
- Diabetische Ketoacidose. Sprechen Sie mit Ihrem Gesundheitsdienstleister, wenn Sie eine Krankheit haben. Ihre Afrezza -Dosis oder wie oft Sie Ihren Blutzucker überprüfen, muss möglicherweise geändert werden.
- Schwere allergische Reaktion (Ganzkörperreaktion). Holen Sie sich sofort medizinische Hilfe, wenn Sie eines dieser Anzeichen oder Symptome einer schweren allergischen Reaktion haben:
- Ein Ausschlag über Ihrem ganzen Körper Probleme, einen schnellen Herzschlag oder Schwitzen zu atmen.
- Niedriges Kalium in Ihrem Blut (Hypokaliämie).
- Herzinsuffizienz . Die Einnahme bestimmter Diabetes -Pillen, die Thiazolidination oder TZDs mit Afrezza bezeichnen, kann bei einigen Menschen zu Herzversagen führen. Dies kann passieren, auch wenn Sie noch nie zuvor Herzversagen oder Herzprobleme hatten. Wenn Sie bereits Herzinsuffizienz haben, kann dies schlechter werden, während Sie TZDs mit Afrezza einnehmen. Ihr Gesundheitsdienstleister sollte Sie genau überwachen, während Sie TZDs mit Afrezza einnehmen. Sagen Sie Ihrem Gesundheitsdienstleister, wenn Sie neue oder schlechtere Symptome von Herzinsuffizienz haben, einschließlich:
- Kurzatmigkeit Schwellung Ihrer Knöchel oder Füße plötzliche Gewichtszunahme.
- Die Behandlung mit TZDs und Afrezza muss möglicherweise von Ihrem Gesundheitsdienstleister geändert oder gestoppt werden, wenn Sie eine neue oder schlechtere Herzinsuffizienz haben.
Holen Sie sich eine medizinische Notfallhilfe, wenn Sie:
- Probleme beim Atmen von Atemnot schnell Herzschlag Schwellung Ihrer Gesichtszunge oder Hals schwitzen extreme Schläfrigkeit Schwindel Verwirrung.
Die häufigsten Nebenwirkungen von Afrezza sind:
- Niedriger Blutzucker (Hypoglykämie) Husten Halsschmerzen.
Dies sind nicht alle möglichen Nebenwirkungen von Afrezza. Rufen Sie Ihren Arzt an, um medizinische Beratung zu Nebenwirkungen zu erhalten. Sie können die FDA bei 1-800-FDA-1088 (1-800-332-1088) Nebenwirkungen melden.
Allgemeine Informationen über den sicheren und effektiven Einsatz von Afrezza.
Medikamente werden manchmal für andere Zwecke als die in einem Medikamentenhandbuch aufgeführten Zwecke verschrieben. Verwenden Sie Afrezza nicht für einen Zustand, für den sie nicht verschrieben wurde. Geben Sie Afrezza nicht an andere Menschen, auch wenn sie die gleichen Symptome haben, die Sie haben. Es kann ihnen schaden.
Dieser Medikamentenhandbuch fasst die wichtigsten Informationen über Afrezza zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Gesundheitsdienstleister. Sie können Ihren Apotheker oder Gesundheitsdienstleister um Informationen über Afrezza bitten, die für Angehörige der Gesundheitsberufe geschrieben wurden.
Was sind die Zutaten in Afrezza?
Wirkstoff: menschliches Insulin
Inaktive Zutaten: Fumaryl Diketopiperazin Polysorbat 80
Anweisungen zur Verwendung
Masrazza®
(uh-frezz-uh) (Insulin -menschliches) Inhalationspulver für den oralen Inhalationsgebrauch
Diese Verwendungsanweisungen enthält Informationen zur Verwendung von AFREZZA® (Insulin Human) Inhalationspulver.
Lesen Sie diese Anweisungen für die Verwendung, bevor Sie mit Afrezza beginnen, und jedes Mal, wenn Sie einen neuen Afrezza -Inhalator erhalten. Es kann neue Informationen geben. Diese Informationen treten nicht an den Platz, mit Ihrem Gesundheitsdienstleister über Ihre Krankheit oder Ihre Behandlung zu sprechen.
Ihr Gesundheitsdienstleister sollte Ihnen zeigen, wie Sie Ihren Afrezza -Inhalator richtig verwenden, bevor Sie ihn zum ersten Mal verwenden.
Wichtige Informationen über Afrezza:
- Masrazza comes in 3 strengths (see Abbildung a):
- 4 Einheiten (blue cartridge)
- 8 Einheiten (green cartridge)
- 12 Einheiten (yellow cartridge)
Abbildung a
 |
- Wenn Ihre vorgeschriebene Afrezza -Dosis höher als 12 Einheiten ist, müssen Sie mehr als 1 Patrone verwenden.
- Wenn Sie mehr als 1 Patrone für Ihre Dosis verwenden müssen, werfen Sie die gebrauchte Patrone weg, bevor Sie eine neue erhalten. Sie können erkennen, wann eine Patrone verwendet wurde, weil der Becher in die Mitte gezogen ist.
- Versuchen Sie nicht, die Afrezza -Patronen zu öffnen. Der Afrezza -Inhalator öffnet die Patrone beim Gebrauch automatisch.
- Masrazza cartridges should only be used with the Afrezza -Inhalator. Versuchen Sie nicht, das Afrezza -Insulinpulver auf andere Weise zu atmen. Legen Sie keine Patronen in den Mund und schlucken Sie keine Patronen.
- Verwenden Sie jeweils nur 1 Afrezza -Inhalator. Der gleiche Inhalator sollte für die 4 -Einheit -8 -Einheit- oder 12 -Einheiten -Patronen verwendet werden.
- Lagern Sie den Inhalator an einem sauberen trockenen Ort mit der Mundstücksabdeckung bis zur nächsten Dosis.
- Werfen Sie Ihren Afrezza -Inhalator nach 15 Tagen weg und holen Sie sich einen neuen.
Wenn Sie Probleme mit Ihrem Afrezza-Inhalator haben oder wenn er bricht und Sie einen neuen Anruf 1-877-323-8505 benötigen.
Kennen Sie Ihren Afrezza -Inhalator:
 |
Kennen Sie Ihre Afrezza -Patronen:
 |
So nehmen Sie Ihre Dosis Afrezza:
Stellen Sie immer sicher, dass Sie die richtige Anzahl von Afrezza -Patronen für Ihre Dosis haben, bevor Sie beginnen. Afrezza -Patronen dürfen nur mit dem Afrezza -Inhalator verwendet werden.
Schritt 1: Wählen Sie die Afrezza -Patronen für Ihre Dosis aus
 |
Wenn Ihre vorgeschriebene Afrezza -Dosis mehr als 12 Einheiten beträgt, müssen Sie mehr als 1 Patrone verwenden um deine rechte Dosis zu bekommen.
Verwenden Sie das unten stehende Dosierungsdiagramm, um die geringste Anzahl von Afrezza -Patronen zu bestimmen, die Sie für Ihre Dosis verwenden können. Andere Patronenkombinationen können verwendet werden.
Abbildung b
 |
Beispiel
 |
Wählen Sie Patronen
Wichtig: Verwenden Sie das obige Afrezza -Dosis -Diagramm (siehe Abbildung B) Um die richtige Anzahl von Afrezza -Patronen auszuwählen, die für Ihre Dosis benötigt werden.
Pakete geöffnet
- Entfernen Sie eine Blasenkarte aus dem Folienpaket.
- Die Perforation entlang reißen, um einen Streifen zu entfernen.
 |
Drücken Sie Patronen zum Entfernen
 |
Nehmen Sie eine Patrone aus dem Streifen, indem Sie auf die klare Seite drücken, um die Patrone herauszudrücken. Entfernen Sie die richtige Anzahl von Patronen für Ihre Dosis. Das Schieben auf die Tasse wird die Patrone nicht beschädigen. Masrazza cartridges left over in an opened strip must be used within 3 days.
 |
Vor fortfahren:
Überprüfen Sie, ob Sie die richtige Afrezza -Patrone für Ihre Dosis haben.
Verwenden Sie nur 1 Inhalator für mehrere Patronen. Werfen Sie Ihren Afrezza -Inhalator nach 15 Tagen weg und holen Sie sich einen neuen.
Schritt 2: Laden einer Patrone
Inhalator halten
Halten Sie den Inhalatorspiegel in einer (1) Hand mit dem weißen Mundstück oben und der lila Basis auf der Unterseite.
 |
Offener Inhalator
Öffnen Sie den Inhalator, indem Sie das weiße Mundstück in eine vertikale Position anheben.
Bevor Sie die Afrezza -Patrone in Ihren Inhalator stellen Raumtemperatur für 10 Minuten.
 |
Legen Sie die Patrone Platz
Halten Sie die Patrone mit der Tasse nach unten.
Richten Sie die Patrone mit der Öffnung im Inhalator aus. Das spitzen Ende der Kartusche sollte sich mit dem spitzen Ende im Inhalator ausrichten.
Legen Sie die Patrone in den Inhalator. Stellen Sie sicher, dass die Patrone flach im Inhalator liegt.
 |
Wenn einer dieser Auftreten die Patrone wegwirft und eine neue Patrone laden.
 |
Inhalator eng
Senken Sie das Mundstück, um den Inhalator zu schließen (dies öffnet die Drogenpatrone).
Sie sollten einen Schnappschuss spüren, wenn der Inhalator geschlossen ist.
 |
Schritt 3: Einatmen von Afrezza
Entfernen Sie die Mundstückabdeckung
 |
Wichtig: Halten Sie den Inhalatorspiegel während und nach Entfernung der lila Mundstücksabdeckung.
Überprüfen Sie, ob Sie bereit sind zu atmen:
- Lila Mundstücksabdeckung wird entfernt.
- Inhalator wird auf dem Niveau gehalten.
- Überprüfen Sie die folgenden A-B-C-Schritte vor Beginn des Einatmenprozesses vollständig.
Ausatmen
Halten Sie den Inhalator von Ihrem Mund fern und blasen Sie vollständig aus (atmen Sie aus).
 |
Positionsinhalator im Mund
Halten Sie Ihren Kopfniveau das Mundstück in Ihren Mund und Neigen Sie den Inhalator wie gezeigt in Ihr Kinn nach unten.
Schließen Sie Ihre Lippen um das Mundstück, um ein Siegel zu bilden.
Neigen Sie den Inhalator nach unten und halten Sie Ihren Kopfniveau.
 |
Tief atmen und den Atem anhalten
Mit dem Mund um das Mundstück umgeben tief durch den Inhalator einatmen.
Halten Sie den Atem an So lange so bequem und gleichzeitig den Inhalator aus Ihrem Mund entfernen. Nachdem Sie den Atem ausatmen, atmen Sie normal und atmen Sie normal weiter.
 |
Schritt 4: Entfernen einer gebrauchten Patrone
Mundstücksabdeckung ersetzen
Legen Sie die lila Mundstücksabdeckung wieder auf den Inhalator.
 |
Offener Inhalator
Öffnen Sie den Inhalator, indem Sie das weiße Mundstück hochheben.
 |
Patrone entfernen
Entfernen Sie die Patrone von der lila Basis.
 |
Werfen Sie die Patrone weg (oder recyceln)
Werfen Sie die gebrauchte Patrone in Ihren regulären Haushaltsmüll weg.
Alternativ kann die gebrauchte Kartusche (bestehend aus HDPE zugewiesenen Recycling -Nummer 2 zusammengesetzt) recycelt werden.
 |
Multiple Patronendosierung
Wenn Sie mehr als eine (1) Afrezza -Patrone für Ihre Dosis benötigen, finden Sie das Afrezza -Dosierungsdiagramm oben (Abbildung B).
 |
Wiederholen Sie die Schritte 2 bis 4 für jede Afrezza -Patrone, die Sie für Ihre vorgeschriebene Afrezza -Dosis benötigen.
 |
Wie soll ich Afrezza aufbewahren?
 |
Pflege für deinen Afrezza -Inhalator:
Lagerung Instructions
Sobald Sie Ihre volle Dosis genommen haben, stellen Sie sicher, dass die lila Mundstückabdeckung ersetzt und der Inhalator geschlossen ist.
- Halten Sie den Inhalator an einem sauberen trockenen Ort Mit dem Mundstück Deckung bis zu Ihrer nächsten Dosis.
- Kann gekühlt gelagert werden, muss aber vor dem Gebrauch bei Raumtemperatur liegen.
- Verlassen oder lagern Sie niemals Patronen im Inhalator.
- Außerhalb der Reichweite von Kindern.
 |
Pflegeanweisungen
- Verwenden Sie jeweils einen Inhalator. Der gleiche Inhalator sollte verwendet werden, um 4 Einheiten 8 -Einheiten oder 12 Einheitenpatronen einzunehmen. Ersetzen Sie den Inhalator alle 15 Tage, um die Arzneimittelabgabe aufrechtzuerhalten.
 |
- Halten Sie 15 Tage nach dem Inhalator mit einem Kalender oder verwenden Sie das Diagramm auf der Rückseite der Inhalatorbox.
- Nachdem Ihr Dosispulverreste in das Mundstück normal ist, hat dies keine Auswirkungen auf Ihre Dosis.
Die Außenseite des Inhalers kann bei Bedarf mit einem sauberen trockenen Tuch abgewischt werden. Waschen Sie den Inhalator niemals. Halte es trocken.
 |
Wechsel zwischen Afrezza und injiziertem Insulin:
Wenden Sie sich an Ihren Gesundheitsdienstleister, bevor Sie Insuline wechseln.
Masrazza is a mealtime insulin.
Wechseln Sie nicht von Afrezza zu einem langen Insulin.
Wechseln Sie nicht von einem langen Insulin nach Afrezza.
 |
Diese Verwendung wurden von der US -amerikanischen Food and Drug Administration genehmigt.