Glatopa
Die Informationen Auf Dieser Website Stellen Keine Medizinische Beratung Dar. Wir Verkaufen Nichts. Die Richtigkeit Der Übersetzung Wird Nicht Garantiert. Haftungsausschluss
Drogenzusammenfassung
Was ist Glatopa?
Glatopa (Glatirameracetat -Injektion) ist ein Immunmodulator zur Behandlung von Patienten mit rezidivierenden Formen von Multipler Sklerose (MS), einschließlich solcher, die eine erste klinische Episode erlebt haben und haben Magnetresonanztomographie (MRT) Merkmale im Einklang mit MS. Glatopa ist generisches Version von Copaxon .
Was sind Nebenwirkungen von Glatopa?
Glatopa
- Nesselsucht
- Schwierigkeiten beim Atmen
- Schwellung Ihrer Gesichtslippen Zunge oder Hals
- spülen
- Brustschmerzen
- Schneller Herzschlag
- Angst
- Kurzatmigkeit
- Juckreiz
- Schwindel
- Ohnmacht
- Brechreiz
- Erbrechen
- Appetitverlust
- Magenschmerzen
- vergilbt der Augen oder Haut ( Gelbsucht )
- dunkler Urin
- Fieber
- Halsschmerzen
- Stimmungsänderungen
- Depression
- Starke Schmerzen an der Injektionsstelle
- Zittern
- Schwellung der Füße oder Beine
- Sehprobleme und
- Ausschlag
Holen Sie sich sofort medizinische Hilfe, wenn Sie eines der oben aufgeführten Symptome haben.
Zu den häufigen Nebenwirkungen von Glatopa gehören:
- Reaktionen für Injektionsstelle
- Hautrötung
- Ausschlag
- Nesselsucht
- Benommenheit
- spülen
- Herzklopfen
- Angst
- Verdauungsstörungen
- Halsverengung und
- Brustschmerzen
Suchen Sie medizinische Versorgung oder rufen Sie auf einmal 911 an, wenn Sie die folgenden schwerwiegenden Nebenwirkungen haben:
- Schwerwiegende Augensymptome wie plötzlicher Sehverlust verschwommenes Sehen Tunnel Sehschmerzen oder Schwellungen oder Halos in der Umgebung des Lichts;
- Schwerwiegende Herzsymptome wie schnelle unregelmäßige oder pochende Herzschläge; Flattern in deiner Brust; Kurzatmigkeit; und plötzliche Schwindel -Unbeschwertheit oder ohnmächtig;
- Starke Kopfschmerzen Verwirrung verwirrt Spracharm oder Bein Schwäche Schwierigkeiten beim Verlust der Koordination unstabil sehr steifes Muskeln hoher Fieber problemlos Schwitzen oder Zittern.
Dieses Dokument enthält nicht alle möglichen Nebenwirkungen und andere können auftreten. Wenden Sie sich an Ihren Arzt nach zusätzlichen Informationen zu Nebenwirkungen.
Dosierung für Glatopa
Die Dosis Glatopa beträgt einmal täglich 20 mg/ml.
Welche Medikamentensubstanzen oder Nahrungsergänzungsmittel interagieren mit Glatopa?
Glatopa kann mit anderen Medikamenten interagieren. Sagen Sie Ihrem Arzt alle Medikamente und Nahrungsergänzungsmittel, die Sie verwenden.
Glatopa während der Schwangerschaft und Stillen
Sagen Sie Ihrem Arzt, wenn Sie schwanger sind oder vor der Verwendung von Glatopa schwanger werden. Es ist nicht bekannt, ob dieses Medikament in die Muttermilch übergeht. Wenden Sie sich vor dem Stillen an Ihren Arzt.
Weitere Informationen
Unsere Glatopa (Glatirameracetatinjektion) -Filzmittel -Arzneimittelzentrum bietet einen umfassenden Überblick über die verfügbaren Arzneimittelinformationen über die potenziellen Nebenwirkungen bei der Einnahme dieses Medikaments.
FDA -Drogeninformationen
- Drogenbeschreibung
- Indikationen
- Nebenwirkungen
- Warnungen
- Überdosis
- Klinische Pharmakologie
- Medikamentenhandbuch
Beschreibung für Glatopa
Glatirameracetat Der Wirkstoff von Glatopa besteht aus den Acetatsalzen von synthetischen Polypeptiden, die vier natürlich vorkommende Aminosäuren enthalten: L-Glutaminsäure L-Alanin L-Tyrosin und L-Lysin mit einer durchschnittlichen Bruchfraktion von 0,141 0,427 0,095 und 0,338 und 0,338, und 0,338). Das durchschnittliche Molekulargewicht von Glatirameracetat beträgt 5000 bis 9000 Daltons. Glatirameracetat wird durch bestimmte Antikörper identifiziert.
Chemisch Glatirameracetat ist L-Glutaminsäurepolymer mit L-Alanin L-Lysin und L-Tyrosinacetat (Salz) bezeichnet. Seine strukturelle Formel ist:
(Glu ala Light Bull)x• xch3Cooh
(C5H9NEIN4• C.3H7NEIN2• C.6H14N2O2• C.9H11NEIN3)x• xc2H4O2
CAS-147245-92-9
Glatopa ist eine klare farblose bis leicht gelbe sterile nicht -pyrogene Lösung für die subkutane Injektion. Jede 1 ml Glatirameracetatlösung enthält 20 mg oder 40 mg Glatirameracetat und den folgenden inaktiven Zutaten: 40 mg Mannitol. Der pH -Wert der Lösungen beträgt ungefähr 5,5 bis 7,0. Die biologische Aktivität von Glatirameracetat wird durch seine Fähigkeit bestimmt, die Induktion der experimentellen Autoimmunenzephalomyelitis (EAE) bei Mäusen zu blockieren.
Verwendung für Glatopa
Glatopa ist für die Behandlung von rezidivierenden Formen von angegeben Multiple Sklerose (MS) Einbeziehung klinisch isoliertes Syndrom-Rückfall-Remitting-Erkrankung und aktive sekundäre progressive Erkrankung bei Erwachsenen.
Dosierung für Glatopa
Empfohlene Dosis
Glatopa dient nur für subkutane Verwendung [siehe Dosierung und Verwaltung ]. Nicht intravenös verabreichen. Der Dosierungsplan hängt von der ausgewählten Produktstärke ab. Die empfohlenen Dosen sind:
- Glatopa 20 mg pro ml: einmal am Tag verwalten oder
- Glatopa 40 mg pro ml: Dreimal pro Woche und mindestens 48 Stunden voneinander entfernt.
Glatopa 20 mg pro ml und Glatopa 40 mg pro ml sind nicht austauschbar.
Anweisungen zur Verwendung
Entfernen Sie eine vorgefüllte vorgefüllte Spritze aus dem gekühlten Karton. Lassen Sie die vorgefüllte Spritze 20 Minuten lang bei Raumtemperatur stehen, damit die Lösung auf Raumtemperatur warm ist. Überprüfen Sie die Spritze vor der Verabreichung visuell auf Partikel und Verfärbung. Die Lösung in der Spritze sollte klar zu leicht gelb erscheinen. Wenn Partikel oder Verfärbung beobachtet wird, verwerfen Sie die Spritze.
Zu den Bereichen für subkutane Selbstinjektion gehören Waffenbauch Hüften und Oberschenkel. Die vorgefüllte Spritze ist nur für den einzelnen Gebrauch gedacht. Unbenutzte Teile verwerfen.
Die Verwendung eines Autoinjectors, der nicht für die Verwendung mit Sandozs Glatopa kompatibel ist Warnungen und Vorsichtsmaßnahmen ].
Wie geliefert
Dosierungsformen und Stärken
- Injektion : 20 mg pro ml in einer vorgefüllten Spritze mit einer Dosis mit einem weißen Kolben. Nur für subkutane Verwendung.
- Injektion : 40 mg pro ml in einer vorgefüllten Spritze mit einem blauen Kolben. Nur für subkutane Verwendung.
Lagerung und Handhabung
Glatopa (Glatirameracetat-Injektion) ist eine klare farblose bis leicht gelbe sterile nicht-pyrogene Lösung in einer 1-ml-Eindosis-Glasspritze mit einer angeschlossenen ½-Zoll-Länge von 29 Gauge, die als:
20 mg pro ml in einer eindosis vorgefüllten Spritze mit einem weißen Kolben in einzelnen Blasenpaketen, die in 30 Zählkartons geliefert werden (Kartons NDC 0781-3234-34)
40 mg pro ml in einer eindosis vorgefüllten Spritze mit einem blauen Kolben in einzelnen Blasenpaketen, die in 12-Zähl-Kartons geliefert werden (Kartons NDC 0781-3250-89)
Einige Glatiramer -Acetatprodukte können von einem optionalen kompatiblen Autoinjektor verabreicht werden. Kompatible Autoinjektoren werden separat geliefert, falls verfügbar Warnungen und Vorsichtsmaßnahmen Und Patienteninformationen ].
Lagern Sie Glatopa bei 2 ° C bis 8 ° C (36 ° F bis 46 ° F). Bei Bedarf kann der Patient Glatopa bei Raumtemperatur auf 15 ° C bis 30 ° C (59 ° F bis 86 ° F) für bis zu einem Monat aufbewahren, aber die Kühlung wird bevorzugt. Vermeiden Sie die Exposition höherer Temperaturen oder intensives Licht. Nicht Glatopa einfrieren. Wenn eine Glatopa -Spritze einfriert, sollte sie weggeworfen werden.
Verteilt von: Sandoz Inc. Princeton NJ 08540. Überarbeitet: Februar 2025
Nebenwirkungen für Glatopa
Die folgenden schwerwiegenden Nebenwirkungen werden an anderer Stelle in der Kennzeichnung beschrieben:
- Anaphylaktische Reaktionen [siehe Warnungen und Vorsichtsmaßnahmen ]
- Sofortige Reaktion nach der Injektion [siehe Warnungen und Vorsichtsmaßnahmen ]
- Brustschmerzen [siehe Warnungen und Vorsichtsmaßnahmen ]
- Lipoatrophie und Hautnekrose [siehe Warnungen und Vorsichtsmaßnahmen ]
- Mögliche Auswirkungen auf die Immunantwort [siehe Warnungen und Vorsichtsmaßnahmen ]
- Leberverletzung [siehe Warnungen und Vorsichtsmaßnahmen ]
Klinische Studien Erfahrung
Da klinische Studien unter stark unterschiedlichen Bedingungen durchgeführt werden, die in den klinischen Studien eines Arzneimittels beobachtet werden, können in den klinischen Studien eines anderen Arzneimittels nicht direkt mit den Raten verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Inzidenz in kontrollierten klinischen Studien
Glatirameracetat -Injektion 20 mg pro ml pro Tag
Bei 563 Patienten, die mit Glatirameracetat -Injektion in geblendeten, placebokontrollierten Studien behandelt wurden, stellten ungefähr 5% der Probanden die Behandlung aufgrund einer nachteiligen Reaktion ab. Die nachteiligen Reaktionen, die am häufigsten mit dem Absetzen verbunden sind, waren: Injektionsstellenreaktionen Dyspnoe Urticaria -Vasodilatation und Überempfindlichkeit. Die häufigsten Nebenwirkungen waren: Injektionsstellenreaktionen Vasodilatationsausschlagsdyspnoe und Brustschmerzen.
Tabelle 1 listet Anzeichen und Symptome auf, die bei mindestens 2% der mit Glatirameracetatinjektion behandelten Patienten 20 mg pro ml in den placebokontrollierten Studien auftraten. Diese Anzeichen und Symptome waren bei Patienten, die mit Glatirameracetat -Injektion behandelt wurden, numerisch häufiger als bei Patienten, die mit Placebo behandelt wurden. Nebenwirkungen waren in der Intensität normalerweise mild.
Tabelle 1: Nebenwirkungen in kontrollierten klinischen Studien mit einer Inzidenz von ≥ 2% der Patienten und häufiger mit Glatirameracetat -Injektion (20 mg pro ml täglich) als mit Placebo
| Glatirameracetat -Injektion 20 mg/ml (n = 563) % | Placebo (n = 564) % | ||
| Blut- und Lymphsystemstörungen | Lymphadenopathie | 7 | 3 |
| Herzerkrankungen | Herzklopfen | 9 | 4 |
| Tachykardie | 5 | 2 | |
| Augenstörungen | Augenstörung | 3 | 1 |
| Diplopie | 3 | 2 | |
| Magen -Darm -Störungen | Brechreiz | 15 | 11 |
| Erbrechen | 7 | 4 | |
| Dysphagie | 2 | 1 | |
| Allgemeine Erkrankungen und Verwaltungsortbedingungen | Injektion Site Erythem | 43 | 10 |
| Injektion Site Schmerz | 40 | 20 | |
| Injektion Site Pruritus | 27 | 4 | |
| Injektion Site Mass | 26 | 6 | |
| Asthenie | 22 | 21 | |
| Schmerz | 20 | 17 | |
| Injektion Site Ödem | 19 | 4 | |
| Brustschmerzen | 13 | 6 | |
| Injektion Site Inflammation | 9 | 1 | |
| Ödem | 8 | 2 | |
| Injektion Site Reaction | 8 | 1 | |
| Pyrexie | 6 | 5 | |
| Injektion Site Überempfindlichkeit | 4 | 0 | |
| Lokale Reaktion | 3 | 1 | |
| Schüttelfrost | 3 | 1 | |
| Ödem machen | 3 | 1 | |
| Ödem Peripheral | 3 | 2 | |
| Injektion Site Fibrosis | 2 | 1 | |
| Injektion Site Atrophy | 2 | 0 | |
| Immunsystemstörungen | Überempfindlichkeit | 3 | 2 |
| Infektionen und Befall | Infektion | 30 | 28 |
| Grippe | 14 | 13 | |
| Rhinitis | 7 | 5 | |
| Bronchitis | 6 | 5 | |
| Gastroenteritis | 6 | 4 | |
| Vaginale Candidiasis | 4 | 2 | |
| Stoffwechsel- und Ernährungsstörungen | Gewicht nahm zu | 3 | 1 |
| Muskuloskelett- und Bindegewebestörungen | Rückenschmerzen | 12 | 10 |
| Neoplasmen gutartige maligne und nicht spezifizierte (inklusive Zysten und Polypen) | Gutartiges Neoplasma der Haut | 2 | 1 |
| Störungen des Nervensystems | Tremor | 4 | 2 |
| Migräne | 4 | 2 | |
| Synkope | 3 | 2 | |
| Sprachstörung | 2 | 1 | |
| Psychiatrische Störungen | Angst | 13 | 10 |
| Nervosität | 2 | 1 | |
| Nieren- und Harnstörungen | Miktiondringlichkeit | 5 | 4 |
| Atemstillstand und Mediastinalstörungen | Dyspnoe | 14 | 4 |
| Husten | 6 | 5 | |
| Laryngospaspasp | 2 | 1 | |
| Haut- und subkutane Gewebeerkrankungen | Ausschlag | 19 | 11 |
| Hyperhidrose | 7 | 5 | |
| Pruritus | 5 | 4 | |
| Urtikaria | 3 | 1 | |
| Hauterkrankung | 3 | 1 | |
| Gefäßstörungen | Vasodilatation | 20 | 5 |
| * Die Atrophie der Injektionsstelle umfasst Begriffe im Zusammenhang mit der lokalisierten Lipoatrophie an der Injektionsstelle |
Nebenwirkungen, die nur in 4 bis 5 weiteren Probanden in der Glatiramer -Acetat -Injektionsgruppe auftraten als in der Placebo -Gruppe (weniger als 1% Differenz), für die eine Beziehung zur Glatiramer -Acetat -Injektion jedoch nicht ausgeschlossen werden konnte, waren Arthralgie und Herpes -Simplex.
Laboranalysen wurden an allen Patienten durchgeführt, die am klinischen Programm zur Glatirameracetat -Injektion teilnahmen. Die klinisch signifikanten Laborwerte für die Hämatologie-Chemie und -Reinalanalyse waren sowohl für Glatirameracetat-Injektion als auch für Placebogruppen in blind klinischen Studien ähnlich. In kontrollierten Studien ließ ein Patient die Behandlung aufgrund einer Thrombozytopenie (16 x 10 /l) ab, die nach Absetzen der Behandlung auflösten.
Daten zu nachteiligen Reaktionen in den kontrollierten klinischen Studien mit Glatirameracetat -Injektion von 20 mg pro ml wurden analysiert, um Unterschiede auf der Grundlage von Geschlecht zu bewerten. Es wurden keine klinisch signifikanten Unterschiede identifiziert. Sechsundneunzig Prozent der Patienten in diesen klinischen Studien waren kaukasisch. Die Mehrheit der mit Glatirameracetatinjektion behandelten Patienten war zwischen 18 und 45 Jahren. Folglich sind Daten unzureichend, um eine Analyse der nachteiligen Reaktionsinzidenz in Bezug auf klinisch relevante Altersgruppen durchzuführen.
Andere Nebenwirkungen
In den Absätzen, die den Häufigkeiten von weniger häufig gemeldeten nachteiligen klinischen Reaktionen folgen, werden vorgestellt. Da die Berichte Reaktionen enthalten, die in offenen und unkontrollierten Vorschriftenstudien (n = 979) beobachtet wurden (n = 979), kann die Rolle der Glatiramer -Acetatinjektion in ihrer Kausalität nicht zuverlässig bestimmt werden. Darüber hinaus im Zusammenhang mit nachteiligen Reaktionsmeldungen die Terminologie zur Beschreibung nachteiliger Reaktionen usw. Begrenzen Sie den Wert der bereitgestellten quantitativen Frequenzschätzungen. Die Reaktionsfrequenzen werden als Anzahl der Patienten berechnet, die Glatirameracetatinjektion verwendeten und eine Reaktion geteilt durch die Gesamtzahl der Patienten, die einer Glatirameracetatinjektion ausgesetzt waren, geteilt wurden. Alle gemeldeten Reaktionen sind eingeschlossen, mit Ausnahme derjenigen, die bereits in der vorherigen Tabelle aufgeführt sind, die zu allgemein, um informativ zu sein, und diejenigen, die nicht vernünftigerweise mit dem verbunden sind
Körper als Ganzes
Häufig: Abszess.
Selten: Injektion site Hämatom Mondgesicht Cellulitis Hernie Injektionsstelle Abszess Serumkrankheit Selbstmordversuch Injektionsstelle Hypertrophie Injektionsstelle Melanose Lipom und Photosensitivitätsreaktion.
Herz -Kreislauf
Häufig: Hypertonie.
Selten: Hypotonie Midsystem klicks systolisches Murmeln Vorhofflimmern Bradykardie Viertes Herz -Klang Haltungshypotonie Und varicose veins.
Verdauungs
Selten: Trockener Mund Stomatitis Verbrennung von Empfindungen auf Zungencholezystitis Colitis Ösophagus Ulkus Ösophagitis Magen -Darm -Darm -Karzinom -Zahnfleischblutung Hepatomegalie Erhöhte Appetit Melena Mund Ulzerations -Pankreas -Störung Pankreatitis Rektalblemung Tenesmus Zungenresimenten und Duodene Ulkers.
Endokrin
Selten: Kropfhyperthyreose und Hypothyreose.
Magen -Darm
Häufig: Darm Dringlichkeit oraler Moniliasis Speichelvergrößerung Zahnkaries und Ulcerosa -Stomatitis.
Hemisch und lymphatisch
Selten: Leukopenie -Anämie -Cyanose Eosinophilie Hämatemese -Lymphödem -Pancytopenie und Splenomegalie.
Stoffwechsel und Ernährung
Selten: Gewichtsverlust Alkoholtoleranz Cushing -Syndrom Gicht Abnormale Heilung und Xanthoma.
Muskuloskelett
Selten: Arthritis Muskelatrophie Knochenschmerzen Bursitis Nierenschmerzen Muskelstörung Myopathie Osteomyelitis Sehnenschmerzen und Tenosynovitis.
Nervös
Häufig: Abnormal Träume emotionale Labilität und Stupor.
Was passiert, wenn Sie abhauen
Selten: Aphasie Ataxie -Krampf -Zirma Parästhesie Depersonalisierung Halluzinationen Feindseligkeit Hypokinesie Koma -Konzentration Störung Gesichtslähmung Verringerte Libido Manische Reaktionsgedächtnis Beeinträchtigung Myoklonus neuralgie paranoide Reaktion Parapleglegie psychotische Depressionen und transientes Dummkopf.
Atemweg
Häufig: Hyperventilation und Heufieber.
Selten: Asthma -Pneumonie Epistaxis Hypoventilation und Sprachänderung.
Haut und Anhänge
Häufig: Ekzem Herpes Zoster Pustular Rash Skin Atrophy und Warzen.
Selten: Trockene Hauthaut Hypertrophie Dermatitis Furunculose Psoriasis Angioödeme Kontakt Dermatitis erythema nodosum pilz Dermatitis makulopapuläre Hautausschlag Pigmentierung gutartiger Haut Neoplasma Hautkarzinom Haut Striae und veikulobulöse Hautausschlag.
Besondere Sinne
Häufig: Gesichtsfelddefekt.
Selten: Trockene Augen Otitis externa ptosis katarakt Hornhautgeschwür Mydrias -Optikus -Neuritis Photophobie und Geschmacksverlust.
Urogenital
Häufig: Amenorrhoe -Hämaturie Impotenz Menorrhagie verdächtige Papanicolaou -Abstriche -Harnfrequenz und Vaginalblutung.
Selten: Vaginitis Flank Pain (Nieren) Brust Engorgerement Brustvergrößerung Karzinom in situ Cervix Fibrocystic Brust Nierenkalkül Nocturia Eierstockzyste Priapismus Pyelonephritis Abnormale sexuelle Funktion und Urethritis.
Glatirameracetat -Injektion 40 mg pro ml dreimal pro Woche
Bei 943 Patienten, die dreimal pro Woche mit Glatirameracetat-Injektion mit 40 mg pro ml in einer verblindeten, placebokontrollierten Studie behandelt wurden, hat ungefähr 3% der Probanden die Behandlung aufgrund einer nachteiligen Reaktion abgesetzt. Die häufigsten Nebenwirkungen waren Injektionsstellenreaktionen, die auch die häufigste Ursache für den Absetzen waren.
Tabelle 2 listet Anzeichen und Symptome auf, die bei mindestens 2% der mit Glatirameracetatinjektion behandelten Patienten 40 mg pro ml in der geblendeten, placebokontrollierten Studie auftraten. Diese Anzeichen und Symptome waren bei Patienten, die mit Glatirameracetatinjektion 40 mg pro ml behandelt wurden, numerisch häufiger als bei Patienten, die mit Placebo behandelt wurden. Nebenwirkungen waren in der Intensität normalerweise mild.
Tabelle 2: Nebenwirkungen in einer kontrollierten klinischen Studie mit einer Inzidenz von ≥ 2% der Patienten und häufiger mit Glatirameracetat -Injektion (40 mg pro ml dreimal pro Woche) als mit Placebo
| Glatirameracetatinjektion 40 mg/ml (n = 943) % | Placebo (n = 461) % | ||
| Allgemeine Erkrankungen und Verwaltungsortbedingungen | Injektion Site Erythem | 22 | 2 |
| Injektion Site Schmerz | 10 | 2 | |
| Injektion Site Mass | 6 | 0 | |
| Injektion Site Pruritus | 6 | 0 | |
| Injektion Site Ödem | 6 | 0 | |
| Pyrexie | 3 | 2 | |
| Grippe-like Illness | 3 | 2 | |
| Injektion Site Inflammation | 2 | 0 | |
| Schüttelfrost | 2 | 0 | |
| Brustschmerzen | 2 | 1 | |
| Infektionen und Befall | Nasopharynngitis | 11 | 9 |
| Atemweg Tract Infektion Viral | 3 | 2 | |
| Atemstillstand und Mediastinalstörungen | Dyspnoe | 3 | 0 |
| Gefäßstörungen | Vasodilatation | 3 | 0 |
| Magen -Darm -Störungen | Brechreiz | 2 | 1 |
| Haut- und subkutane Gewebeerkrankungen | Erythem | 2 | 0 |
| Ausschlag | 2 | 1 |
Bei Probanden, die mit Glatirameracetatinjektion 40 mg pro Woche mit Glatirameracetat -Injektion behandelt wurden, traten keine neuen Nebenwirkungen auf, verglichen mit Probanden, die mit Glatirameracetat -Injektion 20 mg pro ml pro Tag in klinischen Studien und während der Nachkriegserfahrung behandelt wurden. Daten zu nachteiligen Reaktionen in der kontrollierten klinischen Studie zur Glatirameracetat -Injektion 40 mg pro ml wurden analysiert, um Unterschiede auf der Grundlage von Geschlecht zu bewerten. Es wurden keine klinisch signifikanten Unterschiede identifiziert. Achtundneunzig Prozent der Patienten in dieser klinischen Studie waren kaukasiisch und die Mehrheit lag zwischen 18 und 50 Jahren. Folglich sind Daten unzureichend, um eine Analyse der nachteiligen Reaktionsinzidenz im Zusammenhang mit klinisch relevanten Altersgruppen durchzuführen.
Nachmarkterfahrung
Die folgenden nachteiligen Reaktionen wurden während der Verwendung von Glatiramer -Acetat -Injektion nach dem Einsatz nach der Annahme identifiziert. Da diese Reaktionen freiwillig aus einer Population unsicherer Größe berichtet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder ein kausales Verhältnis zur Arzneimittelexposition herzustellen.
Körper als Ganzes: Sepsis; SLE -Syndrom; Hydrozephalus; vergrößerter Bauch; allergische Reaktion
Herz -Kreislauf System: Thrombose; periphere Gefäßerkrankung; Perikardguss; Myokardinfarkt; Deep Thrombophlebitis; Koronarverschluss; Herzinsuffizienz; Kardiomyopathie; Kardiomegalie; Arrhythmie; Angina pectoris
Verdauungs System: Zungenödem; Magengeschwür; Blutung; Auferstimmung
Hemisches und lymphatisches System: Thrombozytopenie; lymphomähnliche Reaktion; Akute Leukämie
Lebererkrankungen: Cholelithiasis; Abnormalität der Leberfunktion; Zirrhose der Leber; Hepatitis; Leberverletzung [siehe Warnungen und Vorsichtsmaßnahmen ]
Immunsystemstörungen: Überempfindlichkeitsreaktionen (einschließlich anaphylaktischer Reaktionen) [siehe WARNUNG BOXED Und Warnungen und Vorsichtsmaßnahmen ]
Stoffwechsel- und Ernährungsstörungen: Hypercholesterinämie
Muskuloskelett System: rheumatoide Arthritis; Verallgemeinerter Krampf
Nervös System: Myelitis; Meningitis; ZNS -Neoplasma; zerebrovaskulärer Unfall; Gehirnödem; abnormale Träume; Aphasie; Konvulsion; Neuralgie
Atemweg System: Lungenembolie; Pleuraerguss; Karzinom der Lunge
Besondere Sinne: Glaukom; Blindheit
Urogenital System: Urogenital -Neoplasma; Urinanomalie; Ovarialkarzinom; Nephrose; Nierenversagen; Brustkarzinom; Blasenkarzinom; Harnfrequenz
Wechselwirkungen zwischen Arzneimitteln für Glatopa
Keine Informationen zur Verfügung gestellt
Warnungen für Glatopa
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Abschnitt.
Vorsichtsmaßnahmen für Glatopa
Anaphylaktische Reaktionen
Es wurde eine lebensbedrohliche und tödliche Anaphylaxie mit Glatirameracetat-Injektion berichtet [siehe Nebenwirkungen ]. Glatopa is contraindicated in patients with a history of hypersensitivity reactions to Glatiramer Acetat injection including anaphylaxis [see Kontraindikationen ]. Anaphylaxis can occur at any time following initiation of Glatiramer Acetat injection therapy from as early as after the first dose up to years after initiation of treatment. Anaphylaxis occurred within an hour of a Glatiramer Acetat injection in most of the reported cases.
Einige Anzeichen und Symptome von anaphylaktischen Reaktionen können sich mit denen von sofortigen Reaktionen nach der Injektion überschneiden [siehe Warnungen und Vorsichtsmaßnahmen ]. All patients receiving treatment with Glatiramer Acetat injection Und caregivers should be informed about the signs Und symptoms of anaphylactic reactions Und that they must seek immediate emergency medical care in case of experiencing such symptoms. If an anaphylactic reaction occurs treatment with Glatiramer Acetat injection must be immediately discontinued. Unless a clear alternative etiology is identified Glatiramer Acetat injection must be permanently discontinued [see Kontraindikationen ].
Sofortige Reaktion nach der Injektion
Ungefähr 16% der Patienten, die Glatirameracetatinjektion 20 mg pro ml in den 5 placebokontrollierten Studien ausgesetzt waren, verglichen mit 4% der Patienten auf Placebo und ungefähr 2% der Patienten, die Glatiramer-Acetat-Injektion 40 mg pro ml ausgesetzt waren. Nach der Injektion und mindestens zwei der folgenden: Spülen Schmerzen in der Brustschmerzen Tachykardie -Angst -Dyspnoe -Verengung des Rachens und Urtikaria. Diese Ereignisse werden als sofortige Reaktionen nach der Injektion bezeichnet.
Die Symptome einer sofortigen Reaktion nach der Injektion können sich mit denen der Anaphylaxie überlappen. Eine sofortige Identifizierung der Anaphylaxie ist wichtig, um eine Verzögerung der Behandlung zu vermeiden. Im Allgemeinen haben die Symptome einer sofortigen Reaktion nach der Injektion einige Monate nach Beginn der Behandlung, obwohl sie früher auftreten können und ein bestimmter Patient eine oder mehrere Episoden dieser Symptome erleben kann. Ob eines dieser Symptome tatsächlich ein bestimmtes Syndrom darstellt oder nicht, ist ungewiss. Typischerweise waren die Symptome vorübergehend und selbstlimitiert und erforderten keine Behandlung. Es gab jedoch Berichte über Patienten mit ähnlichen Symptomen, die eine tödliche Anaphylaxie entwickelten und/oder eine medizinische Notfallversorgung erhielten. Ob ein immunologischer oder nicht immunologischer Mechanismus diese Episoden vermittelt oder ob mehrere ähnliche Episoden, die bei einem bestimmten Patienten beobachtet wurden, identische Mechanismen haben, ist unbekannt.
Brustschmerzen
Ungefähr 13% der Glatiramer-Acetat-Injektion 20 mg pro ml Patienten in den 5 placebokontrollierten Studien im Vergleich zu 6% der Placebo-Patienten und ungefähr 2% der Patienten, die Glatirameracetat-Injektion ausgesetzt waren, 40 mg pro ml bei einer placebokontrollierten Studie im Vergleich zu 1% der Placebo-Patienten, die mindestens eine Episode von vorübergehender Brustschmerzen hatten. Während einige dieser Episoden im Kontext der oben beschriebenen unmittelbaren Reaktion nach der Injektion auftraten, taten es viele nicht. Die zeitliche Beziehung dieser Brustschmerzen zu einer Injektion war nicht immer bekannt. Die Schmerzen waren normalerweise vorübergehend vorübergehend mit anderen Symptomen und schienen keine klinischen Folgen zu haben. Einige Patienten erlebten mehr als eine solche Episode und Episoden begannen normalerweise mindestens 1 Monat nach Beginn der Behandlung. Die Pathogenese dieses Symptoms ist unbekannt.
Lipoatrophie und Hautnekrose
An Injektionsstellen können lokalisierte Lipoatrophie und selten Injektionsstelle eine Hautnekrose auftreten. Lipoatrophie trat bei ungefähr 2% der Patienten auf, die in den 5 placebokontrollierten Studien 20 mg pro ml ausgesetzt waren, verglichen mit keinem Placebo und 0,5% der Patienten, die Glatiramer-Acetat-Injektion 40 mg pro ml ausgesetzt waren. Hautnekrose wurde nur im Nachmarktumfeld beobachtet. Lipoatrophie kann zu verschiedenen Zeiten nach Beginn der Behandlung (manchmal nach einigen Monaten) auftreten und wird als dauerhaft angesehen. Es gibt keine Therapie für Lipoatrophie. Um diese Ereignisse möglicherweise zu minimieren, sollte dem Patienten empfohlen werden, die richtige Injektionstechnik zu befolgen und die Injektionsstellen bei jeder Injektion zu drehen.
Mögliche Auswirkungen auf die Immunantwort
Da Glatirameracetat -Injektion die Immunantwort modifizieren kann, kann dies die Immunfunktionen beeinträchtigen. Beispielsweise kann die Behandlung mit Glatirameracetat -Injektion die Erkennung von Fremdantigenen auf eine Weise beeinträchtigen, die die Überwachung des Körpers und seine Verteidigung gegen Infektionen untergraben würde. Es gibt keine Hinweise darauf, dass die Glatiramer -Acetat -Injektion dies tut, aber es gab keine systematische Bewertung dieses Risikos. Da Glatirameracetat -Injektion ein antigenes Material ist, ist es möglich, dass seine Verwendung zur Induktion von Wirtsantworten führen kann, die unerschütterlich sind, aber keine systematische Überwachung für diese Effekte durchgeführt wurde.
Obwohl die Glatiramer -Acetat -Injektion die Autoimmunreaktion auf Myelin minimieren soll, besteht die Möglichkeit, dass eine kontinuierliche Veränderung der zellulären Immunität aufgrund einer chronischen Behandlung mit Glatirameracetat -Injektion zu unerschütterlichen Wirkungen führen kann.
Bei den meisten Patienten, die Glatirameracetat erhalten, werden Glatiramer-Acetat-reaktive Antikörper gebildet. Studien sowohl an Ratten als auch an Affe haben gezeigt, dass Immunkomplexe im Nierenglomeruli abgelagert werden. Darüber hinaus erreichte in einer kontrollierten Studie mit 125 RRMS -Patienten, die Glatirameracetat -Injektion mit Glatiramer -Acetat -Injektion von 20 mg pro ml subkutan pro Tag für 2 Jahre Serum -IgG -Spiegel mindestens das dreifache Basiswerte bei 80% der Patienten mit 3 Monaten der Behandlung der Behandlung erreichten. Nach 12 Monaten Behandlung hatten 30% der Patienten jedoch noch mindestens das Dreifache der Basiswerte und 90% die Spiegel über die Grundlinie um 12 Monate. Die Antikörper sind ausschließlich vom IgG-Subtyp und überwiegend vom IgG-1-Subtyp. In einem der 94 getesteten Seren konnten keine Antikörper vom Typ IgE nachgewiesen werden; Trotzdem kann die Anaphylaxie mit der Verabreichung der meisten ausländischen Substanzen in Verbindung gebracht werden und wurde mit Glatirameracetat -Injektion berichtet [siehe Warnungen und Vorsichtsmaßnahmen ].
Leberverletzung
Fälle von schweren Leberverletzungen, die schwerwiegende Leberversagen und Hepatitis mit Gelbsucht mit Glatirameracetatinjektion berichtet haben. Die Leberverletzung ist von Tagen bis Jahren nach der Einleitung der Behandlung mit Glatirameracetat -Injektion stattgefunden. Wenn Anzeichen oder Symptome einer Leberfunktionsstörung auftreten, berücksichtigen Sie die Abnahme der Glatiramer -Acetat -Injektion.
Glatiramer -Acetatprodukte und Verabreichungsfehler
Medication errors have occurred when glatiramer acetate products are administered with incompatible autoinjectors. Einige Glatiramer -Acetatprodukte können von einem optionalen kompatiblen AutoInjector verabreicht werden, wenn man verfügbar sein sollte. Allerdings haben nicht alle Glatiramer -Acetatprodukte einen marktisierten optionalen kompatiblen Autoinjektor für die Verabreichung [siehe Dosierung und Verwaltung Und Wie geliefert / Lagerung und Handhabung ].
Die Verwendung eines optionalen Autoinjektors, der nicht für die Verwendung mit Sandozs Glatopa kompatibel ist, kann das Risiko für Medikamentenfehler wie Dosisabnahme oder Verabreichung einer Teildosis erhöhen.
Wenn Sie einen optionalen AutoInjector zur Verabreichung verwenden, stellen Sie sicher, dass das Gerät für die Verwendung mit dem spezifischen Glatiramer -Acetatprodukt durch Verweisen auf die Kennzeichnung von AutoInjectors kompatibel ist.
Die Verfügbarkeit von kompatiblen Autoinjektoren für jedes Glatiramer -Acetat -Produkt kann sich mit der Zeit ändern.
Patientenberatungsinformationen
Raten Sie dem Patienten, die von der FDA zugelassene Patientenkennzeichnung zu lesen ( Medikamentenhandbuch Und Anweisungen zur Verwendung ).
Wichtige Verwaltungsanweisungen
Beraten Sie Patienten mit neuen oder bestehenden Glatiramer -Acetat -Rezepten, um ihren Apotheker oder Gesundheitsdienstleister zu konsultieren, wenn sie Informationen über die Verwendung eines optionalen kompatiblen AutoInjector -Geräts wünschen, falls verfügbar.
Beraten Sie außerdem Patienten, die einen AutoInjector zur Verabreichung verwenden möchten, wenn man nicht alle verfügbaren Autoinjektoren mit allen Glatiramer -Acetatprodukten kompatibel sind, und die Verfügbarkeit kompatibler AutoInjectors kann sich mit der Zeit ändern. Wenn Sie Fragen zur Verfügbarkeit oder Kompatibilität eines AutoInjectors haben, wenden Sie sich an den Hersteller des vorgeschriebenen Glatiramer -Acetatprodukts, um weitere Informationen zu erhalten.
Beraten Sie den Patienten, dass die Verwendung eines optionalen Autoinjektors, der nicht mit dem Glatiramer -Acetat -Produkt kompatibel ist Dosierung und Verwaltung Warnungen und Vorsichtsmaßnahmen ].
Valtrex 500 mg für Fieberbläschen
Anaphylaktische Reaktionen
Beraten Sie die Patienten und ihre Betreuer, dass Glatopa kurz nach der Injektion lebensbedrohliche und tödliche anaphylaktische Reaktionen verursachen kann und dass Reaktionen Monate bis Jahre nach Beginn der Behandlung auftreten können [siehe Warnungen und Vorsichtsmaßnahmen ]. Inform patients Und their caregivers about the signs Und symptoms specific for anaphylactic reactions Und that signs Und symptoms of anaphylactic reactions may overlap with those of immediate post-injection reactions. Instruct them to seek immediate emergency medical care if they experience any signs or symptoms of an anaphylactic reaction [see Warnungen und Vorsichtsmaßnahmen ]. Patients should be advised to also contact their healthcare provider Und that treatment should be discontinued immediately Und permanently if anaphylactic reactions occur.
Sofortige Reaktion nach der Injektion
Beraten Sie den Patienten, dass Glatopa sofort nach der Injektionsreaktionen nach verschiedenen Symptomen nach der Injektion gekennzeichnet sein kann, einschließlich der Schmerzensschmerzen in der Brustschmerzen Tachykardie Angstdyspnoe Verengung des Rachens und Urtikaria [siehe Warnungen und Vorsichtsmaßnahmen ]. These symptoms occur within seconds to minutes blister packages supplied in 12-count cartons (NDC 0781-3250-89) after injection Und are generally transient self-limited Und do not require specific treatment. Inform patients that these symptoms may occur early or may have their onset several months after the initiation of treatment. A patient may experience one or several episodes of these symptoms.
Raten Sie den Patienten, dass sich die Symptome einer sofortigen Reaktion nach der Injektion mit denen einer anaphylaktischen Reaktion überlappen können. Raten Sie den Patienten, sich an ihren Gesundheitsdienstleister zu wenden, wenn sie Anzeichen oder Symptome einer sofortigen Reaktion nach der Injektion aufweisen [siehe Warnungen und Vorsichtsmaßnahmen ].
Brustschmerzen
Raten Sie den Patienten, dass sie vorübergehende Brustschmerzen entweder als Teil der unmittelbaren Reaktion nach der Injektion oder isoliert haben [siehe Warnungen und Vorsichtsmaßnahmen ]. Inform patients that the Schmerz should be transient. Some patients may experience more than one such episode usually beginning at least one month after the initiation of treatment. Patients should be advised to seek medical attention if they experience Brustschmerzen of unusual duration or intensity.
Lipoatrophie und Hautnekrose At Injektion Site
Beraten Sie Patienten, die Lipoatrophie und selten Hautnekrose lokalisiert haben, an Injektionsstellen [siehe Warnungen und Vorsichtsmaßnahmen ]. Instruct patients to follow proper injection technique Und to rotate injection areas Und sites with each injection to minimize these risks.
Leberverletzung
Beraten Sie den Patienten, dass eine Leberverletzung einschließlich Leberversagen und Hepatitis mit Gelbsucht unter Verwendung von Glatopa berichtet wurde. Schulung von Patienten über die Anzeichen und Symptome einer Leberverletzung und weist die Patienten an, sie sofort an ihren Gesundheitsdienstleister zu melden [siehe Warnungen und Vorsichtsmaßnahmen ].
Schwangerschaft
Weisen Sie die Patienten an, dass sie, wenn sie schwanger sind oder planen, während der Einnahme von Glatopa schwanger zu werden, ihren Gesundheitsdienstleister informieren sollten [siehe Verwendung in bestimmten Populationen ].
Stillzeit
Raten Sie den Patienten, ihren Gesundheitsdienstleister zu benachrichtigen, wenn sie stillen oder beabsichtigen, während der Glatopa -Therapie zu stillen [siehe Verwendung in bestimmten Populationen ].
Anweisungen zur Verwendung
Weisen Sie die Patienten an, die Flugblatt des Glatopa -Patienten sorgfältig zu lesen. Glatopa 20 mg pro ml und Glatopa 40 mg pro ml sind nicht austauschbar. Glatirameracetat -Injektion 20 mg pro ml wird täglich verabreicht und Glatirameracetat -Injektion 40 mg pro ml werden dreimal pro Woche verabreicht. Vorsicht von Patienten, aseptische Technik anzuwenden. Die erste Injektion sollte unter der Aufsicht eines medizinischen Fachmanns durchgeführt werden. Weisen Sie die Patienten an, die Injektionsbereiche und Standorte bei jeder Injektion zu drehen. Vorsicht von Patienten vor der Wiederverwendung von Nadeln oder Spritzen. Weisen Sie Patienten in sichere Entsorgungsverfahren an.
Speicherbedingungen
Beraten Sie den Patienten, dass die empfohlene Lagerung für Glatopa Kühlung bei 3 ° C bis 8 ° C ist. Bei Bedarf kann der Patient Glatopa bei Raumtemperatur für bis zu einen Monat lang auf 15 ° C bis 30 ° C (59 ° F bis 86 ° C) speichern, aber Kühlung wird bevorzugt. Glatopa sollte nicht höheren Temperaturen oder intensivem Licht ausgesetzt sein. Nicht Glatopa einfrieren.
Nichtklinische Toxikologie
Karzinogenese -Mutagenese -Beeinträchtigung der Fruchtbarkeit
Karzinogenese
In einer 2-jährigen Karzinogenitätsstudie wurden Mäusen Mahlzeiten bis zu 60 mg/kg/Tag Glatirameracetat durch subkutane Injektion verabreicht (bis zu 15-mal so viel humantherapeutisch von 20 mg/Tag auf mg/m). Es wurde keine Zunahme der systemischen Neoplasien beobachtet. Bei Männern, die die Dosis von 60 mg/kg/Tag erhielten, gab es an den Injektionsstellen eine erhöhte Inzidenz von Fibrosarkomen. Diese Sarkome waren mit Hautschäden verbunden, die durch wiederholte Injektionen eines Reizstoffs über einen begrenzten Hautbereich ausgelöst wurden.
In einer 2-jährigen Karzinogenitätsstudie wurde Ratten durch subkutane Injektion bis zu 30 mg/kg/Tag Glatirameracetat verabreicht (bis zu 15-mal so viel humantherapeutische Dosis mg/m). Es wurde kein Anstieg der Neoplasien beobachtet.
Mutagenese
Glatirameracetat war in In -vitro -Assays (Ames Test Maus -Lymphom -TK) nicht mutagen. Glatirameracetat war in zwei getrennten In -vitro -chromosomalen Aberrationstests in kultivierten menschlichen Lymphozyten klastogen, aber in einem In -vivo -Maus -Knochenmark -Mikronukleus -Assay nicht klastogen.
Beeinträchtigung der Fruchtbarkeit
Wenn Glatiramer -Acetat vor und während der Paarung (Männer und Frauen) und während der gesamten Schwangerschaft und der Laktation (Frauen) bei Dosen von bis zu 36 mg/kg/Tag (18 -fache der menschlichen therapeutischen Dosis auf mg/m) durch subkutane Injektion verabreicht wurde, wurden keine unerwünschten Wirkungen auf reproduktive oder entwicklungsbezogene Parameter beobachtet.
Verwendung in bestimmten Populationen
Schwangerschaft
Risikozusammenfassung
Verfügbare Daten aus Pharmakovigilanz und veröffentlichten Beobachtungsstudien über Jahrzehnte lang mit Glatirameracetat während der Schwangerschaft haben kein medikamentenassoziiertes Risiko für schwerwiegende Geburtsfehler oder andere negative mütterliche oder fetale Ergebnisse identifiziert (siehe siehe Daten ). Administration of Glatiramer Acetat by subcutaneous injection to pregnant rats Und rabbits resulted in no adverse effects on embryo-fetal or offspring development (see Daten ).
Das Hintergrundrisiko von schweren Geburtsfehlern und Fehlgeburten für die angegebene Bevölkerung ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehlerverlust oder andere Ergebnisse. In der US -allgemeinen Bevölkerung beträgt das geschätzte Hintergrundrisiko für größere Geburtsfehler und eine Fehlgeburt bei klinisch anerkannten Schwangerschaften 2% bis 4% bzw. 15% bis 20%.
Daten
Menschliche Daten
Daten from pharmacovigilance Und published observational studies have not identified a drug-associated risk of major birth defects miscarriage or other adverse maternal or fetal outcomes when Glatiramer Acetat was used during pregnancy. However the published comparative observational studies have methodological limitations such as short exposure duration during pregnancy confounding selection bias Und exposure misclassification.
Tierdaten
Bei Ratten oder Kaninchen, die Glatirameracetat durch subkutane Injektion während des Zeitraums der Organogenese erhielten, wurden bei Dosen bis zu 37,5 mg/kg/kg/Tag (18 bzw. 36-mal die therapeutische menschliche Dosis von 20 mg/Tag auf einer mg/m-Basis) keine nachteiligen Auswirkungen auf die embryo-fetale Entwicklung beobachtet. Bei Ratten, die subkutanes Glatirameracetat in Dosen von bis zu 36 mg/kg ab dem 15. Tag der Schwangerschaft während der gesamten Laktation erhielten, wurden keine signifikanten Auswirkungen auf die Entbindung oder das Wachstum und die Entwicklung von Nachkommen beobachtet.
Stillzeit
Risikozusammenfassung
Es gibt keine Daten über das Vorhandensein von Glatiramer -Acetat in der Muttermilch. Basierend auf der geringen systemischen Exposition aufgrund der erheblichen lokalen Hydrolyse von Glatirameracetat nach subkutaner Verabreichung wird nicht erwartet Klinische Pharmakologie ]. There are no data on the effects of Glatiramer Acetat on milk production.
Die Entwicklungs- und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedürfnis der Mutter nach Glatirameracetat -Injektion und möglichen nachteiligen Auswirkungen des gestillten Kindes aus Glatirameracetat -Injektion oder aus dem zugrunde liegenden mütterlichen Zustand auf das gestillte Säugling berücksichtigt werden.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit der Glatirameracetatinjektion wurde bei Patienten unter 18 Jahren nicht festgestellt.
Geriatrische Verwendung
Die Glatiramer -Acetat -Injektion wurde bei älteren Patienten nicht untersucht.
Verwendung bei Patienten mit beeinträchtigter Nierenfunktion
Die Pharmakokinetik von Glatirameracetat bei Patienten mit beeinträchtigter Nierenfunktion wurde nicht bestimmt.
Überdosierungsinformationen für Glatopa
Keine Informationen zur Verfügung gestellt
Kontraindikationen für Glatopa
Die Glatirameracetat -Injektion ist bei Patienten mit bekannter Überempfindlichkeit gegenüber Glatirameracetat oder Mannitol kontraindiziert. Die Reaktionen umfassten eine Anaphylaxie [siehe Warnungen und Vorsichtsmaßnahmen ].
Klinische Pharmakologie for Glatopa
Wirkungsmechanismus
Die Mechanismus, durch die Glatirameracetat seine Auswirkungen bei Patienten mit MS ausübt, sind nicht vollständig verstanden. Es wird jedoch angenommen, dass Glatiramer -Acetat durch Modifizierung von Immunprozessen, von denen angenommen wird, dass sie für die Pathogenese von MS verantwortlich sind, verantwortlich sind. Diese Hypothese wird durch Erkenntnisse von Studien gestützt, die durchgeführt wurden, um die Pathogenese der experimentellen Autoimmunenzephalomyelitis -A -Erkrankung zu untersuchen, die bei Tieren durch Immunisierung gegen das Zentralnervensystem abgeleitete Material, das Myelin enthält, induziert und häufig als experimentelles Tiermodell von MS verwendet wird. Studien an Tieren und In-vitro-Systemen legen nahe, dass bei seiner Verabreichung Glatiramer-Acetatespezifische Suppressor-T-Zellen in der Peripherie induziert und aktiviert werden.
Da Glatiramer-Acetat immunfunktionen Änderungen über das Potenzial zur Veränderung natürlich vorkommender Immunantworten ändern kann. Es gibt keine Hinweise darauf, dass Glatirameracetat dies tut, dies jedoch nicht systematisch bewertet wurde [siehe Warnungen und Vorsichtsmaßnahmen ].
Pharmakokinetik
Ergebnisse, die in pharmakokinetischen Studien erhalten wurden, die an Menschen (gesunde Freiwillige) durchgeführt wurden, und Tiere stützen, dass ein wesentlicher Teil der therapeutischen Dosis, die subkutan an Patienten geliefert wird, lokal hydrolysiert. Größere Glatiramer-Acetat-Fragmente können durch Glatiramer-Acetat-reaktive Antikörper erkannt werden. Es wird angenommen, dass ein Teil des intakten oder teilweise hydrolysierten injizierten Materials in die lymphatische Zirkulation gelangt, damit es regionale Lymphknoten erreicht, und einige können in die systemische Kreislauf intakt eintreten.
Klinische Studien
Beweise für die Wirksamkeit der Glatirameracetat-Injektion stammen aus fünf placebokontrollierten Versuchen, von denen vier eine Glatiramer-Acetat-Injektionsdosis von 20 mg pro ml pro Tag verwendeten und eine eine Glatiramer-Acetat-Injektionsdosis von 40 mg pro ml pro Woche verwendete.
Glatirameracetat -Injektion 20 mg pro ml pro Tag
Studie 1 wurde in einem einzigen Zentrum durchgeführt. Fünfzig Patienten wurden eingeschlossen und randomisiert, um tägliche Dosen von Glatirameracetat -Injektion 20 mg pro ml subkutan oder Placebo (Glatirameracetatinjektion: n = 25; Placebo: n = 25) zu erhalten. Bei Patienten wurde nach Standardkriterien RRMs diagnostiziert und während der 2 Jahre unmittelbar vor der Einschreibung mindestens 2 Exazerbationen. Die Patienten waren ambulant, wie durch einen Score von nicht mehr als 6 auf dem Kurtzke Disability Scale Score (DSS) eine Standardskala von 0 € normal bis 10 Todesstod aufgrund von MS reicht. Eine Punktzahl von 6 ist definiert als eine, bei der ein Patient mit Hilfe immer noch ambulant ist. Eine Punktzahl von 7 bedeutet, dass der Patient einen Rollstuhl verwenden muss.
Die Patienten wurden 2 Jahre lang alle 3 Monate sowie innerhalb von mehreren Tagen nach einer vermuteten Verschärfung untersucht. Um eine Verschlechterung zu bestätigen, musste ein verblindeter Neurologe objektive neurologische Zeichen dokumentieren und die Existenz anderer Kriterien dokumentieren (z. B. die Persistenz der neurologischen Anzeichen für mindestens 48 Stunden).
Das von Protokoll spezifizierte primäre Ergebnismaß war der Anteil der Patienten in jeder Behandlungsgruppe, die für die 2 Jahre des Studiums verändert blieben, aber zwei weitere wichtige Ergebnisse wurden ebenfalls als Endpunkte festgelegt: die Häufigkeit von Angriffen während des Versuchs und die Änderung der Anzahl der Angriffe im Vergleich zu der Anzahl, die in den letzten 2 Jahren auftraten.
Tabelle 3 zeigt die Werte der drei oben beschriebenen Ergebnisse sowie mehrere von Protokoll spezifizierte sekundäre Messungen. Diese Werte basieren auf der Intent-to-Treat-Population (d. H. Alle Patienten, die mindestens 1 Dosis Behandlung erhalten haben und mindestens 1 Einbewertung der Behandlung hatten):
Tabelle 3: Studie 1 Wirksamkeitsergebnisse
| Glatirameracetat -Injektion 20 mg/ml (n = 25) | Placebo (n = 25) | P-Wert | |
| % Rezidivfreie Patienten | 14/25 (56%) | 7/25 (28%) | 0.085 |
| Mittlere Rückfallfrequenz | 0,6/2 Jahre | 2,4/2 Jahre | 0.005 |
| Verringerung der Rückfallrate im Vergleich zu Prestudie | 3.2 | 1.6 | 0.025 |
| Mittlere Zeit bis zum ersten Rückfall (Tage) | > 700 | 150 | 0.03 |
| % der progressionsfreien* Patienten | 20/25 (80%) | 13/25 (52%) | 0.07 |
| * Die Progression wurde als eine Zunahme von mindestens 1 Punkt auf dem DSS definiert, das mindestens 3 aufeinanderfolgende Monate anhält. |
Studie 2 war eine multizentrische Studie mit ähnlichem Design, die in 11 US -Zentren durchgeführt wurde. Insgesamt wurden 251 Patienten (Glatirameracetatinjektion: n = 125; Placebo: n = 126) eingeschlossen. Das primäre Ergebnismaß war die mittlere 2-Jahres-Rückfallrate. Tabelle 4 zeigt die Werte dieses Ergebnisses für die Absicht, die Bevölkerung zu tun, sowie mehrere sekundäre Maßnahmen:
Tabelle 4: Studie 2 Wirksamkeitsergebnisse
| Glatirameracetat -Injektion 20 mg/ml (n = 125) | Placebo (n = 126) | P-Wert | |
| Mittlere Anzahl von Rückfällen | 1.19/2 Jahre | 1,68/2 Jahre | 0.055 |
| % Rezidivfreie Patienten | 42/125 (34%) | 34/126 (27%) | 0.25 |
| Mittlere Zeit bis zum ersten Rückfall (Tage) | 287 | 198 | 0.23 |
| % der progressionsfreien Patienten | 98/125 (78%) | 95/126 (75%) | 0.48 |
| Mittlere Änderung der DSS | -0.05 | 0,21 | 0.023 |
In beiden Studien zeigten die Glatirameracetat -Injektion einen klaren vorteilhaften Einfluss auf die Rückfallrate und basiert auf diesen Beweisen, dass Glatirameracetatinjektion als wirksam angesehen wird.
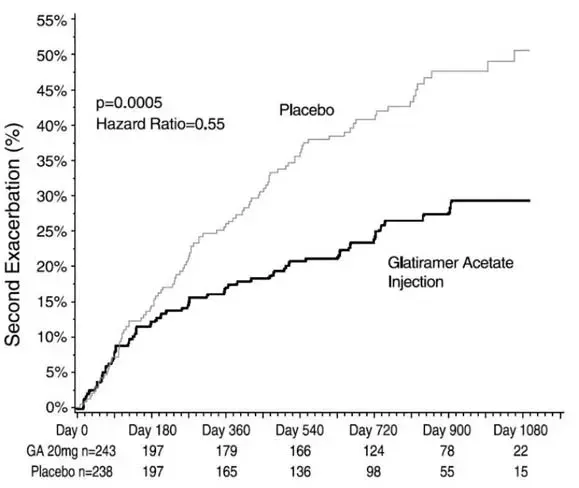
In Studie 3 481 Patienten, die kürzlich (innerhalb von 90 Tagen) ein isoliertes demyelinisierender Ereignis hatten und die für die Multiple Sklerose typische Läsionen bei der MRT -Hirn -MRT hatten, erhielten zufällig entweder Glatirameracetat -Injektion 20 mg pro ml (n = 243) oder Placebo (n = 238). Das primäre Ergebnismaß war Zeit für die Entwicklung einer zweiten Verschlechterung. Die Patienten wurden bis zu drei Jahre lang verfolgt oder bis sie den primären Endpunkt erreichten. Sekundäre Ergebnisse waren Hirn -MRT -Maßnahmen, einschließlich der Anzahl neuer T2 -Läsionen und des T2 -Läsionsvolumens.
Die Zeit für die Entwicklung einer zweiten Exazerbation war bei Patienten, die mit Glatirameracetat -Injektion behandelt wurden, im Vergleich zu Placebo signifikant verzögert (Hazard -Verhältnis = 0,55; 95% Konfidenzintervall 0,40 bis 0,77; Abbildung 1). Die Kaplan-Meier-Schätzungen des Prozentsatzes der Patienten, die innerhalb von 36 Monaten einen Rückfall entwickeln, betrug 42,9% in der Placebo-Gruppe und 24,7% in der Glatiramer-Acetat-Injektionsgruppe.
Abbildung 1: Zeit bis zur zweiten Verschlechterung
 |
Patienten, die mit Glatirameracetat -Injektion behandelt wurden, zeigten bei der letzten Beobachtung weniger neue T2 -Läsionen (Geschwindigkeitsverhältnis 0,41; Konfidenzintervall 0,28 bis 0,59; P; P;<0.0001). Additionally baseline-adjusted T2 lesion volume at the last observation was lower for patients treated with Glatiramer Acetat injection (ratio of 0.89; confidence interval 0.84 to 0.94; p=0.0001).
Studie 4 war eine multinationale Studie, in der MRT -Parameter sowohl als primäre als auch als sekundäre Endpunkte verwendet wurden. Insgesamt 239 Patienten mit RRMs (Glatirameracetatinjektion: n = 119; und Placebo: n = 120) wurden randomisiert. Die Einschlusskriterien ähnelten denen in der zweiten Studie mit dem zusätzlichen Kriterium, dass die Patienten mindestens eine GD-verstärkte Läsion für die Screening-MRT aufweisen mussten. Die Patienten wurden neun Monate lang doppelt blind behandelt, bei denen sie monatlich ein MRT-Scannen unterzogen wurden. Der primäre Endpunkt für die doppelblinde Phase war die gesamte kumulative Anzahl von T1 GD-verstärkenden Läsionen in den neun Monaten. Tabelle 5 fasst die Ergebnisse für das während des Versuchs für die Absichtskohorte überwachte primäre Ergebnismaßnahme zusammen.
Tabelle 5: Studie 4 MRT -Ergebnisse
| Glatirameracetat -Injektion 20 mg/ml (n = 119) | Placebo (n = 120) | P-Wert | |
| Mediane der kumulativen Anzahl von T1 GD-verstärkten Läsionen | 11 | 17 | 0.0030 |
Abbildung 2 zeigt die Ergebnisse des primären Ergebniss monatlich.
Abbildung 2: mittlere kumulative Anzahl von GD-anhanzenden Läsionen
 |
Glatirameracetat -Injektion 40 mg pro ml dreimal pro Woche
Studie 5 war eine doppelblinde, placebokontrollierte multinationale Studie mit insgesamt 1404 Patienten mit RRMs, die in einem Verhältnis von 2: 1 randomisiert wurden, um entweder Glatiramer Acetat-Injektion 40 mg pro ml (n = 943) oder Placebo (n = 461) dreimal pro Woche für 12 Monate zu erhalten. Die Patienten hatten in den 2 Jahren vor dem Screening einen Median von 2 Rückfällen und hatten mindestens 2 Monate vor dem Screening keine Interferon-Beta erhalten. Die Basis -EDSS -Ergebnisse lagen zwischen 0 und 5,5 mit einem Median von 2,5. Die neurologischen Bewertungen wurden alle drei Monate zu Studienbeginn und bei außerplanmäßigen Besuchen für vermutete Rückfälle oder frühe Beendigung durchgeführt. Die MRT wurde zu den Studienmonaten 6 und 12 oder zu Beginn des Vorgangs durchgeführt. Insgesamt 91% derjenigen, die der Glatirameracetat -Injektion zugeordnet waren, und 93% derjenigen, die der Placebo zugewiesen wurden, wurden nach 12 Monaten die Behandlung abgeschlossen.
Das primäre Ergebnismaß war die Gesamtzahl der bestätigten Rückfälle (Persistenz neurologischer Symptome für mindestens 48 Stunden, die bei der Untersuchung mit objektiven Anzeichen bestätigt wurden). Die Wirkung der Glatirameracetat-Injektion auf mehrere Variablen (Magnetresonanztomographie), einschließlich der Anzahl neuer oder vergrößerter T2-Läsionen und der Anzahl der Verbesserung von Läsionen auf T1-gewichteten Bildern, wurde auch in den Monaten 6 und 12 gemessen.
Tabelle 6 zeigt die Ergebnisse für die Absicht.
Tabelle 6: Studie 5 Wirksamkeit und MRT -Ergebnisse
| Glatirameracetatinjektion 40 mg/ml (n = 943) | Placebo (n = 461) | P-Wert | |
| Klinische Endpunkte | |||
| Anzahl der bestätigten Rückfälle während der 12-Monats-Placebokontrollphase | |||
| Angepasste mittlere Schätzungen | 0.331 | 0.505 | <0.0001 |
| Relative Risikominderung | 34% | ||
| MRT -Endpunkte | |||
| Kumulative Anzahl neuer oder vergrößerter T2 -Läsionen in den Monaten 6 und 12 | |||
| Angepasste mittlere Schätzungen | 3.650 | 5.592 | <0.0001 |
| Relative Risikominderung | 35% | ||
| Kumulative Anzahl der Verbesserung von Läsionen auf T1-gewichteten Bildern in den Monaten 6 und 12 | |||
| Angepasste mittlere Schätzungen | 0.905 | 1.639 | <0.0001 |
| Relative Risikominderung | 45% |
Patienteninformationen für Glatopa
Glatopa®
(Gluh-toh-Fire)
(Glatirameracetat -Injektion) zur subkutanen Verwendung
Lesen Sie diesen Medikamentenhandbuch, bevor Sie Glatopa verwenden und jedes Mal, wenn Sie eine Nachfüllung erhalten. Es kann neue Informationen geben. Diese Informationen treten nicht mit Ihrem Gesundheitsdienstleister in Bezug auf Ihre Krankheit oder Ihre Behandlung an.
Was sind die wichtigsten Informationen, die ich über Glatopa wissen sollte?
- Schwerwiegende allergische Reaktionen (anaphylaktische Reaktionen). Schwerwiegende allergische Reaktionen, die lebensbedrohlich oder zum Tod führen können, können jederzeit nach der Verwendung von Glatopa stattfinden. Diese Reaktionen können gleich nach Ihrer ersten Dosis bis zu Jahren nach Beginn der Behandlung mit Glatopa stattfinden, auch wenn Sie noch nie zuvor eine allergische Reaktion hatten. Viele Reaktionen sind innerhalb von 1 Stunde nach Verwendung von Glatopa stattgefunden. Einige Anzeichen und Symptome können mit denen einer sofortigen Reaktion nach der Injektion übereinstimmen. Sehen Was sind die möglichen Nebenwirkungen von Glatopa?
Hören Sie auf Glatopa zu und erhalten Sie sofort Notfallhilfe, wenn Sie:
- weit verbreiteter Hautausschlag
- Schwellung des Gesichts Augenlider Lippen Mund Rachen oder Zunge
- Plötzliche Atemnot Atem oder Keuchen
- Unkontrolliertes Schütteln (Krämpfe)
- Probleme beim Schlucken oder Sprechen
- Ohnmacht schwindelig oder schwach fühlen
Was ist Glatopa?
Glatopa ist ein verschreibungspflichtiges Medikament, das zur Behandlung von rezidivierenden Formen der Multipler Sklerose (MS) verwendet wird, um klinisch isoliertes Syndrom-Rückfall-Remitting-Erkrankung und aktive sekundäre progressive Erkrankungen bei Erwachsenen einzubeziehen.
Es ist nicht bekannt, ob Glatopa bei Kindern unter 18 Jahren sicher und wirksam ist.
Nehmen Sie nicht Glatopa:
- Wenn Sie allergisch gegen Glatiramer Acetat oder Mannitol sind. Schwerwiegende allergische Reaktionen, einschließlich lebensbedrohlicher oder anaphylaktischer Reaktionen, die zum Tod führen können. Eine vollständige Liste der Zutaten in Glatopa finden Sie im Ende dieser Broschüre.
Bevor Sie Glatopa verwenden, teilen Sie Ihrem Gesundheitsdienstleister alle Ihre medizinischen Erkrankungen mit, einschließlich, wenn Sie:
- sind schwanger oder planen, schwanger zu werden. Sprechen Sie mit Ihrem Gesundheitsdienstleister, der beraten wird, ob Sie während Ihrer Schwangerschaft Glatopa einnehmen sollten.
- stillen oder planen zu stillen. Es ist nicht bekannt, ob Glatirameracetat in Ihre Muttermilch übergeht. Sprechen Sie mit Ihrem Gesundheitsdienstleister darüber, wie Sie Ihr Baby am besten füttern können, während Sie Glatopa verwenden.
Teilen Sie Ihrem Gesundheitsdienstleister über alle Medikamente, die Sie einnehmen einschließlich verschreibungspflichtiger und rezeptfreier Medikamente Vitamine und Kräuterpräparate. Glatopa kann die Art und Weise beeinflussen, wie andere Arzneimittel und andere Medikamente die Funktionsweise von Glatopa beeinflussen können.
Kennen Sie die Medikamente, die Sie einnehmen. Behalten Sie eine Liste Ihrer Medikamente bei, um Ihren Gesundheitsdienstleister und Apotheker zu zeigen, wenn Sie ein neues Medikament erhalten.
Wie soll ich Glatopa verwenden?
- Detaillierte Anweisungen finden Sie in der Anweisungen zur Verwendung Am Ende dieser Flugblatt finden Sie vollständige Informationen zur Verwendung von Glatopa.
- Ihr Gesundheitsdienstleister wird Ihnen sagen, wie viel Glatopa zu verwenden ist und wann Sie es verwenden sollen.
- Glatopa wird durch Injektion unter Ihrer Haut (subkutan) gegeben.
- Verwenden Sie Glatopa genau so, wie Ihr Gesundheitsdienstleister Ihnen sagt, dass Sie es verwenden sollen.
- Da jeder Körpertyp mit Ihrem Gesundheitsdienstleister über die Injektionsbereiche, die für Sie am besten geeignet sind, unterscheidet.
- Sie sollten Ihre erste Dosis Glatopa mit einem Gesundheitsdienstleister oder einer Krankenschwester erhalten. Dies kann in der Büro Ihres Gesundheitsdienstleisters oder in einer Krankenschwester für häusliche Gesundheit sein, die Ihnen beibringt, wie Sie Ihre Glatopa -Injektionen verleihen können.
- Einige Glatiramer -Acetatprodukte können mit einem optionalen kompatiblen Autoinjektor verwendet werden. Kompatible Autoinjektoren werden separat geliefert, falls dies verfügbar ist, aber die Verfügbarkeit kompatibler Autoinjektoren kann sich mit der Zeit ändern.
- Erkundigen Sie sich bei Ihrem Gesundheitsdienstleister, wenn Sie Ihr Medikament füllen oder nachfüllen, um sicherzustellen, dass der Autoinjector, den Sie haben, mit Ihrem Glatiramer -Acetatprodukt verwendet werden soll. Nicht alle optionalen Autoinjektoren sollen mit allen Glatiramer -Acetat -Produkten verwendet werden. Wenn Sie den falschen AutoInjector verwenden, erhalten Sie möglicherweise nicht die richtige Dosis Ihres Arzneimittels. Wenden Sie sich an den Hersteller Ihres Glatiramer -Acetatprodukts, um herauszufinden, ob es einen AutoInjector gibt, der mit Ihrem Glatiramer -Acetatprodukt verwendet werden soll.
- Lesen Sie Ihre Anweisungen zur Verwendung und sprechen Sie mit Ihrem Gesundheitsdienstleister über die beste Möglichkeit, Glatopa zu verwenden.
Was sind die möglichen Nebenwirkungen von Glatopa?
Glatopa kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
- Sofortige Reaktion nach der Injektions. Es können schwerwiegende Nebenwirkungen direkt nach oder innerhalb von Minuten nach der Injektion von Glatopa zu jeder Zeit während Ihres Behandlungsverlaufs auftreten. Einige Anzeichen und Symptome können mit denen einer schwerwiegenden allergischen Reaktion (Anaphylaxie) die gleichen sein. Sehen Sie, was die wichtigsten Informationen über Glatopa wissen sollte? Rufen Sie sofort einen Gesundheitsdienstleister an, wenn Sie eine dieser sofortigen Symptome der Reaktion nach der Injektion haben, einschließlich:
- Rötung zu Ihren Wangen oder anderen Körperteilen (Spülung)
- Brustschmerzen
- Schneller Herzschlag
- Angst
- Atemprobleme oder Enge in Ihrem Hals
- Schwellendutsnesselte oder Juckreiz
Wenn Sie Symptome einer sofortigen Reaktion nach der Injektion haben, geben Sie sich nicht mehr Injektionen, wenn ein Gesundheitsdienstleister es Ihnen sagt.
- Brustschmerzen. Sie können Brustschmerzen als Teil einer sofortigen Reaktion nach der Injektion oder alleine haben. Diese Art von Brustschmerzen dauert normalerweise einige Minuten und kann ungefähr 1 Monat nach der Verwendung von Glatopa beginnen. Rufen Sie Ihren Gesundheitsdienstleister sofort an, wenn Sie bei der Verwendung von Glatopa Brustschmerzen haben.
- Schädigung Ihrer Haut. Beschädigung des Fettgewebes direkt unter der Hautoberfläche (Lipoatrophie) und selten den Tod Ihres Hautgewebes (Nekrose) kann auftreten, wenn Sie Glatopa verwenden. Eine Beschädigung des Fettgewebes unter Ihrer Haut kann zu einer Delle an der Injektionsstelle führen, die möglicherweise nicht verschwindet. Sie können Ihre Wahrscheinlichkeit reduzieren, diese Probleme zu entwickeln, durch:
- Befolgen Sie die Anweisungen Ihres Gesundheitsdienstleisters zur Verwendung von Glatopa
- Wählen Sie bei jeder Verwendung von Glatopa einen anderen Einspritzbereich. Siehe Schritt 4 in den Anweisungen zur Verwendung von Auswahl. Wählen Sie Ihren Einspritzbereich aus.
- Leberprobleme. Leberprobleme einschließlich Leberversagen können mit Glatopa auftreten. Rufen Sie Ihren Gesundheitsdienstleister sofort an, wenn Sie Symptome wie:
- Brechreiz
- Appetitverlust
- Müdigkeit
- dunkel gefärbter Urin und blasse Stühle
- vergilbt Ihrer Haut oder des weißen Teils Ihres Auges
- leichter blutend als normal
- Verwirrung
- Schläfrigkeit
Die häufigsten Nebenwirkungen von Glatopa sind:
- Hautprobleme an Ihrer Injektionsstelle, einschließlich:
- Rötung
- Schmerz
- Schwellung
- Juckreiz
- Klumpen
- Ausschlag
- Kurzatmigkeit
- spülen (vasodilation)
- Brustschmerzen
Sagen Sie Ihrem Gesundheitsdienstleister, wenn Sie einen Nebeneffekt haben, der Sie stört oder der nicht verschwindet.
Dies sind nicht alle möglichen Nebenwirkungen von Glatopa. Weitere Informationen finden Sie in Ihrem Gesundheitsdienstleister oder Apotheker.
Rufen Sie Ihren Arzt an, um medizinische Beratung zu Nebenwirkungen zu erhalten. Sie können die FDA bei 1-800-FDA-1088 Nebenwirkungen melden.
Wie soll ich Glatopa aufbewahren?
- Lagern Sie Glatopa im Kühlschrank zwischen 3 ° F und 46 ° F (2 ° C bis 8 ° C).
- Wenn Sie Glatopa nicht in der Lage sind, bis zu 1 Monat bei Raumtemperatur zwischen 59 ° F und 86 ° F (15 ° C bis 30 ° C) zu kühlen.
- Schützen Sie Glatopa vor Licht oder hoher Temperatur.
- Frieren Sie keine Glatopa -Spritzen ein. Wenn eine Spritze einfriert, werfen Sie sie in einem Sharps -Entsorgungsbehälter weg. Siehe Schritt 13 in den Anweisungen zur Verwendung Ihrer Nadeln und Spritzen.
Halten Sie Glatopa und alle Medikamente außerhalb der Reichweite der Kinder.
Allgemeine Informationen über den sicheren und effektiven Einsatz von Glatopa.
Medikamente werden manchmal für andere Zwecke als die in einem Medikamentenhandbuch aufgeführten Zwecke verschrieben. Verwenden Sie keinen Glatopa für einen Zustand, für den es nicht verschrieben wurde. Geben Sie anderen Menschen keinen Glatopa, auch wenn sie die gleichen Symptome wie Sie haben. Es kann ihnen schaden. Sie können Ihren Apotheker oder Gesundheitsdienstleister um Informationen zu Glatopa bitten, die für Angehörige der Gesundheitsberufe geschrieben wurden.
Was sind die Zutaten in Glatopa?
Wirkstoff: Glatiramer Acetat
Inaktive Zutaten: Mannitol
Dieser Medikamentenführer wurde von den US -amerikanischen Lebensmitteln und Drogen genehmigt
Anweisungen zur Verwendung
Glatopa®
(Gluh-toh-Fire)
(Glatirameracetat -Injektion) zur subkutanen Verwendung
Nur für subkutane Injektion.
Nicht Einmischen Sie Glatopa in Ihre Adern (intravenös).
Nicht Verwenden Sie Ihre vorgefüllten Glatopa-Spritzen wieder.
Nicht Teilen Sie Ihre vorgefüllten Glatopa-Spritzen mit einer anderen Person. Sie können einer anderen Person eine Infektion geben oder eine Infektion von ihnen erhalten.
Sie sollten Ihre erste Dosis Glatopa erhalten mit einem Gesundheitsdienstleister oder einer Krankenschwester anwesend. Dies kann in der Büro Ihres Gesundheitsdienstleisters oder in einer Krankenschwester für häusliche Gesundheit sein, die Ihnen zeigt, wie Sie Ihre eigenen Injektionen geben können.
Glatopa comes in either a 20 mg Pre-filled Syringe with needle attached or a 40 mg Pre-filled Syringe with needle attached. How often a dose is given depends on the product strength that is prescribed. Your healthcare provider will prescribe the correct dose for you.
Wenn Sie vorhaben, Ihr Glatiramer -Acetatprodukt mit einem AutoInjector zu verwenden, bitten Sie Ihren Gesundheitsdienstleister oder Apotheker, sicherzustellen . Wenn Sie einen Autoinjector verwenden, der nicht mit Ihrem Glatiramer -Acetat -Produkt verwendet werden soll, erhalten Sie möglicherweise nicht die richtige Dosis Ihres Arzneimittels.
Anweisungen zur Verwendung Ihres Glatopa 20 mg vorgefüllte Spritze:
- Glatopa 40 mg wird dreimal pro Woche in die Fettschicht unter Ihrer Haut injiziert (subkutan).
- Glatopa 40 mg should be given on the same 3 days each week if possible for example Monday Wednesday Und Friday. Give your Glatopa injections at least 48 hours (2 days) apart.
- Jede Glatopa 40 mg vorgefüllte Spritze dient nur für einzelne Verwendung (1 Zeitanwendung).
- Die Glatopa 40 mg-Dosis ist in Kisten mit 12 vorgefüllten Spritzen mit angebrachten Nadeln verpackt. Glatopa 40 mg Vorgefüllte Spritzen haben blaue Plungen.
Wie injiziere ich Glatopa?
Schritt 1: Sammeln Sie die Vorräte, die Sie benötigen, um Glatopa zu injizieren. Sehen Abbildung a .
- 1 Blisterpaket mit einer vorgefüllten Glatopa-Spritze mit Nadel-angebrachtem Alkoholwisch (nicht geliefert)
- Trockener Baumwollkugel (nicht geliefert)
- Ein Ort, an dem Sie Ihre Injektionen wie ein Notizbuch aufzeichnen können (nicht geliefert)
- Sharps -Entsorgungsbehälter (nicht geliefert). Siehe Schritt 13 unten entsorgen Sie Ihre Nadeln und Spritzen
 |
Abbildung a
Schritt 2: Entfernen Sie nur 1 Blisterpaket aus dem Glatopa-vorgefüllten Spritzenkarton. Siehe Abbildung B.
 |
- Legen Sie die Vorräte, die Sie benötigen, auf einer sauberen flachen Oberfläche in einem gut beleuchteten Bereich.
- Nachdem Sie 1 Blisterpack aus dem Karton entfernen, halten Sie alle nicht verwendeten Spritzen im Karton und lagern Sie sie im Kühlschrank.
- Lassen Sie den Blasen die Spritze in warm bis zur Raumtemperatur etwa 20 Minuten lang einpacken.
- Wasch deine Hände. Achten Sie darauf, Ihr Gesicht oder Ihr Haar nach dem Waschen Ihrer Hände nicht zu berühren.
Schritt 3: Schauen Sie sich Ihre vorgefüllte Glatopa-Spritze genau an.
- Es kann kleine Luftblasen in der Spritze geben. Nicht Versuchen Sie, die Luftblase aus der Spritze zu schieben, bevor Sie Ihre Injektion geben, damit Sie keine Medikamente verlieren.
- Überprüfen Sie das flüssige Medizin in der Spritze, bevor Sie Ihre Injektion geben. Die Flüssigkeit in der Spritze sollte klar und farblos aussehen und leicht gelb aussehen. Wenn die Flüssigkeit bewölkt ist oder Partikel enthält, verwenden Sie die Spritze nicht und werfen Sie sie in einen Scharfen -Entsorgungsbehälter weg. Siehe Schritt 13 unten entsorgen Sie Ihre Nadeln und Spritzen.
Schritt 4: Wählen Sie Ihren Einspritzbereich. Siehe Abbildung C.
Sehen Sie sich die Einspritzbereiche an, die Sie auf Ihrem Körper verwenden sollten. Sprechen Sie mit Ihrem Gesundheitsdienstleister über die Injektionsbereiche, die für Sie am besten geeignet sind.
Die möglichen Einspritzbereiche in Ihrem Körper umfassen (siehe Abbildung c ):
- Ihr Magenbereich (Bauch) um den Bauchnabel
- Der Hintergrundrücken
- obere Hüften (unter Ihrer Taille)
- Ihre Oberschenkel (über Ihren Knien)
 |
Abdomen
Vermeiden Sie ungefähr 2 Zoll um den Bauchnabel
 |
Rückseite der Hüften und Arme
Fleischige Bereiche der oberen Hüften immer unter der Taille
Fleischige Bereiche des oberen Rückenabschnitts der Arme
 |
Waffen
Fleischige Bereiche des oberen Rückenabschnitts
 |
Schenkel
Etwa 2 Zoll über dem Knie und 2 Zoll unter der Leistengegend
Abbildung c
- Wählen Sie für jede Glatopa -Dosis einen anderen Einspritzbereich aus 1 der oben gezeigten Bereiche. Siehe Abbildung C.
- Nicht stick the needle in the same place (site) more than 1 time each week. Jeder Injektionsbereich enthält mehrere Injektionsstellen, aus denen Sie auswählen können.
- Vermeiden Sie es immer wieder, an derselben Stelle injiziert zu werden.
- Halten Sie eine Aufzeichnung der Websites auf, an denen Sie Ihre Injektion jeden Tag geben, damit Sie sich daran erinnern, wo Sie bereits injiziert wurden.
Schritt 5: Bereiten Sie sich darauf vor, Ihre Injektion zu geben.
- Es gibt einige Einspritzbereiche in Ihrem Körper, die schwer zu erreichen sind (wie die Rückseite Ihres Arms). Möglicherweise benötigen Sie Hilfe von jemandem, der angewiesen wurde, wie Sie Ihre Injektion geben können, wenn Sie bestimmte Einspritzbereiche nicht erreichen können.
- Nicht inject in sites where the skin has scarring or dents. Using scarred or dented skin for your injections may make your skin worse.
Schritt 6: Reinigen Sie Ihre Injektionsstelle.
- Reinigen Sie die Injektionsstelle mit dem Alkoholwischtuch und lassen Sie Ihre Haut lufttrocknen. Siehe Abbildung D.
 |
Schritt 7: Nehmen Sie die Spritze mit 1 Hand und halten Sie sie wie einen Bleistift. Entfernen Sie die Nadelabdeckung mit Ihrer anderen Hand und legen Sie sie beiseite. Siehe Abbildung E.
 |
Schritt 8: Kneifen Sie etwa 2 Zoll Hautfalte zwischen Daumen und Zeigefinger. Siehe Abbildung F.
 |
Schritt 9: Geben Sie Ihre Injektion.
Lassen Sie die Ferse Ihrer Hand die Spritze an der Injektionsstelle gegen Ihre Haut halten. Setzen Sie die Nadel in einem Winkel von 90 Grad direkt in Ihre Haut ein. Siehe Abbildung G.
 |
Wenn die Nadel in Ihre Haut liegt, füllen Sie die Hautfalte frei. Siehe Abbildung H.
 |
Schritt 10: Geben Sie Ihre Glatopa -Injektion.
Um das Medikament zu injizieren, halten Sie die Spritze stetig und schieben Sie langsam den Kolben hinunter. Siehe Abbildung I.
 |
Schritt 11: Entfernen Sie die Nadel.
ist Loratadin genauso wie Claritin
Nachdem Sie alle Medikamente injiziert haben, ziehen Sie die Nadel direkt heraus. Siehe Abbildung J.
 |
Schritt 12 : Verwenden Sie einen sauberen trockenen Baumwollkugel, um ein paar in die Injektionsstelle zu drücken, wenn die Nadel bis in Ihre Haut die Hautfalte freisetzt. Sekunden. Reiben Sie die Injektionsstelle nicht oder verwenden Sie die Nadel oder Spritze erneut. Siehe Abbildung K.
 |
Schritt 13: Entsorgen Sie Ihre Nadeln und Spritzen.
- Legen Sie Ihre gebrauchten Nadeln und Spritzen sofort nach dem Gebrauch in einen von der FDA geschlossenen Sharps-Entsorgungsbehälter. Nicht throw away (dispose of) loose needles Und syringes in your household tAusschlag.
- Wenn Sie keinen von der FDA geschlossenen Sharps-Entsorgungsbehälter haben, können Sie einen Haushaltsbehälter verwenden, der lautet:
- aus einem schweren Plastik
- Kann mit einem eng anliegenden pünktlichen resistenten Deckel geschlossen werden, ohne dass Scharfe herauskommen können
- während des Gebrauchs aufrecht und stabil
- leckebeständig und
- ordnungsgemäß markiert, um vor gefährlichen Abfällen im Behälter zu warnen.
- Wenn Ihr Sharps -Entsorgungsbehälter nahezu voll ist, müssen Sie Ihre Community -Richtlinien befolgen, um den richtigen Weg zur Entsorgung Ihres Scharfen -Entsorgungsbehälters zu entsorgen. Es kann Staat oder lokale Gesetze darüber geben, wie Sie gebrauchte Nadeln und Spritzen wegwerfen sollten. Weitere Informationen zur Entsorgung sicherer Sharps und spezifische Informationen zur Entsorgung von Sharps im Bundesstaat finden Sie in der FDA -Website unter: https://www.fda.gov/safesharpsDisposal.
- Nicht dispose of your used sharps disposal container in your household tAusschlag unless your community guidelines permit this. Nicht recycle your used sharps disposal container.
 |
Diese Verwendung wurden von der US -amerikanischen Food and Drug Administration genehmigt.