Apidra
Die Informationen Auf Dieser Website Stellen Keine Medizinische Beratung Dar. Wir Verkaufen Nichts. Die Richtigkeit Der Übersetzung Wird Nicht Garantiert. Haftungsausschluss
Drogenzusammenfassung
Was ist Apidra?
Apidra (Insulinglulisine [rDNA -Ursprung] Inj) ist ein Hormon, das in dem Körper hergestellt wird, der zur Behandlung von Diabetes bei Erwachsenen und Kindern, die mindestens 4 Jahre alt sind, behandelt werden. Apidra wird normalerweise zusammen mit einem lang wirkenden Insulin verabreicht.
Was sind Nebenwirkungen von Apidra?
Zu den häufigen Nebenwirkungen von Apidra gehören:
- Reaktionen der Injektionsstelle (Schmerzrötung oder Reizung).
Apidra kann einen niedrigen Blutzucker (Hypoglykämie) verursachen. Sagen Sie Ihrem Arzt, wenn Sie Symptome von niedrigem Blutzucker auftreten, einschließlich plötzlich schwitzendes Schütteln (Zittern). Sagen Sie Ihrem Arzt, wenn Sie ernsthafte Nebenwirkungen von Apidra haben, einschließlich:
- Anzeichen eines niedrigen Kaliumspiegels im Blut (wie Muskelkrämpfe Schwäche unregelmäßiger Herzschlag).
Dosierung für Apidra
Die Dosierung von Apidra ist individualisiert. Die Blutzuckerüberwachung ist unerlässlich. Die tägliche Insulinanforderung kann variieren und liegt normalerweise zwischen 0,5 und 1 Einheit/kg/Tag.
Welche Drogensubstanzen oder Nahrungsergänzungsmittel interagieren mit Apidra?
Apidra kann mit Albuterol Clonidin Guanethidin Lanreotid Niacin Octreotid Pramlintid Reserpin oder Beta-Blockern interagieren. Viele andere Medikamente können die Auswirkungen von Apidra auf die Senkung Ihres Blutzuckers erhöhen oder verringern. Sagen Sie Ihrem Arzt alle verschreibungspflichtigen und rezeptfreien Medikamente und Nahrungsergänzungsmittel, die Sie verwenden. Sagen Sie Ihrem Arzt, wenn Sie schwanger sind, bevor Sie Apidra verwenden. Wenn Sie eine Schwangerschaft planen, besprechen Sie einen Plan, um Ihren Blutzucker mit Ihrem Arzt zu behandeln, bevor Sie schwanger werden. Ihr Arzt kann die Art des Insulins wechseln, den Sie während der Schwangerschaft verwenden. Es ist nicht bekannt, ob dieses Medikament in die Muttermilch übergeht. Wenden Sie sich vor dem Stillen an Ihren Arzt.
Weitere Informationen
Unsere Apidra (Insulin -Glulisine [rDNA -Ursprung] Inj) -Seitwirkungsdrogenzentrum bietet eine umfassende Übersicht über verfügbare Arzneimittelinformationen über die potenziellen Nebenwirkungen bei dieser Medikamente.
FDA -Drogeninformationen
- Drogenbeschreibung
- Indikationen
- Nebenwirkungen
- Wechselwirkungen mit Arzneimitteln
- Warnungen
- Überdosis
- Klinische Pharmakologie
- Medikamentenhandbuch
Beschreibung für Apidra
Apidra® (Insulinglulisinjektion) ist ein schnell wirkendes humanes Insulinanalogon, das zur Senkung des Blutzuckers verwendet wird. Insulinglulisin wird durch rekombinante DNA-Technologie unter Verwendung eines nicht pathogenen Laborstammes von produziert Sie zeigten Chill (K12). Insulinglulisin unterscheidet sich von menschlichem Insulin darin, dass das Aminosäure -Sparagin an Position B3 durch Lysin ersetzt wird und das Lysin in Position B29 durch Glutaminsäure ersetzt wird. Chemisch Insulinglulisine ist 3B-Lysin-29BGlutaminsäure-Human Insulin hat die empirische Formel C.258H384N64O78S6 und ein Molekulargewicht von 5823 und hat die folgende strukturelle Formel:
 |
Apidra (insulin glulisine injection) is a sterile aqueous clear Und colorless solution for subcutaneous or intravenous use. Each milliliter of Apidra contains 100 units (3.49 mg) insulin glulisine 3.15 mg metacresol 6 mg tromethamine 5 mg sodium chloride 0.01 mg polysorbate 20 Und water for injection. Apidra has a pH of approximately 7.3. The pH is adjusted by addition of aqueous solutions of hydrochloric acid Und/or sodium hydroxide.
Verwendung für Apidra
Apidra is indicated to improve glycemic control in adults Und children with diabetes mellitus.
Dosierung für Apidra
Dosierungsüberlegungen
Apidra is a recombinant insulin analog that is equipotent to human insulin (i.e. one unit of Apidra has the same glucose-lowering effect as one unit of regular human insulin) when given intravenously. When given subcutaneously Apidra has a more rapid onset of action Und a shorter duration of action than regular human insulin.
Die Dosierung von Apidra muss individuell werden. Die Blutzuckerüberwachung ist bei allen Patienten, die eine Insulintherapie erhalten, von wesentlicher Bedeutung.
Die tägliche Insulinanforderung kann variieren und liegt normalerweise zwischen 0,5 und 1 Einheit/kg/Tag. Die Insulinanforderungen können während der Stresskrankheit oder bei Veränderungen der Mahlzeitmuster oder mit koadministerierten Arzneimitteln verändert werden.
Subkutane Verabreichung
Apidra should be given within 15 minutes before a meal or within 20 minutes after starting a meal.
Apidra given by subcutaneous injection should generally be used in regimens with an intermediate or long-acting insulin.
Apidra should be administered by subcutaneous injection in the abdominal wall thigh or upper arm. Injection sites should be rotated within the same region (abdomen thigh or upper arm) from one injection to the next to reduce the risk of lipodystrophy [See Nebenwirkungen ].
Kontinuierliche subkutane Infusion (Insulinpumpe)
Apidra may be administered by continuous subcutaneous infusion in the abdominal wall. Do not use diluted or mixed insulins in external insulin pumps. Infusion sites should be rotated within the same region to reduce the risk of lipodystrophy [See Nebenwirkungen ]. The initial programming of the external insulin infusion pump should be based on the total daily insulin dose of the previous regimen.
Die folgenden Insulinpumpen † wurden in apidra klinischen Studien von Sanofiaventis als Hersteller von Apidra verwendet:
- Diseteronic® H-Tron® Plus V100 und D-Tron® mit Disetronic Catheters (Rapid ™ Rapid C ™ Rapid D ™ und Tender ™)
- Minimed® Modelle 506 507 507c und 508 mit Minimed Catheters (Sof-Set Ultimate QR ™ und Quick-Set ™).
Bevor Sie eine andere Insulinpumpe mit Apidra verwenden, lesen Sie die Pumpenbezeichnung, um sicherzustellen, dass die Pumpe mit Apidra bewertet wurde.
Ärzte und Patienten sollten die Informationen zur Pumpenverwendung in der APIDRA -Verschreibungsinformationsblättern und im Handbuch des Pumpenherstellers sorgfältig bewerten. APIDRA-spezifische Informationen sollten für die Zeithäufigkeit in der Verwendung von Infusionssätzen oder anderen Details, die für die Verwendung von APIDRA spezifisch sind, befolgt werden, da die apidra-spezifischen Informationen von den Anweisungen der allgemeinen Pumpenhandbuch abweichen können. Wenn Sie die apidra-spezifischen Anweisungen nicht befolgen, kann dies zu schwerwiegenden unerwünschten Ereignissen führen.
Patienten, die APIDRA durch kontinuierliche subkutane Infusion verabreichen, müssen bei einem Ausfall des Pumpensystems ein alternatives Insulinabgabesystem aufweisen.
Bezogen auf in vitro Studien, die gezeigt haben, dass der Verlust der konservativen Metacresol- und Insulinabbausapidra im Reservoir mindestens alle 48 Stunden geändert werden sollte. Apidra sollte nicht Temperaturen von mehr als 98,6 ° F (37 ° C) ausgesetzt sein. In der klinischen Verwendung muss die Infusionssätze und die Apidra im Reservoir mindestens alle 48 Stunden geändert werden [siehe Warnungen und VORSICHTSMASSNAHMEN Und Wie geliefert / Lagerung und Handhabung ].
Intravenöse Verwaltung
Apidra can be administered intravenously under medical supervision for glycemic control with close monitoring of blood glucose Und serum potassium to avoid hypoglycemia Und hypokalemia. For intravenous use Apidra should be used at concentrations of 0.05 Units/mL to 1 Unit/mL insulin glulisine in infusion systems using polyvinyl chloride (PVC) bags. Apidra has been shown to be stable only in normal saline solution (0.9% sodium chloride). Parenteral drug products should be inspected visually for particulate matter Und discoloration prior to administration whenever solution Und container permit. Do not administer insulin mixtures intravenously.
Wie geliefert
Dosierungsformen und Stärken
Apidra 100 Einheiten pro ml (u-100) sind erhältlich als:
- 10 ml Fläschchen
- 3 ml Solostar -vorgefüllter Stift
Lagerung und Handhabung
Apidra 100 Einheiten pro ml (u-100) sind erhältlich als:
10 ml Fläschchen NDC 0088-2500-33
3 ml Solostar -vorgefüllter Stift package of 5 NDC 0088-2502-05
Stiftnadeln sind nicht in den Packs enthalten.
Solostar ist mit allen Stiftnadeln von Becton Dickinson und Company Ypsomed und Owen Mumford kompatibel.
Lagerung
Verwenden Sie nach dem Ablaufdatum nicht (siehe Karton und Container).
Ungeöffnetes Fläschchen/Solostar
Unöffnete Apidra-Fläschchen und Solostar sollten in einem Kühlschrank auf 36 ° F-46 ° F (2 ° C-8 ° C) gelagert werden. Vor Licht schützen. Apidra sollte nicht im Gefrierschrank gespeichert werden und es sollte nicht gefrieren dürfen. Wegwerfen, wenn es eingefroren wurde. Ungeöffnete Fläschchen/Solostar, die nicht in einem Kühlschrank gespeichert sind, müssen innerhalb von 28 Tagen verwendet werden.
Offenes (in Gebrauch) Fläschchen
Geöffnete Fläschchen, ob gekühlt werden oder nicht, müssen innerhalb von 28 Tagen verwendet werden. Wenn Kühlung nicht möglich ist, kann die im Gebrauch von offene Flächen nicht mehr über 28 Tage vor direkter Wärme und Licht entfernt gehalten werden, solange die Temperatur nicht mehr als 25 ° C beträgt.
Offener (in Gebrauch) vorgefüllter Solostar-Stift
Der geöffnete (in Gebrauch) Solostar sollte nicht gekühlt werden, sondern sollte unter 77 ° F (25 ° C) von direkter Wärme und Licht entfernt gehalten werden. Der geöffnete (in Gebrauch) bei Raumtemperatur gehaltene Solostar muss nach 28 Tagen verworfen werden.
Infusionssätze
Infusionssätze (reservoirs tubing Und catheters) Und the Apidra in the reservoir must be discarded after 48 hours of use or after exposure to temperatures that exceed 98.6°F (37°C).
Intravenöser Gebrauch
Infusionstaschen wie angegeben unter Dosierung und Verwaltung sind 48 Stunden bei Raumtemperatur stabil.
Vorbereitung und Handhabung
Nach der Verdünnung für die intravenöse Verwendung sollte die Lösung vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden. Verwenden Sie die Lösung nicht, wenn sie wolkig geworden ist oder Partikel enthält. Verwenden Sie nur, wenn es klar und farblos ist. Apidra ist nicht mit Dextrose -Lösung und Ringer -Lösung kompatibel und kann daher nicht mit diesen Lösungsflüssigkeiten verwendet werden. Die Verwendung von Apidra mit anderen Lösungen wurde nicht untersucht und wird daher nicht empfohlen.
Sanofi-Aventis US LLC Bridgewater NJ 08807 Eine Sanofi-Firma. Revisionsdatum: 05/2014
Nebenwirkungen for Apidra
Die folgenden nachteiligen Reaktionen werden an anderer Stelle erörtert:
- Hypoglykämie [siehe Warnungen und VORSICHTSMASSNAHMEN ]
- Hypokaliämie [siehe Warnungen und VORSICHTSMASSNAHMEN ]
Klinische Versuchserfahrung
Da klinische Studien unter stark unterschiedlichen Konstruktionen durchgeführt werden, können die in einer klinischen Studie angegebenen unerwünschten Reaktionsraten möglicherweise nicht leicht zu den in einer anderen klinischen Studie gemeldeten Raten verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis tatsächlich beobachteten Raten wider.
Die Häufigkeiten unerwünschter Arzneimittelreaktionen während der klinischen Studien von Apidra bei Patienten mit Typ -1 -Diabetes mellitus und Typ -2 -Diabetes mellitus sind in den folgenden Tabellen aufgeführt.
Tabelle 1: Behandlung - emergente unerwünschte Ereignisse in gepoolten Studien von Erwachsenen mit Typ -1 -Diabetes (unerwünschte Ereignisse mit Häufigkeit von ≥ 5%)
| Apidra % (n = 950) | Alle Vergleichera % (n = 641) | |
| Nasopharynngitis | 10.6 | 12.9 |
| Hypoglykämieb | 6.8 | 6.7 |
| Obere Atemwege | 6.6 | 5.6 |
| Grippe | 4.0 | 5.0 |
| a Insulin Lipro regelmäßiges humanes Insulin -Insulin -Aspart b Nur schwere symptomatische Hypoglykämie |
Tabelle 2: Behandlung - emergente unerwünschte Ereignisse in gepoolten Studien von Erwachsenen mit Typ -2 -Diabetes (unerwünschte Ereignisse mit Häufigkeit von ≥ 5%)
| Apidra % (n = 883) | Regelmäßige menschliche Insulin % (n = 883) | |
| Obere Atemwege infection | 10.5 | 7.7 |
| Nasopharynngitis | 7.6 | 8.2 |
| Ödemperiphere | 7.5 | 7.8 |
| Grippe | 6.2 | 4.2 |
| Arthralgie | 5.9 | 6.3 |
| Hypertonie | 3.9 | 5.3 |
Pädiatrie
Tabelle 3 fasst die nachteiligen Reaktionen zusammen, die in einer klinischen Studie bei Kindern und Jugendlichen mit einer mit Apidra (n = 277) oder Insulin lispro (n = 295) behandelten Typ -1 -Diabetes mit einer Häufigkeit von mehr als 5% mehr als 5% auftreten.
Tabelle 3: Behandlungen - emergente unerwünschte Ereignisse bei Kindern und Jugendlichen mit Typ -1 -Diabetes (unerwünschte Reaktionen mit Frequenz ≥ 5%)
| Apidra % (n = 277) | Lipro % (n = 295) | |
| Nasopharynngitis | 9.0 | 9.5 |
| Obere Atemwege infection | 8.3 | 10.8 |
| Kopfschmerzen | 6.9 | 11.2 |
| Hypoglykämischer Anfall | 6.1 | 4.7 |
Schwere symptomatische Hypoglykämie
Hypoglykämie is the most commonly observed adverse reaction in patients using insulin including Apidra [See Warnungen und VORSICHTSMASSNAHMEN ]. The rates Und incidence of severe symptomatic hypoglycemia defined as hypoglycemia requiring intervention from a third party were comparable for all treatment regimens (see Table 4). In the phase 3 clinical trial children Und adolescents with type 1 diabetes had a higher incidence of severe symptomatic hypoglycemia in the two treatment groups compared to adults with type 1 diabetes. (see Table 4) [See Klinische Studien ].
Tabelle 4: Schwere symptomatische Hypoglykämie*
| Typ -1 -Diabetes Erwachsene 12 Wochen mit Insulinglargine | Typ -1 -Diabetes Erwachsene 26 Wochen mit Insulinglargine | Typ -2 -Diabetes Erwachsene 26 Wochen mit NPH Human Insulin | Typ -1 -Diabetes -Pädiatrie 26 Wochen | ||||||
| Apidra Pre-meal | Apidra Post-meal | Regelmäßiges menschliches Insulin | Apidra | Insulin Lispro | Apidra | Regelmäßiges menschliches Insulin | Apidra | Insulin Lispro | |
| Ereignisse pro Monat pro Patient | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Prozent der Patienten (N/Total N) | 8,4% (24/286) | 8,4% (25/296) | 10,1% (28/278) | 4,8% (16/339) | 4,0% (13/333) | 1,4% (6/416) | 1,2% (5/420) | 16,2% (45/277) | 19,3% (57/295) |
| * Schwere symptomatische Hypoglykämie definiert als ein hypoglykämisches Ereignis, das die Unterstützung einer anderen Person erfordert, die eines der folgenden Kriterien erfüllt <36mg/dL or the event was associated with prompt recovery after oral carbohydrate intravenous glucose or glucagon administration. |
Initiation und Intensivierung der Glukosekontrolle
Intensivierung oder rasche Verbesserung der Glukosekontrolle wurde mit einer vorübergehenden reversiblen ophthalmologischen Brechungsstörung in Verbindung gebracht, die sich einer diabetischen Retinopathie und einer akuten schmerzhaften peripheren Neuropathie verschlechtert. Die langfristige glykämische Kontrolle verringert jedoch das Risiko einer diabetischen Retinopathie und Neuropathie.
Lipodystrophie
Die langfristige Verwendung von Insulin einschließlich Apidra kann an der Stelle von wiederholten Insulininjektionen oder Infusionen Lipodystrophie verursachen. Lipodystrophie umfasst Lipohypertrophie (Verdickung von Fettgewebe) und Lipoatrophie (Verdünnung des Fettgewebes) und kann die Insulinabsorption beeinflussen. Drehen Sie die Insulininjektions- oder Infusionsstellen innerhalb derselben Region, um das Risiko einer Lipodystrophie zu verringern. [Sehen Dosierung und Verwaltung ].
Gewichtszunahme
Gewichtszunahme can occur with insulin therapy including Apidra Und has been attributed to the anabolic effects of insulin Und the decrease in glucosuria.
Peripheres Ödem
Insulin einschließlich Apidra kann Natriumretention und Ödeme verursachen, insbesondere wenn die bisher schlechte Stoffwechselkontrolle durch eine verstärkte Insulintherapie verbessert wird.
Nebenwirkungen mit kontinuierlicher subkutaner Insulininfusion (CSII)
In einer 12-wöchigen randomisierten Studie an Patienten mit Typ-1-Diabetes (n = 59) waren die Raten von Katheterverschluss und Infusionsstellenreaktionen bei apidra- und insulin-Aspart behandelten Patienten ähnlich (Tabelle 5).
Tabelle 5: Katheterverschluss und Reaktionen der Infusionsstelle.
| 40% | Apidra (n=29) | Insulin Aspart (n = 30) |
| Katheterverschluss/Monat | 0.08 | 0.15 |
| Reaktionen der Infusionsstelle | 10,3% (3/29) | 13,3% (4/30) |
Allergische Reaktionen
Lokale Allergie
Wie bei jeder Insulin -Therapie können Patienten, die Apidra einnehmen, eine Rötung an Schwellungen oder Juckreiz am Injektionsort erleben. Diese geringfügigen Reaktionen lösen sich normalerweise in wenigen Tagen bis einige Wochen auf, aber in einigen Fällen können möglicherweise Apidra abgesetzt werden. In einigen Fällen können diese Reaktionen mit anderen Faktoren als Insulin wie Reizstoffen in einem Hautreinigungsmittel oder einer schlechten Injektionstechnik zusammenhängen.
Systemische Allergie
Bei jedem Insulin, einschließlich Apidra, kann schwere lebensbedrohliche verallgemeinerte Allergie einschließlich Anaphylaxie auftreten. Eine generalisierte Allergie gegen Insulin kann einen Ganzkörperausschlag (einschließlich Pruritus) verursachen Dyspnoe -Keuchen -Hypotonie -Tachykardie oder Diaphorese.
In kontrollierten klinischen Studien wurden bis zu 12 Monate potenzielle systemische allergische Reaktionen bei 79 von 1833 Patienten (4,3%) berichtet, die Apidra und 58 von 1524 Patienten (3,8%) erhielten, die die kurzwirkenden Insuline des Komparators erhielten. Während dieser Studien wurde die Behandlung mit Apidra aufgrund einer potenziellen systemischen allergischen Reaktion dauerhaft eingestellt.
Lokalisierte Reaktionen und verallgemeinerte Myalgien wurden unter Verwendung von Metacresol berichtet, was ein Hilfsmittel von Apidra ist.
Antikörperproduktion
In einer Studie an Patienten mit Typ-1-Diabetes (n = 333) blieben die Konzentrationen von Insulinantikörpern, die sowohl mit humanem Insulin als auch mit Insulinglulisin (Kreuzreaktivinsulin-Antikörper) in den ersten 6 Monaten der Studie in den mit Apidra behandelten Patienten reagieren. In den folgenden 6 Monaten der Studie wurde eine Abnahme der Antikörperkonzentration beobachtet. In einer Studie an Patienten mit Typ-2-Diabetes (n = 411) wurde bei den mit Apidra behandelten Patienten und bei den mit menschlichen Insulin behandelten Patienten in den ersten 9 Monaten der Studie ein ähnlicher Anstieg der mit apidra behandelten Patienten beobachtet. Danach nahm die Konzentration von Antikörpern bei den Apidra -Patienten ab und blieb bei den menschlichen Insulinpatienten stabil. Es bestand keine Korrelation zwischen kreuzreaktivem Insulinantikörperkonzentration und Veränderungen der HbA1c-Insulindosen oder der Inzidenz von Hypoglykämie. Die klinische Bedeutung dieser Antikörper ist nicht bekannt.
Apidra did not elicit a significant antibody response in a study of children Und adolescents with type 1 diabetes.
Nachmarkterfahrung
Die folgenden nachteiligen Reaktionen wurden während der Verwendung von APIDRA nach der Annahme identifiziert.
Da diese Reaktionen freiwillig aus einer Population unsicherer Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder ein kausales Verhältnis zur Arzneimittelexposition herzustellen.
Es wurden Medikationsfehler berichtet, bei denen andere Insuline, besonders lang wirkende Insuline, versehentlich anstelle von Apidra verabreicht wurden [siehe Patienteninformationen ].
Wechselwirkungen mit Arzneimitteln for Apidra
Eine Reihe von Arzneimitteln beeinflussen den Glukosestoffwechsel und kann eine Anpassung der Insulindosis und insbesondere die genaue Überwachung erfordern.
Drugs that may increase the blood glucose-lowering effect of insulins including APIDRA and therefore increase the risk of hypoglycemia include oral antidiabetic products pramlintide ACE inhibitors disopyramide fibrates fluoxetine monoamine oxidase inhibitors propoxyphene pentoxifylline salicylates somatostatin analogs and sulfonamide antibiotics.
Medikamente, die die blutglucosesenkende Wirkung von Apidra verringern können, umfassen Corticosteroide Niacin Danazol Diuretik Sympathomimetische Wirkstoffe (z. Inhibitoren und atypische Antipsychotika.
Beta-Blocker-Clonidin-Lithiumsalze und Alkohol können entweder die blutglukosesenkende Wirkung von Insulin erhöhen oder verringern.
Pentamidin kann zu einer Hypoglykämie führen, auf die manchmal eine Hyperglykämie folgen kann.
Die Anzeichen einer Hypoglykämie können bei Patienten reduziert oder nicht vorhanden sein, die Anti-adrenerge Medikamente wie Beta-Blocker-Clonidin-Guanethidin und Reserpin einnehmen.
Warnungen für Apidra
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Abschnitt.
Vorsichtsmaßnahmen für Apidra
Dosierungseinstellung und -überwachung
Die Glukoseüberwachung ist für Patienten, die eine Insulintherapie erhalten, von wesentlicher Bedeutung. Änderungen an einem Insulinregime sollten vorsichtig und nur unter medizinischer Aufsicht vorgenommen werden. Änderungen der Insulinstärke -Herstellertyp oder -verwaltungsmethode können dazu führen, dass eine Änderung der Insulindosis erforderlich ist. Eine gleichzeitige orale antidiabetische Behandlung muss möglicherweise angepasst werden.
Wie bei allen Insulinvorbereitungen kann die zeitliche Vorgehensweise für Apidra bei verschiedenen Personen oder zu unterschiedlichen Zeiten bei derselben Person variieren und hängt von vielen Bedingungen ab, einschließlich des Ortes der lokalen Blutversorgung oder der lokalen Temperatur. Patienten, die ihre körperliche Aktivität oder ihr Mahlzeitplan ändern, müssen Insulin -Dosierungen angepasst werden.
Hypoglykämie
Hypoglykämie is the most common adverse reaction of insulin therapy including Apidra. The risk of hypoglycemia increases with tighter glycemic control. Patients must be educated to recognize Und manage hypoglycemia. Severe hypoglycemia may lead to unconsciousness Und/or convulsions Und may result in temporary or permanent impairment of brain function or death. Severe hypoglycemia requiring the assistance of another person Und/or parenteral glucose infusion or glucagon administration has been observed in clinical trials with insulin including trials with Apidra.
Der Zeitpunkt der Hypoglykämie spiegelt normalerweise das Zeit-Action-Profil der verabreichten Insulinformulierungen wider. Andere Faktoren wie Änderungen der Nahrungsaufnahme (z. B. Menge an Lebensmitteln oder Zeitpunkt der Mahlzeiten) Injektionsstelle und gleichzeitige Medikamente können auch das Risiko einer Hypoglykämie verändern [siehe Wechselwirkungen mit Arzneimitteln ].
Wie bei allen Insulinen sind Vorsicht bei Patienten mit Hypoglykämie -Unwachheit und bei Patienten, die möglicherweise für Hypoglykämie prädisponiert sind (z. B. die pädiatrische Bevölkerung und Patienten, die schnell oder eine unregelmäßige Nahrungsaufnahme haben). Die Fähigkeit des Patienten, sich zu konzentrieren und zu reagieren, kann aufgrund einer Hypoglykämie beeinträchtigt werden. Dies kann ein Risiko in Situationen darstellen, in denen diese Fähigkeiten besonders wichtig sind, z. B. das Fahren oder Betrieb anderer Maschinen.
Schnelle Veränderungen der Serumglukosespiegel können Symptome in Bezug auf Hypoglykämie bei Personen mit Diabetes unabhängig vom Glukosewert induzieren. Frühe Warnsymptome einer Hypoglykämie können unter bestimmten Erkrankungen, wie z. Wechselwirkungen mit Arzneimitteln ] oder intensivierte Diabeteskontrolle. Diese Situationen können vor dem Bewusstsein des Patienten für eine Hypoglykämie zu einer schweren Hypoglykämie (und möglicherweise zu einem Bewusstseinsverlust) führen.
Intravenös verabreichtes Insulin hat einen schnelleren Einsetzen von Wirkung als subkutan verabreichtes Insulin, das eine genauere Überwachung der Hypoglykämie erfordert.
Überempfindlichkeit und allergische Reaktionen
Schwere lebensbedrohliche verallgemeinerte Allergie einschließlich Anaphylaxie kann bei Insulinprodukten einschließlich Apidra auftreten [siehe Nebenwirkungen ].
Hypokaliämie
Alle Insulinprodukte, einschließlich Apidra, führen zu einer Verschiebung des Kaliums vom extrazellulären zum intrazellulären Raum, der möglicherweise zu einer Hypokaliämie führt. Eine unbehandelte Hypokaliämie kann zu einer ventrikulären Arrhythmie und dem Tod von Atemwegslähmung führen. Verwalten Sie Vorsicht bei Patienten, bei denen möglicherweise ein Risiko für Hypokaliämie besteht (z. B. Patienten mit Kaliumsenkungs-Medikamenten Patienten, die Medikamente einnehmen, die für Serumkaliumkonzentrationen empfindlich sind). Überwachen Sie Glukose und Kalium häufig, wenn Apidra intravenös verabreicht wird.
Nieren- oder Leberbeeinträchtigung
Bei Patienten mit Nieren- oder Leberbeeinträchtigung kann eine häufige Glukoseüberwachung und Insulindosisreduktion erforderlich sein [siehe Klinische Pharmakologie ].
Mischung von Insulinen
Apidra for subcutaneous injection should not be mixed with insulin preparations other than NPH insulin. If Apidra is mixed with NPH insulin Apidra should be drawn into the syringe first. Injection should occur immediately after mixing.
Mischen Sie Apidra nicht mit anderen Insulinen für die intravenöse Verabreichung oder zur Verwendung in einer kontinuierlichen subkutanen Infusionspumpe.
Apidra for intravenous administration should not be diluted with solutions other than 0.9% sodium chloride (normal saline). The efficacy Und safety of mixing Apidra with diluents or other insulins for use in external subcutaneous infusion pumps have not been established.
Subkutane Insulin -Infusionspumpen
Wenn in einer externen Insulinpumpe für subkutane Infusions -Apidra verwendet werden, sollte Apidra nicht mit einem anderen Insulin verdünnt oder gemischt werden. Apidra im Reservoir muss mindestens alle 48 Stunden geändert werden. Apidra sollte nicht Temperaturen von mehr als 98,6 ° F (37 ° C) ausgesetzt sein.
Eine Fehlfunktion der Insulinpumpe oder Infusionssatz oder Handhabungsfehler oder Insulinabbau kann schnell zu einer Hyperglykämie -Ketose und einer diabetischen Ketoazidose führen. Eine sofortige Identifizierung und Korrektur der Ursache für Hyperglykämie oder Ketose oder diabetische Ketoazidose ist erforderlich. Es können vorläufige subkutane Injektionen mit Apidra erforderlich sein. Patienten, die eine kontinuierliche subkutane Insulin -Infusionspumpen -Therapie verwenden, müssen geschult werden, um Insulin durch Injektion zu verabreichen und eine alternative Insulin -Therapie zur Verfügung zu stellen. [Sehen Dosierung und Verwaltung Wie geliefert / Lagerung und Handhabung Und Patienteninformationen ].
Intravenöse Verwaltung
Wenn die Apidra intravenös verabreicht wird, müssen Glukose- und Kaliumspiegel genau überwacht werden, um eine potenziell tödliche Hypoglykämie und Hypokaliämie zu vermeiden.
Mischen Sie Apidra nicht mit anderen Insulinen für die intravenöse Verabreichung. Apidra kann nur in normaler Kochsalzlösung verdünnt werden.
Wechselwirkungen mit Arzneimitteln
Einige Medikamente können den Insulinanforderungen und das Risiko für Hypoglykämie oder Hyperglykämie verändern [siehe Wechselwirkungen mit Arzneimitteln ].
Flüssigkeitsretention und Herzinsuffizienz mit gleichzeitiger Verwendung von PPAR-Gamma-Agonisten
Thiazolidinierte (TZDs), die Peroxisom-Proliferator-aktivierte Rezeptor (PPAR) -Gamma-Agonisten sind, können eine dosisbedingte Flüssigkeitsretention verursachen, insbesondere wenn sie in Kombination mit Insulin verwendet werden. Die Flüssigkeitsretention kann zu Herzinsuffizienz führen oder verschärfen. Patienten, die mit Insulin behandelt werden, einschließlich Apidra und einem PPAR-Gamma-Agonisten, sollten für Anzeichen und Symptome einer Herzinsuffizienz beobachtet werden. Wenn sich Herzinsuffizienz entwickelt, sollte es gemäß den aktuellen Pflegestandards verwaltet werden, und die Abnahme oder Dosisreduktion des PPAR-Gamma-Agonisten muss berücksichtigt werden.
Patientenberatungsinformationen
Siehe von der FDA zugelassen Patientenkennzeichnung .
Anweisungen für alle Patienten
Die Patienten sollten auf Selbstverwaltungsverfahren wie Glukoseüberwachung angewiesen werden, die die richtige Injektionstechnik und das Management von Hypoglykämie und Hyperglykämie beobachten. Die Patienten müssen über die Umgang mit besonderen Situationen wie interkurrenten Bedingungen (Krankheitsstress oder emotionale Störungen) angewiesen werden. Eine unzureichende oder übersprungene Insulindosis versehentlich verabreicht eine erhöhte Insulindosis unzureichende Nahrungsaufnahme und übersprungene Mahlzeiten. Weitere Informationen finden Sie in der Apidra -Patientinformationsblätterblatt.
Frauen mit Diabetes sollten empfohlen werden, ihren Arzt zu informieren, wenn sie schwanger sind oder über eine Schwangerschaft nachdenken.
Es wurden zufällige Verwechseltäter zwischen Apidra und anderen Insulinen, insbesondere lang wirkenden Insulinen, berichtet. Um Medikationsfehler zwischen Apidra und anderen Insulinenpatienten zu vermeiden, sollten Patienten angewiesen werden, das Insulin -Etikett immer vor jeder Injektion zu überprüfen.
Bei Patienten, die kontinuierliche subkutane Insulinpumpen verwenden
Patienten, die eine externe Pumpeninfusionstherapie verwenden, sollten angemessen geschult werden.
Die folgenden Insulinpumpen † wurden in apidra klinischen Studien von Sanofiaventis als Hersteller von Apidra verwendet:
- Diseteronic® H-Tron® Plus V100 und D-Tron® mit Disetronic Catheters (Rapid ™ Rapid C ™ Rapid D ™ und Tender ™)
- Minimed® Modelle 506 507 507c und 508 mit Minimed Catheters (Sof-Set Ultimate QR ™ und Quick-Set ™).
Bevor Sie eine andere Insulinpumpe mit Apidra verwenden, lesen Sie die Pumpenbezeichnung, um sicherzustellen, dass die Pumpe mit Apidra bewertet wurde.
Um Insulinabbau -Infusionsinfusions -Verschluss und Verlust des Konservierungsmittels (Metacresol) zu minimieren, müssen die Infusionssätze (Reservoir -Schlauch und Katheter) und die Apidra im Reservoir mindestens alle 48 Stunden ersetzt werden und eine neue Infusionsstelle sollte ausgewählt werden. Die Temperatur des Insulins kann die Umgebungstemperatur überschreiten, wenn das Pumpengehäuse Rohr oder Sportkoffer Sonnenlicht oder Strahlungswärme ausgesetzt ist. Insulin, die Temperaturen über 98,6 ° F (37 ° C) ausgesetzt sind, sollten verworfen werden. Infusionsstellen, die erythematöser oder verdickter oder verdickter Arzt sind, sollten dem medizinischen Fachmann und einer neuen Stelle ausgewählt werden, da eine fortgesetzte Infusion die Hautreaktion erhöhen oder die Absorption von Apidra verändern kann.
Pump- oder Infusionssatzstörungen oder Handhabungsfehler oder Insulinabbau können zu einer schnellen Hyperglykämie, Ketose und diabetischer Ketoazidose führen. Dies ist besonders für schnell wirkende Insulinanaloga relevant, die schneller durch die Haut absorbiert werden und eine kürzere Wirkdauer aufweisen. Eine sofortige Identifizierung und Korrektur der Ursache für Hyperglykämie oder Ketose oder diabetische Ketoazidose ist erforderlich. Zu den Problemen zählen Pumpenfehlfusionsinfusions -Set Okklusions -Leckage -Trennung oder fehlerhafte Handhabungsfehler und degradiertes Insulin. Eine geringere Hypoglykämie aus der Pumpenfehlfunktion kann auftreten. Wenn diese Probleme nicht unverzüglich korrigierte Patienten mit subkutaner Insulininjektion wieder aufnehmen und sich an ihren medizinischen Fachmann wenden. Patienten, die APIDRA durch kontinuierliche subkutane Infusion verabreichen, müssen bei einem Ausfall des Pumpensystems ein alternatives Insulinabgabesystem aufweisen. [Sehen Dosierung und Verwaltung Warnungen und VORSICHTSMASSNAHMEN Und Wie geliefert / Lagerung und Handhabung ].
Nichtklinische Toxikologie
Karzinogenese -Mutagenese -Beeinträchtigung der Fruchtbarkeit
Standard 2-Jahres-Karzinogenitätsstudien an Tieren wurden nicht durchgeführt. In Sprague-Dawley-Ratten wurde eine 12-monatige Wiederholungsdosis-Toxizitätsstudie mit Insulinglulisin in subkutanen Dosen von 2,5 5 20 oder 50 Einheiten/kg zweimal täglich durchgeführt (Dosis, was zu einer Exposition 1 2 8 und 20-mal die durchschnittliche menschliche Dosis basierend auf dem Vergleich des Körperflächenbereichs führt).
Bei weiblichen Ratten, die eine Insulinglulisine verabreichten, gab es im Vergleich zu unbehandelten Kontrollen eine nicht dosis abhängige Inzidenz von Mammatentumoren. Die Inzidenz von Brusttumoren für Insulinglulisin und normales menschliches Insulin war ähnlich. Die Relevanz dieser Ergebnisse für den Menschen ist nicht bekannt. Insulinglulisine war in den folgenden Tests nicht mutagenisch: Ames -Test in vitro Säugetierchromosomen -Aberrationstest in chinesischen V79 -Hamsterzellen und In -vivo -Säugetier -Erythrozyten -Mikronukleus -Test bei Ratten.
Kann CTN 10 dich hoch bringen
In Fruchtbarkeitsstudien an männlichen und weiblichen Ratten bei subkutanen Dosen bis zu 10 Einheiten/kg (Dosis führt zu einer Exposition 2 -fache der durchschnittlichen menschlichen Dosis basierend auf dem Vergleich der Körperoberfläche) wurden keine klaren nachteiligen Auswirkungen auf männliche und weibliche Fruchtbarkeit oder allgemeine Fortpflanzungsleistung von Tieren beobachtet.
Verwendung in bestimmten Populationen
Schwangerschaft
Schwangerschaft Category C
Reproduktions- und Teratologiestudien wurden mit Insulinglulisien bei Ratten und Kaninchen unter Verwendung normaler menschlicher Insulin als Komparator durchgeführt. Weibliche Ratten wurden während der Schwangerschaft in subkutanen Dosen bis zu 10 Einheiten/kg einmal täglich eine Insulinglulisine verabreicht (Dosis, was zu einer Exposition 2-mal die durchschnittliche menschliche Dosis basierend auf dem Vergleich der Körperoberfläche führte) und hatte keine bemerkenswerten toxischen Auswirkungen auf die Embryo-Fetal-Entwicklung.
Insulinglulisine wurde an weibliche Kaninchen während der gesamten Schwangerschaft in subkutanen Dosen von bis zu 1,5 Einheiten/kg/Tag verlegt (Dosis, was zu einer Exposition des 0,5 -fachen der durchschnittlichen menschlichen Dosis basiert, die auf dem Vergleich der Körperoberfläche basiert). Nebenwirkungen auf die Embryo-Fetalentwicklung wurden nur bei mütterlichen toxischen Dosisspiegeln beobachtet, die eine Hypoglykämie induzieren. Eine erhöhte Inzidenz von Nachimplantationsverlusten und Skelettdefekten wurde bei einem Dosis von 1,5 Einheiten/kg einmal täglich beobachtet (eine Dosis, die zu einer Exposition des 0,5-fachen der durchschnittlichen menschlichen Dosis basierend auf dem Vergleich der Körperoberfläche führte), die auch die Mortalität bei Dämmen verursachte. Eine geringfügige erhöhte Inzidenz von Verlusten nach der Implantation wurde bei der nächsten niedrigeren Dosis von 0,5 Einheiten/kg einmal täglich beobachtet (Dosis, was zu einer Exposition von 0,2-fache der durchschnittlichen menschlichen Dosis basiert, die auf dem Vergleich der Körperoberfläche basiert), was auch mit einer schweren Hypoglykämie in Verbindung gebracht wurde, bei dieser Dosis jedoch keine Defekte in Verbindung gebracht wurden. Bei Kaninchen bei einer Dosis von 0,25 Einheiten/kg wurden einmal täglich keine Effekte beobachtet (Dosis, was zu einer Exposition des 0,1 -fachen der durchschnittlichen menschlichen Dosis basiert, die auf dem Vergleich der Körperoberfläche basiert). Die Auswirkungen der Insulinglulisin unterschieden sich nicht von denen, die mit subkutanem normalem humanem Insulin in denselben Dosen beobachtet wurden, und wurden auf sekundäre Wirkungen einer mütterlichen Hypoglykämie zurückgeführt.
Es gibt keine gut kontrollierten klinischen Studien zur Verwendung von Apidra bei schwangeren Frauen. Da Studien zur Reproduktion von Tieren nicht immer der menschlichen Reaktion vorhersagen, sollte dieses Medikament nur dann während der Schwangerschaft angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt. Für Patienten mit Diabetes oder einer Vorgeschichte von Schwangerschaftsdiabetes ist es wichtig, vor der Empfängnis und während der gesamten Schwangerschaft eine gute Stoffwechselkontrolle aufrechtzuerhalten. Die Insulinanforderungen können während des ersten Trimesters im zweiten und dritten Trimester im Allgemeinen abnehmen und nach der Entbindung schnell abnehmen. Bei diesen Patienten ist eine sorgfältige Überwachung der Glukosekontrolle von wesentlicher Bedeutung.
Pflegemütter
Es ist nicht bekannt, ob die Insulinglulisine in die Muttermilch ausgeschieden wird. Weil viele Medikamente in der Muttermilch aus ausgeschieden sind, sollte bei der Verabreichung von Apidra an eine stillende Frau Vorsicht geboten werden. Die Verwendung von Apidra ist mit dem Stillen kompatibel, aber Frauen mit Diabetes, die stillend sind, müssen möglicherweise Anpassungen ihrer Insulin -Dosen erfordern.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit subkutaner Injektionen von Apidra wurde bei pädiatrischen Patienten (4 bis 17 Jahre) mit Typ -1 -Diabetes festgelegt [siehe Klinische Studien ]. Apidra has not been studied in pediatric patients with type 1 diabetes younger than 4 years of age Und in pediatric patients with type 2 diabetes .
Wie bei Erwachsenen muss die Dosierung der Apidra bei pädiatrischen Patienten auf der Grundlage des Stoffwechselbedarfs und der häufigen Überwachung des Blutzuckers individualisiert werden.
Geriatrische Verwendung
In klinischen Studien (n = 2408) wurde APIDRA 147 Patienten ≥ 65 Jahre und 27 Patienten ≥ 75 Jahre verabreicht. Der Großteil dieser kleinen Untergruppe älterer Patienten hatte Typ -2 -Diabetes. Die Änderung der HbA1c -Werte und Hypoglykämiefrequenzen unterschied sich nicht nach Alter. Trotzdem ist Vorsicht vorzugehen, wenn apidra an geriatrische Patienten verabreicht wird.
Überdosierungsinformationen für Apidra
Überschüssiges Insulin kann eine Hypoglykämie verursachen und insbesondere bei intravenös Hypokaliämie. Leichte Hypoglykämie -Episoden können normalerweise mit oraler Glukose behandelt werden.
Es können Anpassungen der Drogendosis -Mahlzeiten oder der Bewegung erforderlich sein. Schwerere Episoden der Hypoglykämie mit Koma -Anfalls oder neurologischen Beeinträchtigungen können mit intramuskulärem/subkutanem Glucagon oder konzentrierter intravenöser Glucose behandelt werden. Eine anhaltende Kohlenhydrataufnahme und -beobachtung kann erforderlich sein, da eine Hypoglykämie nach offensichtlicher klinischer Genesung wiederkommen kann. Hypokaliämie muss angemessen korrigiert werden.
Kontraindikationen für Apidra
Apidra is contraindicated:
- Während Episoden der Hypoglykämie
- Bei Patienten, die überempfindlich gegenüber Apidra oder einem seiner Hilfsstoffe sind, wenn sie bei Patienten mit bekannter Überempfindlichkeit gegen Apidra oder ihren Hilfsstoffen verwendet werden, können Patienten lokalisierte oder verallgemeinerte Überempfindlichkeitsreaktionen entwickeln [siehe Nebenwirkungen ].
Klinische Pharmakologie for Apidra
Wirkungsmechanismus
Die Regulation des Glukosestoffwechsels ist die primäre Aktivität von Insulinen und Insulinanaloga, einschließlich Insulinglulisin. Insuline senken den Blutzucker Glukose durch Stimulierung der peripheren Glukoseaufnahme durch Skelettmuskel und Fett und durch Hemmung der Leberglukoseproduktion. Insuline hemmen die Lipolyse und Proteolyse und verbessern die Proteinsynthese.
Die Glukoseabsenkungstätigkeit von Apidra und regelmäßigem menschlichem Insulin sind ausrüstet, wenn sie auf der intravenösen Route verabreicht werden. Nach der subkutanen Verabreichung ist die Wirkung von Apidra im Vergleich zu normalem menschlichen Insulin schneller und kürzer. [Sehen Pharmakodynamik ].
Pharmakodynamik
Studien an gesunden Freiwilligen und Patienten mit Diabetes zeigten, dass Apidra einen raschen Einsetzen von Wirkung und eine kürzere Aktivitätsdauer als normales menschliches Insulin aufweist, wenn sie subkutan verabreicht werden.
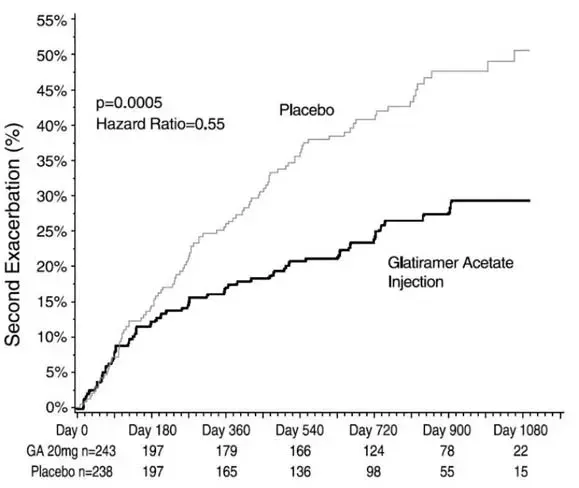
In einer Studie an Patienten mit Typ-1-Diabetes (n = 20) wurden die Glukose -senkenden Profile von Apidra und normalem menschlichen Insulin zu verschiedenen Zeiten in Bezug auf eine Standardmahlzeit bei einer Dosis von 0,15 Einheiten/kg bewertet. (Abbildung 1.)
Der maximale Blutzuckerxkursion (Δglumax; Basislinien -Subtrahieren der Glukosekonzentration) für Apidra, die 2 Minuten vor einer Mahlzeit injiziert wurde, betrug 65 mg/dl im Vergleich zu 64 mg/dl für normale menschliche Insulin, die 30 Minuten vor einer Mahlzeit (siehe 1A) und 84 mg/dl für regelmäßige menschliche Insulin 2 Minuten vor einem Essen (siehe Abbildung 1B) (siehe Abbildung 1B) (siehe Abbildung 1B) (siehe Abbildung 1B). Der maximale Blutzuckerausstoß für Apidra, die 15 Minuten nach Beginn einer Mahlzeit injiziert wurden, betrug 85 mg/dl im Vergleich zu 84 mg/dl für normale menschliche Insulin, die 2 Minuten vor einer Mahlzeit injiziert wurden (siehe Abbildung 1C).
Abbildung 1. Serieller Mittelwert des Blutzuckers bis zu 6 Stunden nach einer einzelnen Dosis von Apidra und normalem menschlichen Insulin. Die Apidra gab 2 Minuten (Apidra -Pre) vor Beginn einer Mahlzeit im Vergleich zu einem normalen menschlichen Insulin, der 30 Minuten (normal -30 Minuten) vor Beginn der Mahlzeit (Abbildung 1A) und im Vergleich zu einem normalen menschlichen Insulin (regulär -kpre) 2 Minuten vor einer Mahlzeit (Abbildung 1B) gegeben wurde. Apidra gab 15 Minuten (Apidra -Post) nach Beginn einer Mahlzeit im Vergleich zu normalen menschlichen Insulin (regulär -ke) 2 Minuten vor einer Mahlzeit (Abbildung 1c). Auf der X-Achse Null (0) ist der Beginn einer 15-minütigen Mahlzeit.
Abbildung 1a
 |
Abbildung 1b
 |
Abbildung c
 |
In einer randomisierten Open-Label-Zwei-Wege-Crossover-Studie erhielten 16 gesunde männliche Probanden eine intravenöse Infusion von Apidra oder regulärem menschlichem Insulin mit Kochsalzdünn mit einer Geschwindigkeit von 0,8 Milliunits/kg/min für zwei Stunden. Die Infusion derselben Dosis von Apidra oder einem regelmäßigen menschlichen Insulin erzeugte eine äquivalente Glukoseentsorgung im stationären Zustand.
Pharmakokinetik
Absorption und Bioverfügbarkeit
Pharmakokinetische Profile bei gesunden Freiwilligen und Patienten mit Diabetes (Typ 1 oder Typ 2) zeigten, dass die Absorption von Insulinglulisin schneller war als die des normalen menschlichen Insulins.
In einer Studie an Patienten mit Typ -1 -Diabetes (n = 20) nach subkutaner Verabreichung von 0,15 Einheiten/kg betrug die mittlere Zeit bis zur maximalen Konzentration (TMAX) 60 Minuten (Bereich 40 bis 120 Minuten) und die Spitzenkonzentration (CMAX) betrug 83 Mikrouns/ml (Bereich 40 bis 131 Mikrounits/ml). und ein Cmax von 50 Mikrounits/ml (Bereich 35 bis 71 Mikrouniten/ml) für normales menschliches Insulin. (Abbildung 2)
Abbildung 2. Pharmakokinetische Profile von Insulinglulisin und normalem humanem Insulin bei Patienten mit Typ -1 -Diabetes nach einer Dosis von 0,15 Einheiten/kg.
Abbildung 2
 |
Insulinglulisin und normales menschliches Insulin wurden in einer Euglykämie -Klemmstudie bei Patienten mit Typ -2 -Diabetes (n = 24) und einem Body -Mass -Index (BMI) zwischen 20 und 36 kg/m² subkutan verabreicht. Die mediane Zeit bis zur maximalen Konzentration (TMAX) betrug 100 Minuten (Bereich 40 bis 120 Minuten) und die mediane Spitzenkonzentration (CMAX) betrug 84 Mikrouniten/ml (Bereich 53 bis 165 Mikrouniten/ml) für Insulinglulisinglas und ein Median -TMAX von 240 Minuten (Bereich 80 bis 360 Minuten) und ein Median -CMAX -MICAX/ml/ml/ml/ml/ml/ml/ml/ml (41 bis 41 bis 33 Minuten). für normales menschliches Insulin. (Abbildung 3.)
Abbildung 3 . Pharmakokinetische Profile von Insulinglulisin und normalem humanem Insulin bei Patienten mit Typ -2 -Diabetes nach einer subkutanen Dosis von 0,2 Einheiten/kg.
Abbildung 3
 |
Wenn Apidra in verschiedene Bereiche des Körpers subkutan injiziert wurde, waren die Zeitkonzentrationsprofile ähnlich. Die absolute Bioverfügbarkeit von Insulinglulisin nach subkutaner Verabreichung beträgt ungefähr 70%, unabhängig von der Injektionsfläche (Abdomens 73% Deltoid 71% Oberschenkel 68%).
In einer klinischen Studie an gesunden Freiwilligen (n = 32) war die gesamte Insulinglulisin -Bioverfügbarkeit nach subkutaner Injektion von Insulinglulisin und NPH -Insulin (in der Spritze vorgemischt) und nach getrennten gleichzeitigen Subkutaninjektionen ähnlich. Die maximale Konzentration (CMAX) von Apidra nach der Vormischung gab es 27%. Die Zeit bis zur maximalen Konzentration (TMAX) war jedoch nicht betroffen. Über die Mischung von Apidra mit anderen Insulinpräparaten als NPH -Insulin sind keine Daten verfügbar. [Sehen Klinische Studien ].
Verteilung und Eliminierung
Die Verteilung und Eliminierung von Insulinglulisin und regulärem menschlichen Insulin nach intravenöser Verabreichung ähnelt mit Volumina der Verteilung von 13 bzw. 21 l bzw. Halbwertszeiten von 13 bzw. 17 Minuten. Nach der subkutanen Verabreichung wird die Insulinglulisine schneller eliminiert als normales menschliches Insulin mit einer scheinbaren Halbwertszeit von 42 Minuten im Vergleich zu 86 Minuten.
Klinische Pharmakologie In Specific Populations
Pädiatrische Patienten
Die pharmakokinetischen und pharmakodynamischen Eigenschaften von Apidra und regulärem menschlichem Insulin wurden in einer Studie bewertet, die bei Kindern von 7 bis 11 Jahren (n = 10) und Jugendlichen 12 bis 16 Jahre (n = 10) mit Typ -1 -Diabetes durchgeführt wurde. Die relativen Unterschiede in der Pharmakokinetik und Pharmakodynamik zwischen Apidra und normalem menschlichem Insulin bei diesen Patienten mit Typ -1 -Diabetes waren denen bei gesunden erwachsenen Probanden und Erwachsenen mit Typ -1 -Diabetes ähnlich.
Wettrennen
Eine Studie an 24 gesunden Kaukasiern und japanischen Probanden verglichen die Pharmakokinetik und die Pharmakodynamik nach subkutaner Injektion von Insulinglulisinsulin -Lispro und normalem menschlichen Insulin. Bei der subkutanen Injektion von Insulinglulisin-Probanden hatte japanische Probanden eine größere anfängliche Exposition (33%) für das Verhältnis von AUC (0-1h) zu AUC (0-Clamp-Ende) als Kaukasier (21%), obwohl die Gesamtbelichtungen ähnlich waren. Es gab ähnliche Befunde mit Insulin Lispro und normalem menschlichen Insulin.
Fettleibigkeit
Insulinglulisin und normales menschliches Insulin wurden in einer euglykämischen Klemmstudie bei adipösen nicht-diabetischen Probanden (n = 18) mit einem Körpermassenindex (BMI) zwischen 30 und 40 kg/m² subkutan verabreicht. The median time to maximum concentration (Tmax) was 85 minutes (range 49 to 150 minutes) and the median peak concentration (Cmax) was 192 microUnits/mL (range 98 to 380 microUnits/mL) for insulin glulisine compared to a median Tmax of 150 minutes (range 90 to 240 minutes) and a median Cmax of 86 microUnits/mL (range 43 to 175 micounnits/ml) für normales menschliches Insulin.
Der schnellere Einsetzen der Wirkung und die kürzere Aktivitätsdauer von Apidra und Insulin Lipro im Vergleich zu regulären menschlichen Insulin wurden in einer fettleibigen nicht-diabetischen Bevölkerung beibehalten (n = 18). (Abbildung 4.)
Abbildung 4 . Glukoseinfusionsraten (GIR) in einer euglykämischen Klemmstudie nach subkutaner Injektion von 0,3 Einheiten/kg Apidra Insulin Lispro oder regulärem humanes Insulin in einer übergewichtigen Bevölkerung.
Abbildung 4
 |
Nierenbehinderung
Studien mit menschlichem Insulin haben bei Patienten mit Nierenversagen erhöhte Zirkulationsspiegel von Insulin gezeigt. In einer Studie, die an 24 nicht-diabetischen Probanden mit normaler Nierenfunktion (CLCR> 80 ml/min) durchgeführt wurde, mäßige Nierenbeeinträchtigung (30-50 ml/min) und eine schwere Nierenbeeinträchtigung (starken Nierenbeeinträchtigungen ( <30 mL/min) the subjects with moderate Und severe renal impairment had increased exposure to insulin glulisine by 29% to 40% Und reduced clearance of insulin glulisine by 20% to 25% compared to subjects with normal renal function. [See Warnungen und VORSICHTSMASSNAHMEN ].
Hepatische Beeinträchtigung
Die Wirkung einer Leberbeeinträchtigung auf die Pharmakokinetik und Pharmakodynamik von Apidra wurde nicht untersucht. Einige Studien mit menschlichem Insulin haben bei Patienten mit Leberversagen erhöhte Zirkulationsspiegel von Insulin gezeigt. [Sehen Warnungen und VORSICHTSMASSNAHMEN ].
Geschlecht
Die Auswirkung des Geschlechts auf die Pharmakokinetik und Pharmakodynamik von Apidra wurde nicht untersucht.
Schwangerschaft
Die Wirkung der Schwangerschaft auf die Pharmakokinetik und Pharmakodynamik von Apidra wurde nicht untersucht.
Rauchen
Die Wirkung des Rauchens auf die Pharmakokinetik und Pharmakodynamik von Apidra wurde nicht untersucht.
Klinische Studien
Die Sicherheit und Wirksamkeit von Apidra wurde bei erwachsenen Patienten mit Typ 1 und Typ -2 -Diabetes (n = 1833) und bei Kindern und Jugendpatienten (4 bis 17 Jahre) mit Typ -1 -Diabetes (n = 572) untersucht. Der primäre Wirksamkeitsparameter in diesen Studien war die glykämische Kontrolle, die mit glykiertem Hämoglobin bewertet wurde (GHB, das als HbA1c -Äquivalent berichtet wurde).
Typ-1-Diabetes-Erwachsene
Bei Patienten mit Typ-1-Diabetes wurde eine aktive kontrollierte Nicht-Inferialitätsstudie mit 26 Wochen randomisierter offener Label durchgeführt, um die Sicherheit und Wirksamkeit von Apidra (n = 339) im Vergleich zu Insulin Lispro (n = 333) bei der Verabreichung innerhalb von 15 Minuten vor einem Essen zu bewerten. Insulinglargine wurde am Abend einmal täglich als Basalinsulin verabreicht. Vor der Randomisierung gab es eine 4-wöchige Laufzeit mit Insulin-Lispro und Insulinglargine. Die meisten Patienten waren kaukasisch (97%). Fünfundfünfzig Prozent der Patienten waren Männer. Das Durchschnittsalter betrug 39 Jahre (Bereich 18 bis 74 Jahre). Glykämische Kontrolle Die Anzahl der täglichen kurz wirkenden Insulininjektionen und die gesamten täglichen Dosen von Apidra und Insulin Lispro waren in den beiden Behandlungsgruppen ähnlich (Tabelle 6).
Tabelle 6: Typ -1 -Diabetes mellitus -adult
| Behandlungsdauer Behandlung in Kombination mit: | 26 Wochen Insulinglargine | |
| Apidra | Insulin Lispro | |
| Glykiertes Hämoglobin (GHB)* (%) | ||
| Anzahl der Patienten | 331 | 322 |
| Baseline mean | 7.6 | 7.6 |
| Adjusted mean change from baseline | -0.1 | -0.1 |
| Treatment difference: Apidra - Insulin Lispro | 0.0 | |
| 95% CI for treatment difference | (-0,1; 0,1) | |
| Basalinsulindosis (Einheiten/Tag) | ||
| Baseline mean | 24 | 24 |
| Adjusted mean change from baseline | 0 | 2 |
| Kurz wirkende Insulindosis (Einheiten/Tag) | ||
| Baseline mean | 30 | 31 |
| Adjusted mean change from baseline | -1 | -1 |
| Mittlere Anzahl kurz wirkender Insulininjektionen pro Tag | 3 | 3 |
| Körpergewicht (kg) | ||
| Baseline mean | 73.9 | 74.1 |
| Mean change from baseline | 0.6 | 0.3 |
| *GHB als Hba1c -Äquivalent gemeldet |
Typ-2-Diabetes-Erwachsene
Eine 26-wöchige randomisierte Open-Label-Aktivitätsstudie mit aktiver kontrollierter Nicht-Inferialität wurde bei Insulin-behandelten Patienten mit Typ-2-Diabetes durchgeführt, um die Sicherheit und Wirksamkeit von Apidra (n = 435) innerhalb von 15 Minuten vor einer Mahlzeit zu bewerten, im Vergleich zu einem normalen menschlichen Insulin (n = 441), das 30 bis 45 Minuten vor einem Mehl verabreicht wurde. NPH Human Insulin wurde zweimal täglich als basales Insulin verabreicht. Alle Patienten nahmen an einer 4-wöchigen Einlaufzeit mit regelmäßigem menschlichem Insulin und NPH-menschlichen Insulin teil. Achtzig Prozent der Patienten waren kaukasisch und 11% schwarz. Das Durchschnittsalter betrug 58 Jahre (Bereich 26 bis 84 Jahre). Der durchschnittliche Body Mass Index (BMI) betrug 34,6 kg/m². Bei der Randomisierung nahmen 58% der Patienten ein orales Antidiabetikum. Diese Patienten wurden angewiesen, ihre orale Antidiabetika in der gleichen Dosis während der gesamten Studie fortzusetzen. Die Mehrheit der Patienten (79%) mischte ihr kurzwirkendes Insulin unmittelbar vor der Injektion mit NPH-humanen Insulin. Die Reduzierungen von Baseline in GHB waren zwischen den 2 Behandlungsgruppen ähnlich (siehe Tabelle 7). In der Anzahl der täglichen kurz wirkenden Insulininjektionen oder basalen oder kurz wirkenden Insulindosen wurden keine Unterschiede zwischen Apidra und regulären menschlichen Insulingruppen beobachtet. (Siehe Tabelle 7.)
Tabelle 7: Typ -2 -Diabetes mellitus -adult
| Behandlungsdauer Behandlung in Kombination mit: | 26 Wochen NPH Human Insulin | |
| Apidra | Regelmäßiges menschliches Insulin | |
| Glykiertes Hämoglobin (GHB)* (%) | ||
| Anzahl der Patienten | 404 | 403 |
| Baseline mean | 7.6 | 7.5 |
| Adjusted mean change from baseline | -0.5 | -0.3 |
| Treatment difference: Apidra - Regelmäßiges menschliches Insulin 95% CI for treatment difference | -0,2 (-0,3; -0,1) | |
| Basalinsulindosis (Einheiten/Tag) | ||
| Baseline mean | 59 | 57 |
| Adjusted mean change from baseline | 6 | 6 |
| Kurz wirkende Insulindosis (Einheiten/Tag) | ||
| Baseline mean | 32 | 31 |
| Adjusted mean change from baseline | 4 | 5 |
| Mittlere Anzahl kurz wirkender Insulininjektionen pro Tag | 2 | 2 |
| Körpergewicht (kg) | ||
| Baseline mean | 100.5 | 99.2 |
| Mean change from baseline | 1.8 | 2.0 |
| *GHB als Hba1c -Äquivalent gemeldet |
Typ-1-Diabetes-Erwachsene: Pre-And Post-Meal Administration
Bei Patienten mit Typ-1-Diabetes wurde eine 12-wöchige randomisierte, aktiv gesteuerte Open-Label-Studie zur Nichtversicherungsstudie durchgeführt, um die Sicherheit und Wirksamkeit von Apidra zu bewerten, die zu unterschiedlichen Zeiten in Bezug auf eine Mahlzeit verabreicht wurden. Apidra wurde entweder innerhalb von 15 Minuten vor einer Mahlzeit (n = 286) oder unmittelbar nach einer Mahlzeit (n = 296) subkutan verabreicht, und es wurde regelmäßiges menschliches Insulin (n = 278) 30 bis 45 Minuten vor einer Mahlzeit subkutan subkutan verabreicht. Insulinglargine wurde einmal täglich vor dem Schlafengehen als Basalinsulin verabreicht. Es gab eine 4-wöchige Laufzeit mit regelmäßiger menschlicher Insulin- und Insulinglargine, gefolgt von Randomisierung. Die meisten Patienten waren kaukasisch (94%). Das Durchschnittsalter betrug 40 Jahre (Bereich 18 bis 73 Jahre). Die glykämische Kontrolle (siehe Tabelle 8) war für die 3 Behandlungsschemata vergleichbar. Bei der gesamten täglichen Anzahl von kurz wirkenden Insulininjektionen wurden keine Änderungen gegenüber dem Ausgangswert zwischen den Behandlungen beobachtet. (Siehe Tabelle 8.)
Tabelle 8: Verabreichung vor und nach der Mähe in Typ-1-Diabetes mellitus-adult
| Behandlungsdauer Behandlung in Kombination mit: | 12 Wochen Insulin Glargine Apidra vor dem Essen | 12 Wochen Sinsulin Glargine Apidra Post -Mahlzeit | 12 Wochenminsulin Glargine normales menschliches Insulin |
| Glykiertes Hämoglobin (GHB)* (%) | |||
| Anzahl der Patienten | 268 | 276 | 257 |
| Baseline mean | 7.7 | 7.7 | 7.6 |
| Adjusted mean change from baseline** | -0.3 | -0.1 | -0.1 |
| Basalinsulindosis (Einheiten/Tag) | |||
| Baseline mean | 29 | 29 | 28 |
| Adjusted mean change from baseline | 1 | 0 | 1 |
| Kurz wirkende Insulindosis (Einheiten/Tag) | |||
| Baseline mean | 29 | 29 | 27 |
| Adjusted mean change from baseline | -1 | -1 | 2 |
| Mittlere Anzahl kurz wirkender Insulininjektionen pro Tag | 3 | 3 | 3 |
| Körpergewicht (kg) | |||
| Baseline mean | 79.2 | 80.3 | 78.9 |
| Mean change from baseline | 0.3 | -0.3 | 0.3 |
| *GHB als Hba1c -Äquivalent gemeldet ** Angepasste mittlere Änderung gegenüber dem Basisbehandlungsunterschied (98,33% CI für die Behandlungsdifferenz): Apidra pre meal vs. Regelmäßiges menschliches Insulin -0.1 (-0.3; 0.0) Apidra post meal vs. Regelmäßiges menschliches Insulin 0.0 (-0.1; 0.2) Apidra post meal vs. pre meal 0.2 (0.0; 0.3) |
Typ-1-Diabetes-Pediatrische Patienten
Eine 26-wöchige randomisierte, aktive kontrollierte Nicht-Infertigkeit-Studie mit offenem Label wurde bei Kindern und Jugendlichen älter als 4 Jahre mit Typ-1-Diabetes mellitus durchgeführt, um die Sicherheit und Wirksamkeit von Apidra (n = 277) zu bewerten, wenn sie innerhalb von 15 Minuten vor einem Essen subkutiert wurden. Die Patienten erhielten auch Insulinglargine (einmal täglich abends verabreicht) oder NPH Insulin (einmal am Morgen und einmal abends verabreicht). Vor der Randomisierung gab es eine 4-wöchige Laufzeit mit Insulin-Lispro- und Insulinglargine oder NPH. Die meisten Patienten waren kaukasisch (91%). Fünfzig Prozent der Patienten waren männlich. Das Durchschnittsalter betrug 12,5 Jahre (Bereich 4 bis 17 Jahre). Der mittlere BMI betrug 20,6 kg/m². Die glykämische Kontrolle (siehe Tabelle 9) war für die beiden Behandlungsschemata vergleichbar.
Tabelle 9: Ergebnisse einer 26-wöchigen Studie bei pädiatrischen Patienten mit Typ-1-Diabetes mellitus
| Apidra | Lipro | |
| Anzahl der Patienten | 271 | 291 |
| Basalinsulin | NPH- oder Insulinglargin | NPH- oder Insulinglargin |
| Glykiertes Hämoglobin (GHB)* (%) | ||
| Baseline mean | 8.2 | 8.2 |
| Adjusted mean change from baseline | 0.1 | 0.2 |
| Treatment Difference: Mean (95% confidence interval) | -0,1 (-0,2 0,1) | |
| Basalinsulindosis (Einheiten/kg/Tag) | ||
| Baseline mean | 0.5 | 0.5 |
| Mean change from baseline | 0.0 | 0.0 |
| Kurz wirkende Insulindosis (Einheiten/kg/Tag) | ||
| Baseline mean | 0.5 | 0.5 |
| Mean change from baseline | 0.0 | 0.0 |
| Mittlere Anzahl kurz wirkender Insulininjektionen pro Tag | 3 | 3 |
| Grundlinienwertmittelgewicht (kg) | 51.5 | 50.8 |
| Durchschnittliche Gewichtsänderung gegenüber dem Ausgangswert (KG) | 2.2 | 2.2 |
| *GHB als Hba1c -Äquivalent gemeldet |
Typ-1-Diabetes-Erwachsene: Continuous Subcutaneous Insulin Infusion
Eine 12-wöchige randomisierte aktive Kontrollstudie (Apidra gegen Insulin-Aspart), die bei Erwachsenen mit Typ-1-Diabetes (Apidra n = 29 Insulin Aspart n = 30) durchgeführt wurde, bewertete die Verwendung von Apidra in einer externen kontinuierlichen Subkutanpumpe. Alle Patienten waren kaukasisch. Das Durchschnittsalter betrug 46 Jahre (Bereich 21 bis 73 Jahre). Der mittlere GHB stieg in beiden Behandlungsgruppen von Ausgangswert zu Endpunkt (von 6,8% auf 7,0% für Apidra; von 7,1% auf 7,2% für Insulin -Aspart).
Patienteninformationen für Apidra
Apidra
(Äh pinkeln)
(Insulinglulisine [rekombinantes DNA -Ursprung] Injektion) Lösung für die Injektion
Lesen Sie die Patienteninformationen, die mit Apidra geliefert werden, bevor Sie anfangen, und jedes Mal, wenn Sie eine Nachfüllung erhalten. Es kann neue Informationen geben. Diese Broschüre tritt nicht mit Ihrem Gesundheitsdienstleister über Ihren Diabetes oder Ihre Behandlung an. Wenn Sie Fragen zu Apidra oder über Diabetes haben, sprechen Sie mit Ihrem Gesundheitsdienstleister.
Was ist Apidra?
Apidra is a man-made insulin used to control high blood sugar in adults Und children with diabetes mellitus .
Es ist nicht bekannt, ob Apidra sicher oder wirksam ist in:
- Kinder unter 4 Jahren mit Typ -1 -Diabetes
- Kinder mit Typ -2 -Diabetes
Wer sollte Apidra nicht nehmen?
Nehmen Sie nicht Apidra:
- Wenn Ihr Blutzucker zu niedrig ist (Hypoglykämie). Siehe den Abschnitt Was sind die möglichen Nebenwirkungen von Apidra?
- Wenn Sie allergisch sind zu den Zutaten in Apidra. Eine vollständige Liste von Zutaten finden Sie im Ende dieser Broschüre. Fragen Sie Ihren Gesundheitsdienstleister, ob Sie nicht sicher sind.
Was soll ich meinem Gesundheitsdienstleister sagen, bevor ich Apidra einnehme?
Erkrankungen können sich auf Ihre Insulinbedürfnisse auswirken. Teilen Sie Ihrem Gesundheitsdienstleister über alle Ihre medizinischen Erkrankungen mit, auch wenn Sie:
- Leber oder Nierenprobleme haben.
- sind schwanger, um schwanger zu werden oder stillen. Es ist nicht bekannt, ob Apidra Ihrem ungeborenen Baby oder Pflegekind schädigen wird. Sie und Ihr Gesundheitsdienstleister sollten über den besten Weg sprechen, um Ihren Diabetes zu verwalten, während Sie schwanger sind oder stillen. Es ist besonders wichtig, die Kontrolle über Ihren Blutzucker während der Schwangerschaft zu behalten.
- Herzinsuffizienz oder andere Herzprobleme haben. Wenn Sie Herzversagen haben, kann es schlechter werden, während Sie TZDs mit Apidra nehmen
Teilen Sie Ihrem Gesundheitsdienstleister über alle Medikamente, die Sie einnehmen einschließlich verschreibungspflichtiger und nicht verschreibungspflichtiger Medikamente Vitamine und pflanzliche Nahrungsergänzungsmittel, insbesondere diejenigen, die üblicherweise TZDs (Thiazolidiones) bezeichnet werden.
Kennen Sie die Medikamente, die Sie einnehmen. Behalten Sie eine Liste Ihrer Medikamente bei sich und zeigen Sie sie Ihrem Gesundheitsdienstleister und Apotheker, wenn Sie ein neues Medikament erhalten.
Wie soll ich Apidra nehmen?
- Nehmen Sie Apidra genau wie vorgeschrieben.
- Nehmen Sie keine Änderungen an Ihrer Dosis oder Ihrer Insulin -Art vor, es sei denn, Sie sollen dies von Ihrem Gesundheitsdienstleister tun.
- Kenne dein Insulin. Stellen Sie sicher, dass Sie es wissen:
- Die Art und Stärke von Insulin, die Ihnen verschrieben wurden
- Die Menge an Insulin, die Sie nehmen
- Die beste Zeit für Sie, um Ihr Insulin zu nehmen. Dies kann sich ändern, wenn Sie eine andere Art von Insulin einnehmen oder wenn Sie Ihrem Insulin ändert, beispielsweise unter Verwendung einer Insulinpumpe, anstatt Injektionen unter der Haut zu geben (subkutane Injektionen).
- Apidra starts working faster than regular insulin but does not work as long.
- Apidra is usually used with a longer-acting insulin when given by injection under the skin (subcutaneous) or by itself when using an insulin pump.
- Lesen Sie die Anweisungen für die Verwendung, die mit Ihrer Apidra geliefert wird. Sprechen Sie mit Ihrem Gesundheitsdienstleister, wenn Sie Fragen haben. Ihr Gesundheitsdienstleister sollte Ihnen zeigen, wie Sie Apidra injizieren können, bevor Sie es einnehmen.
- Ihr Gesundheitsdienstleister wird die beste Art von Apidra für Sie verschreiben. Apidra ist erhältlich in:
- 3 ml Solostar® vorgefüllter Stift
- 10 ml Fläschchen
- Sie benötigen ein Rezept, um Apidra zu erhalten. Stellen Sie immer sicher, dass Sie das richtige Insulin aus der Apotheke erhalten.
- Überprüfen Sie Ihren Blutzuckerspiegel vor jeder Verwendung von Apidra. Fragen Sie Ihren Gesundheitsdienstleister, wie sich Ihr Blutzucker aussehen sollte und wann Sie Ihren Blutzuckerspiegel überprüfen sollten.
- Überprüfen Sie das Etikett, um sicherzustellen, dass Sie den richtigen Insulintyp haben. Dies ist besonders wichtig, wenn Sie auch langwirksames Insulin einnehmen.
- Apidra should look clear Und colorless. Do not use Apidra if it looks cloudy colored or has particles in it. Talk with your pharmacist or healthcare provider if you have any questions.
- Wenn Sie zu viel Apidra nehmen, kann Ihr Blutzucker niedrig fallen (Hypoglykämie). Sie können leichte niedrige Blutzucker (Hypoglykämie) behandeln, indem Sie sofort etwas Zuckervolles trinken oder essen.
- Teilen Sie keine Nadeln von Insulinstiften oder Spritzen mit anderen.
Ihre Dosis Apidra muss möglicherweise geändert werden, weil:
- Erkrankung
- Veränderung der Ernährung
- Stress
- Änderung der körperlichen Aktivität oder Bewegung
- Andere Medikamente, die Sie einnehmen
- reisen
Überprüfen Sie Ihren Blutzucker und bleiben Sie auf dem Diät- und Trainingsplan, wie von Ihrem Gesundheitsdienstleister verschrieben.
Was soll ich bei der Einnahme von Apidra in Betracht ziehen?
- Alkohol kann Ihren Blutzucker beeinflussen, wenn Sie Apidra nehmen
- Fahr- und Betriebsmaschinen. Möglicherweise haben Sie Probleme, aufmerksam zu achten oder zu reagieren, wenn Sie einen niedrigen Blutzucker (Hypoglykämie) haben. Seien Sie vorsichtig, wenn Sie ein Auto fahren oder Maschinen bedienen. Fragen Sie Ihren Gesundheitsdienstleister, ob es in Ordnung ist, wenn Sie fahren, wenn Sie haben:
- Niedriger Blutzucker (Hypoglykämie)
- verringerte oder keine Warnzeichen von niedrigem Blutzucker
Was sind die möglichen Nebenwirkungen von Apidra?
Apidra can cause serious side effects including:
- Niedriger Blutzucker (Hypoglykämie). Symptome von niedrigem Blutzucker können umfassen:
- ängstliche oder gereizte Stimmungsänderungen verändern
- Mühe zu konzentrieren oder verwirrt zu fühlen
- Kribbeln in den Lippen oder Zunge in den Händen
- Ich fühle mich schwindelig, benommen oder schläfrig
- Albträume oder Schlafschlafen
- Kopfschmerzen
- verschwommenes Sehen
- verschwommene Rede
- Ein schneller Herzschlag
- Schwitzen
- Shakakess
- unsicher gehen
Sehr niedriger Blutzucker (Hypoglykämie) kann Bewusstlosigkeit (ohnmächtig) Anfälle und Tod verursachen. Sprechen Sie mit Ihrem Gesundheitsdienstleister darüber, wie Sie feststellen können, ob Sie einen niedrigen Blutzucker haben und was zu tun ist, wenn dies bei der Einnahme von Apidra passiert. Kennen Sie Ihre Symptome von niedrigem Blutzucker. Befolgen Sie die Anweisungen Ihres Gesundheitsdienstleisters zur Behandlung Ihres niedrigen Blutzuckers.
Sprechen Sie mit Ihrem Gesundheitsdienstleister, wenn niedriger Blutzucker ein Problem für Sie ist. Ihre Dosis Apidra muss möglicherweise geändert werden.
- Schwerwiegende allergische Reaktionen.
Holen Sie sich sofort medizinische Hilfe, wenn Sie eines dieser Symptome einer schweren allergischen Reaktion haben:
- Ein Ausschlag in Ihrem ganzen Körper
- Kurzatmigkeit
- Probleme beim Atmen (Keuchen)
- Schneller Puls
- Schwitzen
- Fühlen Sie sich schwach (aufgrund des niedrigen Blutdrucks)
- Niedriges Kalium in deinem Blut. Ihr Arzt wird Sie darauf überprüfen.
Häufige Nebenwirkungen sind:
- Reaktionen an der Injektionsstelle (lokale allergische Reaktion). Sie können Rötungen anschwellen und am Injektionsort jucken. Wenn Sie weiterhin Hautreaktionen haben oder dass sie ernsthaft mit Ihrem Gesundheitsdienstleister sprechen.
- Hautverdickung oder Gruben an der Injektionsstelle. Injizieren Sie kein Insulin in die Haut, wo dies geschehen ist. Wählen Sie einen Injektionsbereich (Oberarm Oberschenkel oder Magenbereich). Wechseln Sie die Injektionsstellen in dem Bereich, den Sie mit jeder Dosis auswählen. Injizieren Sie für jede Injektion nicht genau den gleichen Punkt.
- Gewichtszunahme
Herzinsuffizienz . Die Einnahme bestimmter Diabetes -Pillen, die Thiazolidination oder TZDs mit Apidra genannt werden, kann bei manchen Menschen eine Herzversagen verursachen. Dies kann passieren, auch wenn Sie noch nie zuvor Herzversagen oder Herzprobleme hatten. Wenn Sie bereits Herzinsuffizienz haben, kann dies schlechter werden, während Sie TZDs mit Apidra einnehmen. Ihr Gesundheitsdienstleister sollte Sie genau überwachen, während Sie TZDs mit Apidra einnehmen. Sagen Sie Ihrem Gesundheitsdienstleister, wenn Sie neue oder schlechtere Symptome von Herzinsuffizienz haben, einschließlich:
- Kurzatmigkeit
- Schwellung Ihrer Knöchel oder Füße
- Plötzliche Gewichtszunahme
Während der Behandlung mit TZDs und Apidra muss die TZD -Dosis möglicherweise von Ihrem Gesundheitsdienstleister angepasst oder gestoppt werden, wenn Sie eine neue oder schlechtere Herzinsuffizienz haben.
Teilen Sie Ihrem Gesundheitsdienstleister über jeden Nebeneffekt mit, der Sie stört oder der nicht verschwindet. Dies sind nicht alle möglichen Nebenwirkungen von Apidra.
Rufen Sie Ihren Arzt an, um medizinische Beratung zu Nebenwirkungen zu erhalten. Sie können die FDA bei 1800-332-1088 Nebenwirkungen melden.
Wie soll ich Apidra aufbewahren?
- Die Verwendung der Patientenanweisungen für die Verwendung Ihrer Apidra finden Sie für bestimmte Speicheranweisungen.
Ungeöffnete Apidra:
- Verwenden Sie APIDRA nach dem auf das Etikett gestempelten Ablaufdatum nicht.
- Halten Sie alle ungeöffneten Apidra im Kühlschrank zwischen 2 ° C bis 8 ° C zwischen 36 ° F und 46 ° F.
- NICHT einfrieren. Verwenden Sie Apidra nicht, wenn es eingefroren wurde.
- Halten Sie Apidra von direkter Hitze und Licht fern.
- Ungeöffnete Fläschchen und Solostar, die nicht in einem Kühlschrank gehalten wurden, müssen innerhalb von 28 Tagen nach dem Öffnen verwendet werden.
Allgemeine Informationen über Apidra
Medikamente werden manchmal für Erkrankungen verschrieben, die bei Patienteninformationsblättern nicht erwähnt werden. Verwenden Sie Apidra nicht für eine Erkrankung, für die es nicht verschrieben wurde. Geben Sie anderen Menschen nicht Apidra, auch wenn sie die gleichen Symptome haben, die Sie haben. Es kann ihnen schaden.
Diese Broschüre fasst die wichtigsten Informationen über Apidra zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Gesundheitsdienstleister. Sie können Ihren Gesundheitsdienstleister um Informationen über Apidra bitten, die für Gesundheitsdienstleister geschrieben wurden. Weitere Informationen zu Apidra erhalten Sie unter 1-800-633-1610 oder unter www.apidra.com.
Was sind die Zutaten in Apidra?
Wirkstoff: Insulinglulisine
Inaktive Inhaltsstoffe: Metacresol -Tromethamin -Natriumchlorid -Polysorbat 20 Wasser zur Injektionshydrochlorsäure oder Natriumhydroxid
WEITERE INFORMATIONEN
Diabetes prognostiziert ist ein nationales Magazin, das speziell für Patienten mit Diabetes und ihren Familien entworfen wurde, und ist nach Abonnement der American Diabetes Association (ADA) P.O. Box 363 Morris IL 61054-0363 1-800-Diabetes (1-800-342-2383). Sie können auch die ADA -Website unter www.diabetes.org besuchen.
Eine weitere Veröffentlichung COUNTDOWN ist bei der Juvenile Diabetes Research Foundation International (JDRF) 120 Wall Street 19. Stock New York New York 10005 1800-JDF-Cure (1-800-533-2873) erhältlich. Sie können auch die JDRF -Website unter www.jdf.org besuchen. Weitere Informationen zu Diabetes finden Sie bei Ihrem Gesundheitsdienstleister oder Diabetes -Pädagogen oder besuchen Sie www.diabeteswatch.com.
Weitere Informationen zu Apidra erhalten Sie unter 1-800-633-1610 oder unter www.apidra.com.
Apidra® SoloStar®
(Insulinglulisin [rDNA -Ursprung] Injektion) 3 ml vorgefüllter Stift
Patientenanweisungen zur Verwendung
Stellen Sie sicher, dass Sie verstehen und befolgen Sie diese Anweisungen, bevor Sie Ihre Apidra Solostar® verwenden. Sprechen Sie mit Ihrem Gesundheitsdienstleister über den richtigen Weg, um Ihren Apidra Solostar zu verwenden, bevor Sie sie zum ersten Mal verwenden. Behalten Sie diese Broschüre bei, falls Sie sie später erneut betrachten müssen.
Apidra SoloStar should not be used by people who are blind or have severe vision problems without the help of a person who has good eyesight Und who is trained to use the Apidra SoloStar the right way.
Apidra SoloStar is a disposable prefilled pen used to inject Apidra. Each Apidra SoloStar has 300 units of insulin which can be used for many doses. You can select a dose from 1 to 80 units. The pen plunger moves with each dose. The plunger will only move to the end of the cartridge when 300 units of insulin have been given.
 |
Wenn Sie sich subkutane Injektionen von Apidra geben:
- Sie sollten Apidra innerhalb von 15 Minuten vor einer Mahlzeit oder innerhalb von 20 Minuten nach Beginn einer Mahlzeit einnehmen.
- Injizieren Sie Apidra nicht, wenn Sie nicht innerhalb von 15 Minuten essen möchten.
- Apidra in die Haut Ihres Oberschenkels oder Magenbereichs in den Oberarm oder in die Haut injizieren. Injizieren Sie Apidra weder in eine Ader noch in einen Muskel.
- Wählen Sie einen Injektionsbereich (Oberarm Oberschenkel oder Magenbereich). Wechseln Sie die Injektionsstellen in dem Bereich, den Sie mit jeder Dosis auswählen. Injizieren Sie für jede Injektion nicht genau den gleichen Punkt.
Wichtige Informationen zur Verwendung von Apidra Solostar:
- Verwenden Sie für jede Injektion eine neue Nadel. Apidra Solostar kann mit Stiftnadeln von Becton Dickinson und Firma Ypsomed und Owen Mumford verwendet werden. Wenden Sie sich an Ihren Gesundheitsdienstleister, um weitere Informationen zu erhalten.
- Führen Sie vor jeder Injektion einen Sicherheitstest durch. (Siehe Schritt 3.)
- Wählen Sie keine Dosis aus oder drücken Sie die Einspritztaste ohne angehängte Nadel.
- Teilen Sie Ihren Apidra Solostar nicht mit anderen, auch wenn sie an Diabetes verfügen.
- Wenn Ihre Injektion von einer anderen Person gegeben wird, muss diese Person vorsichtig sein, um eine versehentliche Nadelstabverletzung zu vermeiden und eine Übertragung einer Infektion zu verhindern.
- Verwenden Sie Apidra Solostar nicht, wenn es beschädigt ist oder wenn Sie nicht sicher sind, ob es richtig funktioniert.
- Tragen Sie immer eine zusätzliche Apidra -Solostar -vorgefüllte Stift, falls Ihre Apidra -Solostar verloren geht oder beschädigt ist.
Schritt 1. Vorbereitung auf eine Injektion
Stellen Sie sicher, dass Sie die folgenden Elemente haben:
- Apidra Solostar
- Stiftnadeln
- Alkoholabstrich
- Punktionenresistentbehälter. Sehen Sie, wie ich gebrauchte Nadeln und Apidra Solostar entsorgen kann.
- Überprüfen Sie das Etikett auf Ihrem Apidra Solostar, um sicherzustellen, dass Sie das richtige Insulin haben. Der Apidra Solostar ist blau. Es hat einen dunkelblauen Injektionsknopf mit einem erhöhten Ring oben.
- Überprüfen Sie das Ablaufdatum auf dem Karton oder das Etikett Ihrer Apidra Solostar, um sicherzustellen, dass das Datum nicht verabschiedet wurde. Verwenden Sie keine Apidra -Solostar, wenn das Datum vergangen ist.
- Nehmen Sie die Stiftkappe ab.
- Schauen Sie sich das Insulin in Ihrer Apidra -Solostar an. Überprüfen Sie, ob das Insulin klar aussieht. Verwenden Sie diesen Apidra -Solostar nicht, wenn das Insulin trüb gefärbt ist oder Partikel enthält.
Schritt 2. Anbringen der Nadel
Verwenden Sie für jede Injektion immer eine neue sterile Nadel, um Kontaminationen und potenzielle Nadelblöcke zu verhindern.
Lesen Sie die Stiftnadelanweisungen zur Verwendung, bevor Sie sie verwenden.
Bitte beachten Sie: Stiftnadeln können anders aussehen. Die gezeigten Stiftnadeln dienen nur zu veranschaulichen Zwecken.
- Wischen Sie die Gummisiegel mit Alkohol ab.
- Entfernen Sie die Schutzdichtung von der neuen Stiftnadel.
- Richten Sie die Nadel mit dem Stift aus und halten Sie sie gerade, während Sie sie befestigen (abhängig vom Nadeltyp drücken).
 |
- Wenn Sie die Nadel nicht gerade halten, während Sie sie befestigen, kann dies die Gummisiegel beschädigen und die Nadel durchlaufen oder die Nadel brechen.
 |
Schritt 3. Durchführen eines Sicherheitstests
Führen Sie vor jeder Injektion einen Sicherheitstest durch, um sicherzustellen, dass Sie die richtige Dosis Apidra erhalten. Der Sicherheitstest:
- Stellen Sie sicher, dass der Stift und der Nadel richtig funktionieren
- Entfernt Luftblasen
A. Wählen Sie eine Dosis von 2 Einheiten aus, indem Sie den Dosierungswahlwähler drehen.
 |
B. Die Außennadelkappe ausziehen und nach der Injektion die gebrauchte Nadel entfernen. Nehmen Sie die innere Nadelkappe ab und entsorgen Sie sie.
 |
C. Halten Sie den Stift mit der Nadel nach oben.
D. Tippen Sie auf das Insulinreservoir, damit sich Luftblasen in Richtung der Nadel erheben.
E. Drücken Sie die Injektionstaste ganz in. Überprüfen Sie, ob Insulin aus der Nadelspitze kommt.
 |
Möglicherweise müssen Sie den Sicherheitstest mehr als einmal durchführen, bevor Sie das Insulin sehen.
- Wenn kein Insulin herauskommt, überprüfen Sie die Luftblasen und wiederholen Sie den Sicherheitstest noch zweimal, um sie zu entfernen.
- Wenn immer noch kein Insulin herauskommt, kann die Nadel blockiert werden. Ändern Sie die Nadel und versuchen Sie es erneut.
- Wenn kein Insulin herauskommt, nachdem die Nadel geändert wurde, kann Ihre Apidra -Solostar beschädigt werden. Verwenden Sie diesen Apidra -Solostar nicht.
Schritt 4. Auswählen Ihrer Dosis
Wählen Sie die von Ihrem Gesundheitsdienstleister verschriebene Apidra -Dosis aus. Sie können die Insulindosis in Schritten von 1 Einheit von mindestens 1 Einheit bis maximal 80 Einheiten auswählen. Wenn Sie eine Dosis über 80 Einheiten benötigen, sollten Sie sie als zwei oder mehr Injektionen angeben.
A. Überprüfen Sie, ob das Dosisfenster 0 nach dem Sicherheitstest zeigt.
B. Wählen Sie Ihre benötigte Dosis aus (im Beispiel unten in der ausgewählten Dosis beträgt 30 Einheiten). Wenn Sie sich an Ihrer Dosis abbiegen, können Sie sich zurücklehnen.
 |
- Drücken Sie den Einspritztaste nicht, während das Insulin drehen wird.
- Sie können den Dosierungsauswahl nicht drehen, die die Anzahl der im Stift verbleibenden Einheiten übergeben hat. Zwingen Sie den Dosierungsauswahl nicht zum Drehen. In diesem Fall können Sie entweder die Insulinmenge injizieren, die sich noch im Stift befindet, und Ihre Dosis mit einer neuen Apidra -Solostar beenden, oder Sie können einen neuen Apidra -Solostar für Ihre volle Dosis verwenden.
Schritt 5. Geben Sie die Injektion
A. Geben Sie die Injektion genau wie Sie von Ihrem Gesundheitsdienstleister gezeigt.
B. Stecken Sie die Nadel in Ihre Haut.
 |
C. Injizieren Sie die Dosis, indem Sie die Injektionstaste im ganzen Weg drücken. Drücken Sie nur den Einspritztaste, wenn Sie bereit sind, injizieren. Die Nummer im Dosisfenster kehrt zu 0 zurück, wenn Sie injizieren.
 |
D. Halten Sie den Einspritztaste ganz hinein. Zählen Sie langsam auf 10, bevor Sie die Nadel aus Ihrer Haut nehmen. Dies wird sicherstellen, dass die volle Dosis gegeben wurde.
Schritt 6. Entfernen und Entsendung der Stiftnadel
Entfernen Sie immer die Stiftnadel nach jeder Injektion und lagern Sie Ihre Apidra -Solostar ohne eine Nadel. Dies hilft zu verhindern:
- Kontamination und Infektion
- Luft vom Insulinreservoir und Leckage von Insulin. Dies hilft, sicherzustellen, dass Sie die richtige Dosis Insulin injizieren.
A. Befolgen Sie die Anweisungen von Ihrem Gesundheitsdienstleister, wenn Sie die Nadel entfernen und entsorgen. Schöpfen Sie beispielsweise die Außennadelkappe wieder auf der Nadel und verwenden Sie sie, um die gebrauchte Nadel vom Stift abzuschrauben. Um das Risiko einer zufälligen Nadelstabverletzung und der Übergabeinfektion zu verringern:
- Nadeln nicht mit Ihren Fingern zusammenfassen
- Ersetzen Sie niemals die innere Nadelkappe.
Wenn Ihre Injektion von einer anderen Person gegeben wird, muss diese Person auch vorsichtig sein, wenn Sie die Nadeln entfernen und entsorgen, um eine versehentliche Nadelstabverletzung und eine Infektion zu verhindern.
B. Entsorgen Sie die Nadel in Ihrem speziellen, punkthaltigen Behälter (siehe Wie kann ich gebrauchte Nadeln und Apidra -Solostar entsorgen?).
C. Legen Sie die Stiftkappe immer wieder auf den Stift und lagern Sie die Apidra Solostar bis zu Ihrer nächsten Injektion.
Wie kann ich gebrauchte Nadeln und Apidra Solostar entsorgen?
- Erkundigen Sie sich bei Ihrem Gesundheitsdienstleister nach Anweisungen zum richtigen Weg, um gebrauchte Nadeln und Apidra Solostar zu entsorgen. Es kann lokale oder staatliche Gesetze geben, wie man gebrauchte Nadeln und Apidra Solostar wegwerfen. Entsorgen Sie keine gebrauchten Nadeln oder Apidra -Solostar im Haushaltsmüll und recyceln Sie sie nicht.
- Legen Sie gebrauchte Nadeln und gebrauchte leere Apidra-Solostar in einen Behälter, der speziell zur Entsorgung gebrauchter Spritzen und Nadeln (als scharfen Behälter bezeichnet) oder einem harten Kunststoffbehälter (z. B. leere Waschmittelflaschen) mit einer Schraufwallkappe oder einem Metallbehälter mit einem aus Kunststoffdeckel gekennzeichneten, gebrauchten Spritzen bezeichnet wird. Diese Behälter sollten den richtigen Weg versiegelt und entsorgt werden.
Wie soll ich Apidra Solostar aufbewahren?
- Kühlen Sie Apidra Solostar nach dem ersten Gebrauch nicht.
- Halten Sie bei Raumtemperatur unter 25 ° C (25 ° C).
- Entsorgen Sie alle geöffneten Apidra -Solostar 28 Tage nach der ersten Verwendung.
Wartung
- Schützen Sie Ihren Apidra -Solostar vor Staub und Schmutz.
- Sie können die Außenseite Ihrer Apidra -Solostar reinigen, indem Sie sie mit einem feuchten Tuch abwischen.
- Waschen oder schmieren Sie den Stift nicht, da dies ihn beschädigen kann.
- Behandeln Sie Ihre Apidra Solostar mit Sorgfalt. Vermeiden Sie Situationen, in denen Ihr Apidra -Solostar beschädigt werden könnte. Wenn Sie besorgt sind, dass Ihr Apidra -Solostar möglicherweise beschädigt wird, verwenden Sie eine neue.
Wenn Sie Fragen zu Apidra Solostar oder über Diabetes haben, bitten Sie Ihren Gesundheitsdienstleister unter www.apidra.com oder rufen Sie Sanofi-aventis USA unter 1-800-633-1610 an.