Lamictal
Die Informationen Auf Dieser Website Stellen Keine Medizinische Beratung Dar. Wir Verkaufen Nichts. Die Richtigkeit Der Übersetzung Wird Nicht Garantiert. Haftungsausschluss
Drogenzusammenfassung
Was ist Lamictal?
Lamictal (Lamotrigin) ist ein Antikonvulsant, das allein oder in Kombination mit anderen Antiseizure -Medikamenten zur Behandlung bestimmter Arten von Anfällen verwendet wird. Lamictal ist als erhältlich Generika .
Was sind Nebenwirkungen von Lamictal?
Zu den häufigen Nebenwirkungen von Lamictal gehören:
- Schwindel
- Schütteln (Zittern)
- Schläfrigkeit
- müde Gefühl
- Schläfrigkeit
- Koordinierungsverlust
- Kopfschmerzen
- doppelte Vision
- verschwommenes Sehen
- Brechreiz
- Erbrechen
- Magenverstimmung
- Magenschmerzen
- Trockener Mund
- Änderungen der Menstruationsperioden
- Rückenschmerzen
- Halsschmerzen
- laufende Nase oder
- Schlafprobleme (Schlaflosigkeit).
Zu den schwerwiegenden Nebenwirkungen von Lamictal, die Sie Ihrem Arzt melden sollten, gehören:
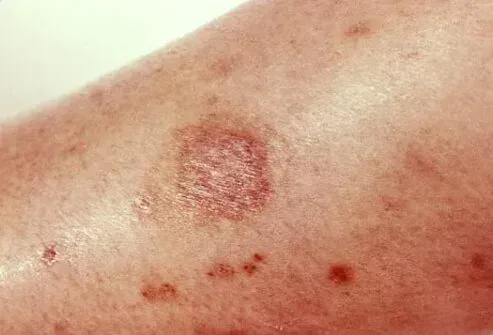
- Ausschlag
- Verschlechterung von Depressionen oder Selbstmordgedanken und
- Grippeähnliche Symptome wie Körperschmerzen oder geschwollene Drüsen.
Lamictal
- Fieber
- geschwollene Drüsen
- Schwäche
- Schwere Muskelschmerzen
- Jeglicher Hautausschlag vor allem durch Blasenbildung und Schälen
- Schmerzhafte Wunden in Ihrem Mund oder um Ihre Augen
- Kopfschmerzen
- Nackensteifigkeit
- Erhöhte Lichtempfindlichkeit
- Brechreiz Erbrechen
- Verwirrung
- Schläfrigkeit
- Gelben der Haut oder Augen ( Gelbsucht )
- blasse Haut
- kalte Hände und Füße
- Einfach Blutergüsse und
- ungewöhnliche Blutungen
Holen Sie sich sofort medizinische Hilfe, wenn Sie eines der oben aufgeführten Symptome haben.
Suchen Sie medizinische Versorgung oder rufen Sie auf einmal 911 an, wenn Sie die folgenden schwerwiegenden Nebenwirkungen haben:
- Schwerwiegende Augensymptome wie plötzlicher Sehverlust verschwommenes Sehen Tunnel Sehschmerzen oder Schwellungen oder Halos in der Umgebung des Lichts;
- Schwerwiegende Herzsymptome wie schnelle unregelmäßige oder pochende Herzschläge; Flattern in deiner Brust; Kurzatmigkeit; und plötzliche Schwindel -Unbeschwertheit oder ohnmächtig;
- Starke Kopfschmerzen Verwirrung verwirrt Spracharm oder Bein Schwäche Schwierigkeiten beim Verlust der Koordination unstabil sehr steifes Muskeln hoher Fieber problemlos Schwitzen oder Zittern.
Dieses Dokument enthält nicht alle möglichen Nebenwirkungen und andere können auftreten. Wenden Sie sich an Ihren Arzt nach zusätzlichen Informationen zu Nebenwirkungen.
Dosierung für Lamictal
Lamictal -Dosen hängen davon ab, dass der Zustand behandelt wird und ob sie allein oder in Kombination mit anderen Antiseizure -Medikamenten verwendet wird.
Welche Medikamentensubstanzen oder Nahrungsergänzungsmittel interagieren mit Lamictal?
Interaktionen von Arzneimitteln umfassen:
- Valproinsäure
- Carbamazepin
- phable
- primidone und
- Olanzapin
Lamictal während der Schwangerschaft und Stillen
Die Sicherheit der Verwendung von Lamictal während der Schwangerschaft wurde nicht festgestellt. Lamictal wird in Muttermilch und stillen, während Lamictal nicht empfohlen wird.
Weitere Informationen
Unsere Lamictal Side Effects Drug Center bietet einen umfassenden Überblick über die verfügbaren Arzneimittelinformationen über die potenziellen Nebenwirkungen bei der Einnahme dieses Medikaments.
FDA -Drogeninformationen
- Drogenbeschreibung
- Indikationen
- Dosierung
- Nebenwirkungen
- Wechselwirkungen mit Arzneimitteln
- Warnungen
- Überdosis
- Klinische Pharmakologie
- Medikamentenhandbuch
WARNUNG
Schwerwiegende Hautausschläge
Lamictal® kann schwerwiegende Hautausschläge verursachen, die Krankenhausaufenthalte und Absetzen der Behandlung erfordern. Die Inzidenz dieser Hautausschläge, zu denen das Stevens-Johnson-Syndrom gehörte, beträgt bei pädiatrischen Patienten (2 bis 16 Jahre) bei pädiatrischen Patienten (im Alter von 2 bis 16 Jahren) als zusätzliche Therapie bei der Epilepsie Lamictal als zusätzliche Therapie für Epilepsie. In klinischen Studien mit bipolarer und anderer Stimmungsstörungen betrug die Rate eines schwerwiegenden Ausschlags bei erwachsenen Patienten, die als anfängliche Monotherapie lamiktal wurden, und 0,13% (1,3 pro 1000) bei erwachsenen Patienten, die als Zusatztherapie lamiktaler Patienten erhalten, 0,08% (0,8 pro 1000). In einer prospektiv verfolgten Kohorte von pädiatrischen Patienten von 1983 (2 bis 16 Jahre im Alter von 2 bis 16 Jahren) gab es eine Epilepsie, die zusätzliche Lamictal einnahm, es gab einen Tod im Zusammenhang mit Ausschlag. In weltweiten Nachkrankungen wurden bei erwachsenen und pädiatrischen Patienten seltene Fälle von toxischen epidermalen Nekrolyse und/oder ausschlagbedingten Todesstoten berichtet, aber ihre Zahlen sind zu wenig, um eine genaue Schätzung der Rate zu ermöglichen.
Abgesehen von Alter sind noch keine Faktoren identifiziert, von denen bekannt ist, dass sie das Auftretensrisiko oder die Schwere des durch Lamictal verursachten Ausschlags vorhersagen. Es gibt noch Vorschläge, dass das Risiko eines Ausschlags auch durch (1) gleichzeitig mit Valproat (1) mit Valproat (einschließlich Valproinsäure und Divalprox -Natrium) erhöht werden kann (2), die die empfohlene anfängliche Dosis von Lamictal überschreiten oder (3) die empfohlene Dosis -Eskalation für die Lamictal überschreiten. In Abwesenheit dieser Faktoren sind jedoch Fälle aufgetreten.
Fast alle Fälle von lebensbedrohlichen Hautausschlägen, die durch Lamictal verursacht wurden, sind innerhalb von 2 bis 8 Wochen nach der Initiierung der Behandlung aufgetreten. Isolierte Fälle sind jedoch nach längerer Behandlung (z. B. 6 Monate) aufgetreten. Dementsprechend kann die Dauer der Therapie nicht als Mittel zur Vorhersage des potenziellen Risikos angewiesen werden, das durch das erste Auftreten eines Ausschlags angekündigt wird.
Obwohl gutartige Hautausschläge auch durch Lamictal verursacht werden, ist es nicht möglich, zuverlässig vorherzusagen, welche Hautausschläge schwerwiegend oder lebensbedrohlich sind. Dementsprechend sollte Lamictal normalerweise beim ersten Anzeichen eines Ausschlags abgesetzt werden, es sei denn, der Ausschlag ist eindeutig nicht mit Drogen verbunden. Die Einstellung der Behandlung kann nicht verhindern, dass ein Ausschlag lebensbedrohlich wird oder dauerhaft behindert oder entstellt wird [siehe Warnungen und VORSICHTSMASSNAHMEN ].
Beschreibung für Lamictal
LAMICTAL (lamotrigine) an AED of the phenyltriazine class is chemically unrelated to existing AEDs. Lamotrigine's chemical name is 35-diamino-6-(23-dichlorophenyl)-as-triazine its molecular formula is C9H7N5Cl2 und sein Molekulargewicht beträgt 256,09. Lamotrigin ist ein weißes bis helles, cremefarbenes Pulver und hat eine PKA von 5,7. Lamotrigin ist in Wasser (0,17 mg/ml bei 25 ° C) sehr leicht löslich und in 0,1 M HCl (4,1 mg/ml bei 25 ° C) leicht löslich. Die strukturelle Formel lautet:
| |
Lamictal-Tabletten werden für die orale Verabreichung als 25-mg-Tabletten mit 150 mg (Creme) und 200 mg (blau) geliefert. Jedes Tablet enthält die markierte Menge an Lamotrigin und die folgenden inaktiven Zutaten: Laktose; Magnesiumstearat; mikrokristalline Cellulose; Povidone; Natriumstärkeglykolat; Fd
Für die orale Verabreichung werden lamictal -kaubare Dispergieren bereitgestellt. Die Tabletten enthalten 2 mg (weiß) 5 mg (weiß) oder 25 mg (weiß) Lamotrigin und die folgenden inaktiven Inhaltsstoffe: Schwarzstrahlgeschmack Calciumcarbonat niedrig substituiertes Hydroxypropylcellulose-Magnesium-Aluminium-Silikat-Starat-Starat-Satchon-Natcharin-Starrch-Glyinium-Silikat-Starat-Starch-Starch-Glycolat-Satrium-Starrchismarkolat. Die kaubaren dispergierbaren Tabletten erfüllen organische Verunreinigungsverfahren 2, wie in der aktuellen USP -Monographie für Lamotrigin -Tabletten zur oralen Suspension veröffentlicht.
Für die orale Verabreichung werden lamiktale ODT oral zerfallende Tabletten geliefert. Die Tabletten enthalten 25 mg (weiß bis nicht weiß) 50 mg (weiß bis achksam) 100 mg (weiß bis nicht weiß) oder 200 mg (weiß bis nicht weiß) von Lamotrigin und den folgenden inaktiven inaktiven Zutaten: künstlicher Kirschgeschmack Crosspovidon Ethylcelluloses Magessium-Strearat-Mannit-Polyethyylen-Polyethyylen-Polyethyylen-Polyethyylen-Polyethylenpolyethyylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylen-Polyethylenpolyethylen.
Lamictal ODT oral auflösen Tabletten werden mithilfe von Technologies (Microcaps® und Advatab®) formuliert, um den bitteren Geschmack von Lamotrigin zu maskieren und ein schnelles Auflösungsprofil zu erreichen. Die Tabletteneigenschaften wie das Nachlager und die Benutzerfreundlichkeit wurden in einer Studie an 108 gesunden Freiwilligen als günstig eingestuft.
Verwendung für Lamictal
Epilepsie
Zusatztherapie
Lamictal wird als zusätzliche Therapie für die folgenden Anfallsarten bei Patienten ab 2 Jahren angezeigt:
- partielle Anfälle.
- Primärer generalisierter tonisch-klonischer (PGTC) Anfälle.
- Verallgemeinerte Anfälle des Lennox-Gastaut-Syndroms.
Monotherapie
Lamictal ist für die Umwandlung in die Monotherapie bei Erwachsenen (ab 16 Jahren) mit partiellen Anfällen angezeigt, die mit Carbamazepin-Phenytoin-Phenobarbital-Primidon oder Valproat als einzelnes Antiepileptika (AED) behandelt werden.
Sicherheit und Wirksamkeit von Lamictal wurden nicht als anfängliche Monotherapie festgestellt; (2) zur Umwandlung in eine Monotherapie von anderen AEDs als Carbamazepin -Phenytoin -Phenobarbital -Primidon oder Valproat; oder (3) für die gleichzeitige Umwandlung in eine Monotherapie von 2 oder mehr begleitenden AEDs.
Bipolare Störung
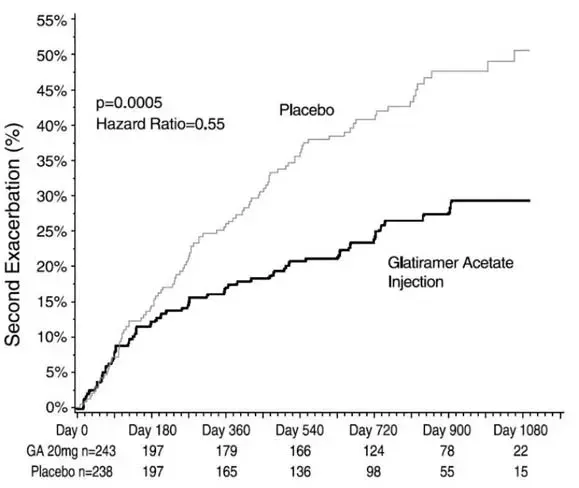
Lamictal ist für die Erhaltungsbehandlung der bipolaren I -Störung angezeigt, um die Zeit auf das Auftreten von Stimmungs -Episoden (Depression Mania Hypomania gemischte Episoden) bei Patienten zu verzögern Clinical Studies ].
Einschränkungen der Nutzung
Die Behandlung von akuten manischen oder gemischten Episoden wird nicht empfohlen. Die Wirksamkeit von Lamictal bei der akuten Behandlung von Stimmungs -Episoden wurde nicht festgestellt.
Dosierung für Lamictal
Allgemeine Dosierungsüberlegungen
Ausschlag
Es gibt noch Vorschläge, dass das Risiko eines schwerwiegenden potenziell lebensbedrohlichen Hautausschlags durch (1) gleichzeitige Verabreichung von Lamictal mit Valproat (2) erhöht werden kann, die die empfohlene anfängliche Dosis von Lamictal oder (3) die empfohlene Dosiserkalation für Lamictal überschreitet. Es sind jedoch Fälle in Abwesenheit dieser Faktoren aufgetreten [siehe WARNUNG BOXED ]. Therefore it is important that the dosing recommendations be followed closely.
Das Risiko eines unsichereren Ausschlags kann erhöht werden, wenn die empfohlene anfängliche Dosis und/oder die Dosis -Eskalationsrate für Lamictal überschritten wird, und bei Patienten mit Allergie oder Ausschlag gegen andere AEDs.
Lamictal Starter -Kits und lamictale ODT -Patient -Titrations -Kits liefern Lamictal in Dosen, die mit dem empfohlenen Titrationsplan für die ersten 5 Wochen der Behandlung übereinstimmen, die auf gleichzeitigen Medikamenten für Patienten mit Epilepsie (älter als 12 Jahre) und bipolarer I -Störungen (Erwachsene) basieren und das Potenzial für Ausschlag reduzieren sollen. Die Verwendung von Lamictal Starter Kits und lamictal ODT -Patienten -Titrations -Kits wird für geeignete Patienten empfohlen, die Lamictal starten oder neu starten [siehe Wie geliefert / Lagerung und Handhabung ].
Es wird empfohlen, dass Lamictal bei Patienten, die aufgrund eines Ausschlags im Zusammenhang mit der vorherigen Behandlung mit Lamotrigin nicht neu gestartet werden, nicht neu gestartet werden, es sei denn, die potenziellen Vorteile überwiegen eindeutig die Risiken. Wenn die Entscheidung getroffen wird, einen Patienten neu zu starten, der Lamictal eingestellt hat, sollte die Notwendigkeit, die anfänglichen Dosierungsempfehlungen neu zu starten, bewertet werden. Je größer das Zeitintervall seit der vorherigen Dosis ist, desto größer ist der Neustart der anfänglichen Dosierungsempfehlungen. Wenn ein Patient lamotrigin für einen Zeitraum von mehr als 5 Halbwertszeiten eingestellt hat, wird empfohlen, anfängliche Dosierungsempfehlungen und Richtlinien einzuhalten. Die Halbwertszeit von Lamotrigin wird durch andere begleitende Medikamente beeinflusst [siehe Klinische Pharmakologie ].
Lamictal, die zu Medikamenten hinzugefügt wurden, von denen bekannt ist, dass sie Glucuronidierung induzieren oder hemmen
Da Lamotrigin überwiegend durch Glucuronsäure -Konjugationsmedikamente metabolisiert wird, von denen bekannt ist, dass sie die Glucuronidation induzieren oder hemmen, kann die scheinbare Clearance von Lamotrigin beeinflussen. Medikamente, die Glucuronidation induzieren, umfassen Carbamazepin-Phenytoin-Phenobarbital-Primidon-Rifampin-Östrogen-haltige Produkte, einschließlich oraler Kontrazeptiva und der Proteaseinhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir. Valproat hemmt die Glucuronidierung. Für Dosierungsüberlegungen für Lamictal bei Patienten mit ösogenhaltigen Produkten wie Kontrazeptiva und Atazanavir/Ritonavir siehe unten und Tabelle 13. Für die Dosierung von Überlegungen für Lamictal bei Patienten mit anderen Medikamenten, von denen bekannt ist, dass sie Glucuronidation induzieren oder hemmen, siehe Tabellen 1 2 5-6 und 13.
Zielplasmaspiegel bei Patienten mit Epilepsie oder bipolarer Störung
Für Lamotrigin wurde kein therapeutischer Plasmakonzentrationsbereich festgelegt. Die Dosierung von Lamictal sollte auf der therapeutischen Reaktion beruhen [siehe Klinische Pharmakologie ].
Frauen, die östrogenhaltige orale Kontrazeptiva einnehmen
Lamictal bei Frauen einnehmen, die östrogenhaltige orale Kontrazeptiva einnehmen
Obwohl gezeigt wurde Klinische Pharmakologie ] Keine Anpassungen der empfohlenen Dosis-Eskalationsrichtlinien für Lamictal sollten ausschließlich auf der Verwendung von östrogenhaltigen oralen Kontrazeptiva erforderlich sein. Daher sollte die Dosis -Eskalation den empfohlenen Richtlinien für die Einleitung einer zusätzlichen Therapie mit Lamictal befolgen, die auf den gleichzeitigen AED oder anderen begleitenden Medikamenten basieren (siehe Tabellen 1 5 und 7). Im Folgenden finden Sie Anpassungen an Erhaltungsdosen von Lamictal bei Frauen, die östrogenhaltige orale Kontrazeptiva einnehmen.
Anpassungen der Erhaltungsdosis von Lamictal bei Frauen, die östrogenhaltige orale Kontrazeptiva einnehmen
(1) Einnahme östrogenhaltiger oraler Kontrazeptiva: Bei Frauen, die Carbamazepin-Phenytoin-Phenobarbital-Primidon oder andere Arzneimittel wie Rifampin und die Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir nicht einnehmen Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ] Die Wartungsdosis von Lamictal muss in den meisten Fällen um bis zu 2-fach über die empfohlene Zielwartungsdosis erhöht werden, um einen konsistenten Lamotrigin-Plasmaspiegel aufrechtzuerhalten.
(2) Estrogen-haltige orale Kontrazeptiva starten: Bei Frauen, die eine stabile Dosis von Lamiktal einnehmen und keine Carbamazepin-Phenytoin-Phenobarbital-Primidon oder andere Medikamente wie Rifampin und die Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavira-Inhibitoren [durch die Protease-Lamotrigine-Lamotrigine-[-zwei) einnehmen, die sich mit Lamotriginen-Lamotriginidation befinden, die sich mit Lamotriginidation befinden, die die Lamotrigine-[-durch Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ] Die Wartungsdosis muss in den meisten Fällen um bis zu 2-fach erhöht werden, um einen konsistenten Lamotrigin-Plasmaspiegel aufrechtzuerhalten. Die Erhöhung der Dosis sollte gleichzeitig beginnen, wenn die orale Kontrazeptivität eingeführt wird, und fordert die klinische Reaktion nicht schneller als 50 bis 100 mg/Tag pro Woche fort. Die Dosiserhöhung dürfte die empfohlene Geschwindigkeit nicht überschreiten (siehe Tabellen 1 und 5), es sei denn, die Plasmaspiegel der Lamotrigin oder die klinische Reaktion unterstützen größere Erhöhungen. Während der Woche der inaktiven hormonellen Präparation (pillenfreie Woche) können allmähliche transiente Zunahme der Lamotrigin-Plasmakehme auftreten, und diese Erhöhungen sind größer, wenn die Dosiserhöhung in den Tagen vor oder während der Woche der inaktiven hormonellen Vorbereitung vorgenommen wird. Erhöhte Lamotrigin -Plasmaspiegel könnten zu zusätzlichen Nebenwirkungen wie Schwindelataxie und Diplopie führen. Wenn nachteilige Reaktionen, die auf Lamictal zurückzuführen sind, während der pill-freien Wochenanpassung an die Gesamtwartungsdosis konsequent auftreten. Die auf die pillenfreien Woche begrenzte Dosisanpassungen werden nicht empfohlen. Für Frauen, die neben Carbamazepin -Phenytoin -Phenobarbital -Primidon oder anderen Arzneimitteln wie Rifampin und den Protease -Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir, die Lamotrigine induzieren, sollten Lamotrigin -Glukuridierung ohne Lamotrigine induziert werden [an sehen, sollten ansehen [sehen, sollte [an sehen, sollten [angewandt sein, sollte ansehen [sehen, dass [angewandt sein sollte [sehen, dass [Scheines, [angewandt ist,) einnehme, für Frauen. Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ].
(3) die östrogenhaltigen oralen Kontrazeptiva stoppen: Bei Frauen, die Carbamazepin-Phenytoin-Phenobarbital-Primidon oder andere Arzneimittel wie Rifampin und die Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir nicht einnehmen, sehen Lamotrigine Glucuronidation [an. Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ] Die Erhaltungsdosis von Lamictal muss in den meisten Fällen um bis zu 50% gesenkt werden, um einen konsistenten Lamotrigin -Plasmaspiegel aufrechtzuerhalten. Die Abnahme der Lamictal-Dosis sollte 25% der gesamten täglichen Dosis pro Woche über einen Zeitraum von 2 Wochen nicht überschreiten, es sei denn Klinische Pharmakologie ]. In women taking Lamictal in addition to Carbamazepin phable phenobarbital primidone or other drugs such as rifampin and the protease inhibitors lopinavir/ritonavir and atazanavir/ritonavir that induce lamotrigine glucuronidation [sehen Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ] Es sollte keine Anpassung an die Dosis von Lamictal erforderlich sein.
Frauen und andere hormonelle Verhütungsvorbereitungen oder Hormonersatztherapie
Die Wirkung anderer hormoneller Verhütungsmittelpräparate oder Hormonersatztherapie (HRT) auf die Pharmakokinetik von Lamotrigin wurde nicht systematisch bewertet. Andere östrogenhaltige Therapien wie HRT können Lamotrigin stören. Daher kann eine genaue klinische Überwachung der Wirksamkeit von Lamictal mit Dosisanpassung erforderlich sein [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]. It has been reported that ethinylestradiol not progestogens increased the clearance of lamotrigine up to 2-fold and the progestin-only pills had no effect on lamotrigine plasma levels. Therefore adjustments to the dosage of Lamictal in the presence of progestogens alone will likely not be needed.
Patienten, die Atazanavir/Ritonavir einnehmen
Während Atazanavir/Ritonavir die Lamotrigin-Plasmakonzentration verringert, sollten keine Anpassungen der empfohlenen Dosis-Eskalationsrichtlinien für Lamictal erforderlich sein, die ausschließlich auf der Verwendung von Atazanavir/Ritonavir anhand von Atazanavir/Ritonavir erforderlich sein sollten. Die dosis -Eskalation sollte den empfohlenen Richtlinien für die Einleitung einer zusätzlichen Therapie mit Lamictal befolgen, die auf gleichzeitigen AED oder anderen begleitenden Medikamenten basieren (siehe Tabellen 1 2 und 5). Bei Patienten, die bereits Erhaltungsdosen von Lamictal einnehmen und keine Glucuronidierungsinduktoren einnehmen, muss die Dosis von Lamictal möglicherweise erhöht werden, wenn Atazanavir/Ritonavir hinzuge Klinische Pharmakologie ].
Patienten mit Leberbehinderung
Die Erfahrung bei Patienten mit Leberbeeinträchtigungen ist begrenzt. Basierend auf einer klinischen Pharmakologie -Studie an 24 Probanden mit leichten mittelschweren und schweren Leberbeeinträchtigungen [siehe Verwendung in bestimmten Populationen Klinische Pharmakologie ] Die folgenden allgemeinen Empfehlungen können abgegeben werden. Bei Patienten mit leichter Leberbehinderung ist keine Dosierungsanpassung erforderlich. Die anfänglichen Eskalations- und Erhaltungsdosen sollten bei Patienten mit mittelschwerer und schwerer Leberbeeinträchtigung ohne Aszites im Allgemeinen um etwa 25% und bei Patienten mit schwerer Leberbeeinträchtigung mit Aszites reduziert werden. Eskalations- und Wartungsdosen können nach klinischem Ansprechen angepasst werden.
Wie viel ist zu viel Selenium
Patienten mit Nierenbehinderung
Anfangsdosen von Lamictal sollten auf gleichzeitigen Medikamenten der Patienten beruhen (siehe Tabellen 1-3 und 5); Reduzierte Erhaltungsdosen können bei Patienten mit einer signifikanten Nierenbeeinträchtigung wirksam sein [siehe Verwendung in bestimmten Populationen Klinische Pharmakologie ]. Few patients with severe renal impairment have been evaluated during chronic treatment with Lamictal. Because there is inadequate experience in this population Lamictal should be used with caution in these patients.
Abbruchstrategie
Epilepsie
Bei Patienten, die Lamictal in Kombination mit anderen AEDs erhalten, sollte eine Neubewertung aller AEDs im Regime berücksichtigt werden, wenn eine Änderung der Anfallskontrolle oder ein Erscheinungsbild oder eine Verschlechterung unerwünschter Reaktionen beobachtet wird.
Wenn eine Entscheidung getroffen wird, die Therapie mit Lamictal abzubrechen, wird eine schrittweise Reduzierung der Dosis über mindestens 2 Wochen (ca. 50% pro Woche) empfohlen, es sei denn, Sicherheitsbedenken erfordern einen schnelleren Rückzug [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Abnahme von Carbamazepin-Phenytoin-Phenobarbital-Primidon oder anderen Arzneimitteln wie Rifampin und Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir, die Lamotrigin-Glucuronidation induzieren, sollte die Halbmordrücke von Lamotrigine verlängern; Das Absetzen von Valproat sollte die Halbwertszeit von Lamotrigin verkürzen.
Bipolare Störung
In den kontrollierten klinischen Studien gab es keine Zunahme des Inzidenzarts oder der Schwere von Nebenwirkungen nach abrupter Beendigung von Lamictal. Im Programm für klinische Entwicklung bei Erwachsenen mit bipolarer Störung trafen 2 Patienten kurz nach dem abrupten Rückzug von Lamictal. Die Einstellung von Lamictal sollte eine schrittweise Verringerung der Dosis über mindestens 2 Wochen (ca. 50% pro Woche) beinhalten, es sei denn, Sicherheitsbedenken erfordern einen schnelleren Rückzug [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Epilepsie - Zusatztherapie
Dieser Abschnitt enthält spezifische Dosierungsempfehlungen für Patienten älter als 12 Jahre und Patienten im Alter von 2 bis 12 Jahren. Innerhalb jeder dieser Altersgruppen werden spezifische Dosierungsempfehlungen in Abhängigkeit von begleitenden AEDs oder anderen begleitenden Medikamenten gegeben (siehe Tabelle 1 für Patienten älter als 12 Jahre und Tabelle 2 für Patienten im Alter von 2 bis 12 Jahren). Ein gewichtsbasierter Dosierungsanleitung für Patienten im Alter von 2 bis 12 Jahren im begleitenden Valproat ist in Tabelle 3 angegeben.
Patienten älter als 12 Jahre
Empfohlene Dosierungsrichtlinien sind in Tabelle 1 zusammengefasst.
Tabelle 1: Eskalationsregime für Lamictal bei Patienten, die älter als 12 Jahre mit Epilepsie sind
| Bei Patienten, die Valproat einnehmena | Bei Patienten, die Carbamazepin -Phenytoin -Phenobarbital -Primidon nicht einnehmenb oder Valproata | Bei Patienten, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmenb und nicht Valproat einnehmena | |
| Wochen 1 und 2 | 25 mg jeden zweiten Tag | 25 mg jeden Tag | 50 mg/Tag |
| Wochen 3 und 4 | 25 mg jeden Tag | 50 mg/Tag | 100 mg/Tag (in 2 geteilten Dosen) |
| Woche 5 zum Wartung | Erhöhen Sie alle 1 bis 2 Wochen um 25 bis 50 mg/Tag. | Erhöhen Sie alle 1 bis 2 Wochen um 50 mg/Tag. | Erhöhen Sie alle 1 bis 2 Wochen um 100 mg/Tag. |
| Übliche Wartungsdosis | 100 bis 200 mg/Tag mit Valproat allein 100 bis 400 mg/Tag mit Valproat und anderen Medikamenten, die Glucuronidation induzieren (in 1 oder 2 geteilten Dosen) | 225 bis 375 mg/Tag (in 2 geteilten Dosen) | 300 bis 500 mg/Tag (in 2 geteilten Dosen) |
| a Es wurde gezeigt Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. b Medikamente, die Lamotrigin-Glucuronidation induzieren und die Clearance als die angegebenen AEDs erhöhen, umfassen östliche orale Kontrazeptiva-Rifampin und die Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir. Dosierungsempfehlungen für östrogenhaltige Produkte, einschließlich oraler Kontrazeptiva und des Protease-Inhibitors Atazanavir/Ritonavir, finden Sie in allgemeinen Dosierungsüberlegungen [siehe Dosierung und Verwaltung ]. Patients on rifampin and the protease inhibitor lopinavir/ritonavir should follow the same dosing titration/maintenance regimen used with AEDs that induce glucuronidation and increase clearance [sehen Dosierung und Verwaltung Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. |
Patienten im Alter von 2 bis 12 Jahren
Empfohlene Dosierungsrichtlinien sind in Tabelle 2 zusammengefasst.
Niedrigere Startdosen und langsamere Eskalationen als diejenigen, die in klinischen Studien verwendet werden, werden empfohlen, da das Risiko eines Hautausschlags durch niedrigere Startdosen und langsamere Dosiserkalationen verringert werden kann. Daher dauern die Erhaltungsdosen in der klinischen Praxis länger als in klinischen Studien. Es kann mehrere Wochen bis Monate dauern, bis eine individuelle Wartungsdosis erreicht ist. Erhaltungsdosen bei Patienten mit Wiegen <30 kg regardless of age or concomitant AED may need to be increased as much as 50% based on clinical response.
Die kleinste verfügbare Stärke von Lamictal -Tabletten für die orale Suspension beträgt 2 mg und nur ganze Tabletten sollten verabreicht werden. Wenn die berechnete Dosis mit ganzer Tabletten nicht erreicht werden kann, sollte die Dosis auf das nächste ganze Tablet abgerundet werden [siehe Wie geliefert / Lagerung und Handhabung Medikamentenhandbuch ].
Tabelle 2: Eskalationsregime für Lamictal bei Patienten im Alter von 2 bis 12 Jahren mit Epilepsie
| Bei Patienten, die Valproat einnehmena | Bei Patienten, die Carbamazepin -Phenytoin -Phenobarbital -Primidon nicht einnehmenb oder Valproata | Bei Patienten, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmenb und nicht Valproat einnehmena | |
| Wochen 1 und 2 | 0,15 mg/kg/Tag In 1 oder 2 geteilte Dosen rundete sich auf das nächste ganze Tablet ab (siehe Tabelle 3 für Gewichtsdosierungshandbuch) | 0,3 mg/kg/Tag In 1 oder 2 geteilte Dosen rundete sich auf die nächste ganze Tablette ab | 0,6 mg/kg/Tag In 2 geteilten Dosen rundete sich auf die nächste ganze Tablette ab |
| Wochen 3 und 4 | 0,3 mg/kg/Tag In 1 oder 2 geteilte Dosen rundete sich auf das nächste ganze Tablet ab (siehe Tabelle 3 für Gewichtsdosierungshandbuch) | 0,6 mg/kg/Tag In 2 geteilten Dosen rundete sich auf die nächste ganze Tablette ab | 1,2 mg/kg/Tag In 2 geteilten Dosen rundete sich auf die nächste ganze Tablette ab |
| Woche 5 zum Wartung | Die Dosis sollte alle 1 bis 2 Wochen wie folgt erhöht werden: Berechnen Sie 0,3 mg/kg/Tag, um diesen Betrag auf das nächste ganze Tablet zu runden und diese Menge zur zuvor verabreichten täglichen Dosis hinzuzufügen. | Die Dosis sollte alle 1 bis 2 Wochen wie folgt erhöht werden: Berechnen Sie 0,6 mg/kg/Tag, um diesen Betrag auf das nächste ganze Tablet zu runden und diese Menge der zuvor verabreichten Tagesdosis hinzuzufügen. | Die Dosis sollte alle 1 bis 2 Wochen wie folgt erhöht werden: Berechnen Sie 1,2 mg/kg/Tag, um diesen Betrag auf das nächste ganze Tablet zu runden und diese Menge der zuvor verabreichten Tagesdosis hinzuzufügen. |
| Übliche Wartungsdosis | 1 bis 5 mg/kg/Tag (Maximal 200 mg/Tag in 1 oder 2 geteilten Dosen) 1 bis 3 mg/kg/Tag mit Valproat allein | 4,5 bis 7,5 mg/kg/Tag (Maximal 300 mg/Tag in 2 geteilten Dosen) | 5 bis 15 mg/kg/Tag (maximal 400 mg/Tag in 2 geteilten Dosen) |
| Erhaltungsdosis bei Patienten <30 kg | Möglicherweise müssen aufgrund des klinischen Ansprechens um bis zu 50% erhöht werden. | Möglicherweise müssen aufgrund des klinischen Ansprechens um bis zu 50% erhöht werden. | Möglicherweise müssen aufgrund des klinischen Ansprechens um bis zu 50% erhöht werden. |
| Hinweis: Für die Dosierung sollten nur ganze Tabletten verwendet werden. a Es wurde gezeigt Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. b Medikamente, die Lamotrigin-Glucuronidation induzieren und die Clearance als die angegebenen AEDs erhöhen, umfassen östliche orale Kontrazeptiva-Rifampin und die Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir. Dosierungsempfehlungen für östrogenhaltige Produkte, einschließlich oraler Kontrazeptiva und des Protease-Inhibitors Atazanavir/Ritonavir, finden Sie in allgemeinen Dosierungsüberlegungen [siehe Dosierung und Verwaltung ]. Patients on rifampin and the protease inhibitor lopinavir/ritonavir should follow the same dosing titration/maintenance regimen used with AEDs that induce glucuronidation and increase clearance [sehen Dosierung und Verwaltung Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. |
Tabelle 3: Der anfängliche Gewichtsdosierungsanleitung für Patienten im Alter von 2 bis 12 Jahren, die Valproat (Wochen 1 bis 4) mit Epilepsie einnehmen
| Wenn das Gewicht des Patienten ist | Geben Sie diese tägliche Dosis mit der am besten geeigneten Kombination aus Lamictal 2- und 5-mg-Tabletten an | ||
| Größer als | Und weniger als | Wochen 1 und 2 | Wochen 3 und 4 |
| 6,7 kg | 14 kg | 2 mg jeden zweiten Tag | 2 mg jeden Tag |
| 14,1 kg | 27 kg | 2 mg jeden Tag | 4 mg jeden Tag |
| 27,1 kg | 34 kg | 4 mg jeden Tag | 8 mg jeden Tag |
| 34,1 kg | 40 kg | 5 mg jeden Tag | 10 mg jeden Tag |
Übliche Zusatzwartungsdosis für Epilepsie
Die in den Tabellen 1 und 2 identifizierten üblichen Wartungsdosen stammen aus Dosierungsschemata, die in den placebokontrollierten zusätzlichen Versuchen eingesetzt werden, in denen die Wirksamkeit von Lamictal festgelegt wurde. Bei Patienten, die Multidrug -Regime erhalten, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon ohne Valproat -Erhaltungsdosen von zusätzlichen Lamictal bis zu 700 mg/Tag verwenden, wurden verwendet. Bei Patienten, die Valproat allein erhalten, wurden Wartungsdosen von zusätzlichen Lamikten von bis zu 200 mg/Tag verwendet. Der Vorteil der Verwendung von Dosen, die über den in den Tabellen 1 bis 4 empfohlenen Dosen verwendet wurden, wurde in kontrollierten Versuchen nicht festgelegt.
Epilepsie - Conversion From Zusatztherapie To Monotherapie
Das Ziel des Übergangsregimes ist es, zu versuchen, die Beschlagnahmungskontrolle aufrechtzuerhalten und gleichzeitig das Risiko eines schwerwiegenden Hautausschlags im Zusammenhang mit der schnellen Titration von Lamictal zu verringern.
Die empfohlene Erhaltungsdosis von Lamictal als Monotherapie beträgt 500 mg/Tag in 2 geteilten Dosen.
Um ein erhöhtes Ausfallrisiko zu vermeiden, sollten die empfohlene anfängliche Dosis und die anschließende Dosis Eskalationen für Lamictal nicht überschritten werden [siehe WARNUNG BOXED ].
Umwandlung aus der Zusatztherapie mit Carbamazepin -Phenytoin -Phenobarbital oder Primidon zu Monotherapie mit Lamictal
Nach einer Dosis von 500 mg/Tag Lamictal unter Verwendung der Richtlinien in Tabelle 1 sollte das gleichzeitige Enzym-induzierende AED über einen Zeitraum von 4 Wochen um 20% abgeschlossen werden. Das Regime für den Entzug des begleitenden AED basiert auf Erfahrungen, die in der kontrollierten klinischen Studie mit kontrollierter Monotherapie gesammelt wurden.
Umwandlung von der Zusatztherapie mit Valproat zu Monotherapie mit Lamictal
Das Umrechnungsschema umfasst die 4 in Tabelle 4 beschriebenen Schritte.
Tabelle 4: Umwandlung von der Zusatztherapie mit Valproat zu Monotherapie mit Lamictal bei Patienten ab 16 Jahren mit Epilepsie
| Lamictal | Valproat | |
| Schritt 1 | Erhalten Sie eine Dosis von 200 mg/Tag gemäß den Richtlinien in Tabelle 1. | Aufrechterhalten der etablierten stabilen Dosis. |
| Schritt 2 | Bei 200 mg/Tag unterhalten. | Verringern Sie die Dosis durch Decrements nicht mehr als 500 mg/Tag/Woche auf 500 mg/Tag und halten Sie dann 1 Woche lang. |
| Schritt 3 | Erhöhen Sie auf 300 mg/Tag und halten Sie 1 Woche lang auf. | Gleichzeitig auf 250 mg/Tag abnehmen und 1 Woche lang aufhalten. |
| Schritt 4 | Erhöhen Sie jede Woche um 100 mg/Tag, um eine Wartungsdosis von 500 mg/Tag zu erreichen. | Einstellen. |
Umwandlung aus der Zusatztherapie mit anderen Antiepileptika -Medikamenten als Carbamazepin -Phenytoin -Phenobarbital -Primidon oder Valproat zur Monotherapie mit Lamictal
Für die Umwandlung in die Monotherapie mit Lamictal mit anderen AEDs als Carbamazepin -Phenytoin -Phenobarbital -Primidon oder Valproat können keine spezifischen Dosierungsrichtlinien vorgesehen werden.
Bipolare Störung
Das Ziel der Erhaltungsbehandlung mit Lamictal ist es, die Zeit auf das Auftreten von Stimmungs -Episoden (Depression Mania Hypomania gemischte Episoden) bei Patienten zu verzögern, die für akute Stimmungs -Episoden mit Standardtherapie behandelt wurden [siehe Indikationen und Nutzung ].
Patienten, die lamictal länger als 16 Wochen einnehmen, sollten regelmäßig neu bewertet werden, um die Notwendigkeit einer Erhaltungsbehandlung zu bestimmen.
Erwachsene
The target dose of LAMICTAL is 200 mg/day (100 mg/day in patients taking valproate which decreases the apparent clearance of lamotrigine and 400 mg/day in patients not taking valproate and taking either carbamazepine phenytoin phenobarbital primidone or other drugs such as rifampin and the protease inhibitor lopinavir/ritonavir that increase the apparent clearance of Lamotrigin). In den klinischen Studien wurden Dosen von bis zu 400 mg/Tag, während die Monotherapie bewertet wurde; Bei 400 mg/Tag wurde jedoch kein zusätzlicher Nutzen im Vergleich zu 200 mg/Tag beobachtet [siehe Clinical Studies ]. Accordingly doses above 200 mg/day are not recommended.
Die Behandlung mit Lamictal wird auf der Grundlage gleichzeitiger Medikamente nach dem in Tabelle 5 dargelegten Regime eingeführt. Wenn andere psychotrope Medikamente nach einer Stabilisierung zurückgezogen werden, sollte die Dosis von Lamictal angepasst werden. Bei Patienten, die Valproat absetzen, sollte die Dosis von Lamictal in gleichen wöchentlichen Schritten über einen Zeitraum von 2 Wochen verdoppelt werden (siehe Tabelle 6). Bei Patienten, die Carbamazepin-Phenytoin-Phenobarbital-Primidon oder andere Arzneimittel wie Rifampin und die Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir, die Lamotrigin-Glucuronidation in der ersten Woche vergrößern, sollte die Hälfte der Hälfte der Hälfte der Hälfte der Hälfte der Hälfte von einer 2-markten Hälfte. 6). Die Dosis von Lamictal kann dann als klinisch angegeben an die Zieldosis (200 mg) angepasst werden.
Wenn anschließend andere Medikamente eingeführt werden, muss die Dosis von Lamictal möglicherweise angepasst werden. Insbesondere die Einführung von Valproat erfordert eine Verringerung der Lamictal -Dosis [siehe Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ].
Um ein erhöhtes Ausschlagrisiko zu vermeiden, sollten die empfohlene anfängliche Dosis und die anschließende Dosis Eskalationen von Lamictal nicht überschritten werden [siehe WARNUNG BOXED ].
Tabelle 5: Eskalationsregime für Lamictal bei Erwachsenen mit bipolarer Störung
| Bei Patienten, die Valproat einnehmena | Bei Patienten, die Carbamazepin -Phenytoin -Phenobarbital -Primidon nicht einnehmenb oder Valproata | Bei Patienten, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmenb und nicht Valproat einnehmena | |
| Wochen 1 und 2 | 25 mg jeden zweiten Tag | 25 mg täglich | 50 mg täglich |
| Wochen 3 und 4 | 25 mg täglich | 50 mg täglich | 100 mg täglich in geteilten Dosen |
| Woche 5 | 50 mg täglich | 100 mg täglich | 200 mg täglich in geteilten Dosen |
| Woche 6 | 100 mg täglich | 200 mg täglich | 300 mg täglich in geteilten Dosen |
| Woche 7 | 100 mg täglich | 200 mg täglich | bis zu 400 mg täglich in geteilten Dosen |
| a Es wurde gezeigt Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. b Medikamente, die Lamotrigin-Glucuronidation induzieren und die Clearance als die angegebenen AEDs erhöhen, umfassen östrogenhaltige Produkte, einschließlich oraler Kontrazeptiva Rifampin und die Proteaseinhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir. Dosierungsempfehlungen für orale Kontrazeptiva und der Protease -Inhibitor Atazanavir/Ritonavir finden Sie in allgemeinen Dosierungsüberlegungen [siehe Dosierung und Verwaltung ]. Patients on rifampin and the protease inhibitor lopinavir/ritonavir should follow the same dosing titration/maintenance regimen used with AEDs that induce glucuronidation and increase clearance [sehen Dosierung und Verwaltung Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. |
Tabelle 6: Dosierungsanpassungen an Lamictal bei Erwachsenen mit bipolarer Störung nach Absetzen von Psychopharmaka
| Abbruch von Psychopharmaka (ohne Valproata Carbamazepin -Phenobarbital oder Primidonb) | Nach Abbruch von Valproata | Nach Abbruch von Carbamazepin -Phenytoin -Phenobarbital oder Primidonb | |
| Aktuelle Dosis Lamictal (mg/Tag) 100 | Aktuelle Dosis Lamictal (mg/Tag) 400 | ||
| Woche 1 | Die aktuelle Lamictal -Dosis beibehalten | 150 | 400 |
| Woche 2 | Die aktuelle Lamictal -Dosis beibehalten | 200 | 300 |
| Woche 3 weiter | Die aktuelle Lamictal -Dosis beibehalten | 200 | 200 |
| a Es wurde gezeigt Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. b Medikamente, die Lamotrigin-Glucuronidation induzieren und die Clearance als die angegebenen AEDs erhöhen, umfassen östrogenhaltige Produkte, einschließlich oraler Kontrazeptiva Rifampin und die Proteaseinhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir. Dosierungsempfehlungen für orale Kontrazeptiva und der Protease -Inhibitor Atazanavir/Ritonavir finden Sie in allgemeinen Dosierungsüberlegungen [siehe Dosierung und Verwaltung ]. Patients on rifampin and the protease inhibitor lopinavir/ritonavir should follow the same dosing titration/maintenance regimen used with AEDs that induce glucuronidation and increase clearance [sehen Dosierung und Verwaltung Wechselwirkungen mit Arzneimitteln Klinische Pharmakologie ]. |
Verabreichung von Lamictal -Tabletten zur oralen Suspension
Lamictal tablets for oral suspension may be swallowed whole chewed or dispersed in water or diluted fruit juice. If the tablets are chewed consume a small amount of water or diluted fruit juice to aid in swallowing.
Um Lamictal -Tabletten für die orale Suspension zu dispergieren, geben Sie die Tabletten zu einer geringen Menge Flüssigkeit (1 Teelöffel oder genug, um das Medikament abzudecken). Ungefähr 1 Minute später, wenn die Tablets vollständig verteilt sind, verteilt sich die Lösung und verbrauchen die gesamte Menge sofort. Es sollte kein Versuch unternommen werden, teilweise Mengen der dispergierten Tabletten zu verabreichen.
Verabreichung von lamiktalen ODT oral zerfalten Tabletten
Lamictal ODT orally disintegrating tablets should be placed onto the tongue and moved around in the mouth. The tablet will disintegrate rapidly can be swallowed with or without water and can be taken with or without food.
Wie geliefert
Dosierung Forms And Strengths
Tabletten
25-mg-weiße schildförmige Tabletten mit Lamictal und 25.
100 mg Pfirsich erzielte schildförmige Tabletten mit Lamictal und 100.
150-mg-Creme erzielte schildförmige Tabletten mit Lamictal und 150.
200-mg Blue erzielte schildförmige Tabletten mit Lamictal und 200.
Tabletten For Oral Suspension
2-mg-weiße bis nicht weiße runde Tabletten mit LTG über 2.
5-mg-weiße bis nicht-weiße Caplet-förmige Tabletten mit GX CL2 gestrichen.
25-mg weiße super elliptische Tabletten mit GX CL5 gestrichen.
Oral zerfetzen Tabletten
25-mg-weiße bis nicht weiße, rund umgeschnittene Radius-Tabletten mit LMT auf der einen Seite und 25 auf der anderen Seite.
50 mg weiße bis nicht weiße, rund umgeschnittene Radius-Tabletten mit LMT auf der einen Seite und 50 auf der anderen Seite.
100 mg weiße bis nicht weiße, rund umgeschnittene Radius-Tabletten mit Lamictal auf der einen Seite und 100 auf der anderen Seite.
200 mg weiße bis nicht weiße, rund umgeschnittene Radius-Tabletten mit Lamictal auf der einen und 200 auf der anderen Seite.
Lagerung und Handhabung
Lamictal (lamotrigine) tablets
25-mg-weiß bewertete schildförmige Tabletten mit Lamictal und 25 Flaschen mit 100 (100 Flaschen NDC 0173-0633-02).
Speichern Sie bei 25 ° C (77 ° F); Exkursionen, die auf 15 ° C bis 30 ° C (59 ° F bis 86 ° F) zulässig sind [siehe USP -kontrollierte Raumtemperatur ] an einem trockenen Ort.
100 mg Pfirsich erzielte schildförmige Tabletten mit Lamictal und 100 Flaschen mit 100 (100 Flaschen NDC 0173-0642-55).
150-mg-Creme bewertete Schild-förmige Tabletten mit Lamictal und 150 60 Flaschen (60 Flaschen NDC 0173-0643-60).
200-mg Blue-Scored Shield-förmige Tabletten mit Lamictal und 200 Flaschen mit 60 (60 Flaschen NDC 0173-0644-60).
Speichern Sie bei 25 ° C (77 ° F); Exkursionen, die auf 15 ° C bis 30 ° C (59 ° F bis 86 ° F) zulässig sind [siehe USP -kontrollierte Raumtemperatur ] an einem trockenen Ort und vor Licht schützen.
Lamictal (lamotrigine) Starter Kit For Patients Taking Valproat (Blue Kit)
25-mg weiß bewertete Schild-förmige Tabletten mit Lamictal- und 25 Blasenpaket mit 35 Tabletten ( NDC 0173-0633-10).
Speichern Sie bei 25 ° C (77 ° F); Exkursionen, die auf 15 ° C bis 30 ° C (59 ° F bis 86 ° F) zulässig sind [siehe USP -kontrollierte Raumtemperatur ] an einem trockenen Ort.
Lamictal (lamotrigine) Starter Kit For Patients Taking Carbamazepin -Phenobarbital oder Primidon and Not Taking Valproat (Green Kit)
25-mg-Schildschütze-Tabletten mit Lamictal- und 25- und 100 mg Pfirsich-Scored-Schild-Tabletten mit Lamictal und 100 Blisterpaket mit 98 Tabletten (84/25-mg-Tabletten und 14/100-mg-Tabletten) (100-mg-Tabletten) (84/25-mg-Tabletten) (80 mg. NDC 0173-0817-28).
Speichern Sie bei 25 ° C (77 ° F); Exkursionen, die auf 15 ° C bis 30 ° C (59 ° F bis 86 ° F) zulässig sind [siehe USP -kontrollierte Raumtemperatur ] an einem trockenen Ort und vor Licht schützen.
Lamictal (lamotrigine) Starter Kit For Patients Not Taking Carbamazepin Phable Phenobarbital -Primidon Or Valproat (Orange Kit)
25-mg-Schildschild-förmige Tabletten mit Lamictal- und 25- und 100 mg Pfirsich-Scored Shield-förmigen Tabletten mit Lamictal- und 100 Blisterpaket mit 49 Tabletten (42/25-mg-Tabletten und 7/100-mg-Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (42/25-mg-Tabletten) (Tabletten) (49 Tabletten) (Tabletten mit 7/100-mg) (5/100-mg-Tabletten) (42/25-mg-Tabletten) (42. NDC 0173-0594-02).
Speichern Sie bei 25 ° C (77 ° F); Exkursionen, die auf 15 ° C bis 30 ° C (59 ° F bis 86 ° F) zulässig sind [siehe USP -kontrollierte Raumtemperatur ] an einem trockenen Ort und vor Licht schützen.
Lamictal (lamotrigine) Tabletten For Oral Suspension
2-mg-weiße bis nicht weiße runde Tabletten mit LTG über 2 Flaschen von 30 (30 Flaschen ( NDC 0173- 0699-00). Bestellen Sie direkt bei GlaxoSmithKline 1-800-334-4153.
5 mg weiße bis nicht weiße Caplet-förmige Tabletten mit GX CL2-Flaschen von 100 (100 ( NDC 0173-0526-00).
25-mg weiße super elliptische Tabletten mit GX CL5-Flaschen von 100 (100 (100) (100) NDC 0173-0527-00).
Speichern Sie bei 25 ° C (77 ° F); Exkursionen, die auf 15 ° C bis 30 ° C (59 ° F bis 86 ° F) zulässig sind [siehe USP -kontrollierte Raumtemperatur ] an einem trockenen Ort.
Lamictal ODT (lamotrigine) Oral zerfetzen Tabletten
25-mg-weiße bis nicht weiße, runde Radius-Tabletten mit Flachgesicht mit LMT auf der einen Seite und 25 auf der anderen Wartungspaket von 30 (30 (30) (30 (30 NDC 0173-0772-02).
50 mg weiße bis nicht weiße, rund umgeschnittene Radius-Tabletten mit LMT auf einer Seite und 50 auf der anderen Wartungspaket von 30 (30 (30) (30 (30 NDC 0173-0774-02).
100 mg weiße bis nicht weiße, rund umgeschnittene Radius-Tabletten mit Lamictal auf der einen Seite und 100 auf der anderen Wartungspaket von 30 (30 (30) (30 (30 NDC 0173-0776-02).
200 mg weiße bis nicht weiße, rund umgeschnittene Radius-Tabletten mit Lamictal auf der einen Seite und 200 auf der anderen Wartungspaket von 30 (30 (30) (30 (30 (30) (30 (30) (30 (30) (30 (30) (30 (30) (30 (30) (30 (30) (30 (30) (30 (30) (30 (30) (30), ( NDC 0173-0777-02).
Speichern Sie zwischen 20 ° C und 25 ° C (68 ° F und 77 ° F); mit Ausflügen zwischen 15 ° C und 30 ° C (59 ° F und 86 ° F).
Lamictal ODT (lamotrigine) Patient Titration Kit For Patients Taking Valproat (Blue ODT Kit)
25-mg weiße bis nicht weiße, runde Radius-Tafel mit Flachgesicht, die mit LMT auf der einen Seite und 25 und 50 mg weiße bis nicht weiße, runde Flachgesicht-Radius-Tabletten mit LMT auf einer Seite und 50 auf der anderen Seite 28 Tabletten (21/25-mg-Tabletten und 7/50-mg-Tabletten) (7/50-mg-Tabletten) (7/50-mg-Tabletten) ((50-mg) (7/50-mg-Tabletten) () () ((50) (50 mg) () () () () () (50 mg Tabletten) (7/50-mg-Tabletten) () (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) (Tabletten) ()afes NDC 0173-0779-00).
Speichern Sie zwischen 20 ° C und 25 ° C (68 ° F und 77 ° F); mit Ausflügen zwischen 15 ° C und 30 ° C (59 ° F und 86 ° F).
Lamictal ODT (lamotrigine) Patient Titration Kit For Patients Taking Carbamazepin Phable Phenobarbital Or Primidone And Not Taking Valproat (Green ODT Kit)
50-mg weiße bis nicht weiße, runde Radius-Tafel mit Flachgesicht auf der einen Seite und 50 mg weiße bis nicht weiße, runde Flachgesichts-Radius-Tabletten mit Lamictal auf einer Seite und 100 MG-Tablets und 14/100-MG-Tablets). NDC 0173-0780-00).
Speichern Sie zwischen 20 ° C und 25 ° C (68 ° F und 77 ° F); mit Ausflügen zwischen 15 ° C und 30 ° C (59 ° F und 86 ° F).
Lamictal ODT (lamotrigine) Patient Titration Kit For Patients Not Taking Carbamazepin Phable Phenobarbital -Primidon Or Valproat (Orange ODT Kit)
25 mg weiße bis nicht weiße, runde Radius-Tafel mit Flachgesicht mit LMT auf der einen Seite und 25 auf der anderen 50 mg weißen bis nicht weißen runden Flachgesicht-Radius-Tabletten mit LMT auf der einen Seite und 50 auf der anderen Seite und 100 mg weiße und 100 mg weiße bis zu einem und 100 mg weißen und 100 mg weißen und 100-köpfigen, auf der einen Seite und 100-minemen und 100-auf-auf-auf-auf-auf-auf dem anderen und 100 auf der 35-Jährigen und 100 auf der Seite von 35 (mit erteilten Tisch) und auf dem anderen und 100 auf der Seite, auf dem mit einer Seite, auf der 3-marktalen, auf der anderen Seite, auf der anderen Seite, auf der 35er-Seite wurde er auf der anderen Seite mit dem anderen und 100 auf der Seite mit einer Seite, auf dem mit einer Seite, auf der 35-Jährigen, wurden auf der 35-Jährigen (100-auf-auf-. Tablets 14/50-mg-Tabletten und 7/100-mg-Tabletten) ( NDC 0173- 0778-00).
Speichern Sie zwischen 20 ° C und 25 ° C (68 ° F und 77 ° F); mit Ausflügen zwischen 15 ° C und 30 ° C (59 ° F und 86 ° F).
Blasenpackungen
Wenn das Produkt in einem Blasenpaket abgegeben wird, sollte dem Patienten empfohlen werden, das Blasenpaket vor der Verwendung zu untersuchen und nicht zu verwenden, wenn Blasen zerrissen oder fehlt.
Verteilt von: GlaxoSmithKline Durham NC 27701. Überarbeitet: Apr 2025
Nebenwirkungen for Lamictal
Die folgenden schwerwiegenden Nebenwirkungen werden in den Warnungen ausführlicher beschrieben und
Vorsichtsmaßnahmen der Kennzeichnung:
- Schwerwiegende Hautausschläge [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Hämophagozytische lymphohistiozytose [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Multiorgan -Überempfindlichkeitsreaktionen und Organversagen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Herzrhythmus und Leitungsanomalien [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Blutdyscasias [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Selbstmordverhalten und Selbstmordverhalten [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Aseptische Meningitis [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Rückzugsanfälle [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Status epilepticus [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
Clinical Trial Experience
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, die in den klinischen Studien eines Arzneimittels in den klinischen Studien eines anderen Arzneimittels nicht direkt mit den in der Praxis beobachteten Raten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels beobachtet werden.
Epilepsie
Die häufigsten Nebenwirkungen in allen klinischen Studien: Zusatztherapie bei Erwachsenen mit Epilepsie
Die am häufigsten beobachteten (≥ 5% für lamiktale und häufiger bei Medikamenten als Placebo) Nebenwirkungen, die in Verbindung mit Lamictal während der Zusatztherapie bei Erwachsenen beobachtet wurden und bei einer äquivalenten Häufigkeit bei Placebo-behandelten Patienten nicht beobachtet wurden: Schwindel-Ataxie-Säulungs-Kopfschmerzen Diplopia Blurred Vision Naulusa Vomiting und Hautausschlag. Schwindeldiplopie -Ataxie verschwommenes Sehvermögen und Erbrechen waren dosisbezogen. Schwindeldiplopieataxie und verschwommenes Sehen traten häufiger bei Patienten auf, die Carbamazepin mit Lamictal erhielten, als bei Patienten, die andere AEDs mit Lamictal erhielten. Klinische Daten deuten auf eine höhere Inzidenz von Ausschlag hin, einschließlich schwerwiegender Hautausschlag bei Patienten, die ein gleichzeitiges Valproat erhalten, als bei Patienten, die nicht Valproat erhalten [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Ungefähr 11% der 3378 erwachsenen Patienten, die als zusätzliche Therapie in der vormarkierten klinischen Studien lamiktal erhielten, stellten die Behandlung aufgrund einer unerwünschten Reaktion ab. Die nachteiligen Reaktionen, die am häufigsten mit dem Absetzen verbunden sind, waren Ausschlag (3,0%) Schwindel (2,8%) und Kopfschmerzen (2,5%).
In einer Dosis-Wirkungs-Studie bei Erwachsenen war die Abnahmerate von Lamictal für Schwindelataxie-Diplopie-Sehverübung und Erbrechen dosisbedingt.
Monotherapie in Erwachsene with Epilepsie: The most commonly observed (≥5% for Lamictal and more common on drug than placebo) adverse reactions seen in association with the use of Lamictal during the monotherapy phase of the controlled trial in adults not seen at an equivalent rate in the control group were Erbrechen coordination abnormality dyspepsia Brechreiz Schwindel rhinitis anxiety Schlaflosigkeit infection pain weight decrease chest pain and dysmenorrhea. The most commonly observed (≥5% for Lamictal and more common on drug than placebo) adverse reactions associated with the use of Lamictal during the conversion to monotherapy (add-on) period not seen at an equivalent frequency among low-dose valproate-treated patients were Schwindel Kopfschmerzen Brechreiz asthenia coordination abnormality Erbrechen Ausschlag somnolence diplopia ataxia accidental injury Tremor verschwommenes Sehen Schlaflosigkeit nystagmus Durchfall lymphadenopathy pruritus and sinusitis.
Ungefähr 10% der 420 erwachsenen Patienten, die als Monotherapie in der Vorformung klinischer Studien Lamictal erhielten, stellten die Behandlung aufgrund einer Nebenwirkung ab. Die nachteiligen Reaktionen, die am häufigsten mit dem Absetzen verbunden sind, waren Hautausschläge (4,5%) Kopfschmerzen (3,1%) und Asthenie (2,4%).
Zusatztherapie in Pädiatrische Patienten with Epilepsie: The most commonly observed (≥5% for Lamictal and more common on drug than placebo) adverse reactions seen in association with the use of Lamictal as adjunctive treatment in pediatric patients aged 2 to 16 years and not seen at an equivalent rate in the control group were infection Erbrechen Ausschlag Fieber somnolence accidental injury Schwindel Durchfall abdominal pain Brechreiz ataxia Tremor asthenia bronchitis flu syndrome and diplopia.
Bei 339 Patienten im Alter von 2 bis 16 Jahren mit teilweisen Anfällen oder verallgemeinerten Anfällen des Lennox-Gastaut-Syndroms 4,2% der Patienten auf Lamictal und 2,9% der Patienten, die auf Placebo aufgrund unerwünschter Reaktionen abgesetzt wurden. Die am häufigsten berichtete nachteilige Reaktion, die zum Absetzen von Lamictal führte, war Hautausschlag.
Ungefähr 11,5% der 1081 pädiatrischen Patienten im Alter von 2 bis 16 Jahren, die als Zusatztherapie bei vorminischen klinischen Studien eine Lamictal erhielten, ließen die Behandlung aufgrund einer Nebenwirkung ab. Die nachteiligen Reaktionen, die am häufigsten mit dem Absetzen verbunden sind, waren eine ausschließende (4,4%) Reaktion (1,7%) und Ataxie (0,6%).
Kontrollierte zusätzliche klinische Studien bei Erwachsenen mit Epilepsie: Tabelle 8 listet unerwünschte Reaktionen auf, die bei erwachsenen Patienten mit Epilepsie auftraten, die mit Lamictal in placebokontrollierten Studien behandelt wurden. In diesen Studien wurde die aktuelle AED -Therapie des Patienten entweder Lamictal oder Placebo hinzugefügt.
Tabelle 8: Nebenwirkungen in gepoolten, placebokontrollierten Zusatzstudien bei erwachsenen Patienten mit Epilepsieab
| Körpersystem/ Nebenwirkungen | Prozent der Patienten, die zusätzliche Lamictal erhalten (n = 711) | Prozent der Patienten, die zusätzliches Placebo erhalten |
| Körper als Ganzes | ||
| Kopfschmerzen | 29 | 19 |
| Grippyndrom | 7 | 6 |
| Fieber | 6 | 4 |
| Bauchschmerzen | 5 | 4 |
| Nackenschmerzen | 2 | 1 |
| Reaktion verschärft (Anfallsverluster) | 2 | 1 |
| Verdauungs | ||
| Brechreiz | 19 | 10 |
| Erbrechen | 9 | 4 |
| Durchfall | 6 | 4 |
| Dyspepsie | 5 | 2 |
| Verstopfung | 4 | 3 |
| Anorexie | 2 | 1 |
| Muskuloskelett | ||
| Arthralgie | 2 | 0 |
| Nervös | ||
| Schwindel | 38 | 13 |
| Ataxia | 22 | 6 |
| Schläfrigkeit | 14 | 7 |
| In Abstimmung | 6 | 2 |
| Schlaflosigkeit | 6 | 2 |
| Tremor | 4 | 1 |
| Depression | 4 | 3 |
| Angst | 4 | 3 |
| Konvulsion | 3 | 1 |
| Reizbarkeit | 3 | 2 |
| Sprachstörung | 3 | 0 |
| Konzentrationsstörung | 2 | 1 |
| Atemweg | ||
| Rhinitis | 14 | 9 |
| Pharyngitis | 10 | 9 |
| Husten nahm zu | 8 | 6 |
| Haut und Anhänge | ||
| Ausschlag | 10 | 5 |
| Pruritus | 3 | 2 |
| Besondere Sinne | ||
| Diplopie | 28 | 7 |
| Verschwommenes Sehen | 16 | 5 |
| Vision Abnormalität | 3 | 1 |
| Urogenital | ||
| Nur weibliche Patienten | (n = 365) | (n = 207) |
| Dysmenorrhoe | 7 | 6 |
| Vaginitis | 4 | 1 |
| Amenorrhoe | 2 | 1 |
| a Nebenwirkungen, die bei mindestens 2% der mit Lamictal behandelten Patienten und bei einer größeren Inzidenz als Placebo auftraten. B -Patienten in diesen Zusatzstudien erhielten zusätzlich zu Lamictal oder Placebo 1 bis 3 der damit begleitenden AEDs -Carbamazepin -Phenytoin -Phenobarbital oder Primidon. Patienten haben möglicherweise mehrere Nebenwirkungen während der Studie oder bei Absetzen berichtet. Daher können Patienten in mehr als 1 Kategorie aufgenommen werden. |
In einer randomisierten parallelen Studie, in der Placebo mit 300 und 500 mg/Tag Lamictal verglichen wurde, waren einige der häufigsten medikamentenbedingten unerwünschten Reaktionen mit Dosis verbunden (siehe Tabelle 9).
Tabelle 9: dosisbedingte unerwünschte Reaktionen aus einer randomisierten placebokontrollierten Zusatzstudie bei Erwachsenen mit Epilepsie
| Nebenwirkungen | Prozent der Patienten, die auftreten bei | Versreaktionen | |
| Placebo (n = 73) | Lamictal 300 mg (n = 71) | Lamictal 500 mg (n = 72) | |
| Ataxia | 10 | 10 | 28b |
| Verschwommenes Sehen | 10 | 11 | 25ab |
| Diplopie | 8 | 24a | 49ab |
| Schwindel | 27 | 31 | 54 |
| Brechreiz | 11 | 18 | 25a |
| Erbrechen | 4 | 11 | 18a |
| a Signifikant größer als Placebo -Gruppe (p)<0.05). b Signifikant größer als die Gruppe, die lamictal 300 mg erhält (p)<0.05). |
Das allgemeine unerwünschte Reaktionsprofil für Lamictal war zwischen Frauen und Männern ähnlich und war unabhängig vom Alter. Da die größte nicht kaukasische Rassenuntergruppe nur 6% der Patienten in Placebo-kontrollierten Studien Lamictal ausgesetzt war, gibt es nicht genügend Daten, um eine Erklärung zur Verteilung nachteiliger Reaktionsberichte nach Rasse zu stützen. Im Allgemeinen waren Frauen, die entweder Lamictal als zusätzliche Therapie oder Placebo erhielten, eher unerwünschte Reaktionen als Männer. Die einzige nachteilige Reaktion, für die die Berichte über Lamictal bei Frauen zu> 10% häufiger waren als Männer (ohne einen entsprechenden Unterschied nach Geschlecht im Placebo), war Schwindel (Differenz = 16,5%). Es gab kaum einen Unterschied zwischen Frauen und Männern in Bezug auf die Abnahme von Lamictal für individuelle Nebenwirkungen.
Controllierte Monotherapie-Studie bei Erwachsenen mit partiellen Anfällen: Tabelle 10 listet unerwünschte Reaktionen auf, die bei Patienten mit einer mit einer Monotherapie behandelten Patienten mit Lamictal in einer Doppelblindstudie nach Absetzen einer gleichzeitigen Carbamazepin oder Phenytoin, die nicht in der Kontrollfrequenz in der Kontrollgruppe gesehen wurden, behandelt wurden.
Tabelle 10: Nebenwirkungen in einer kontrollierten Monotherapie-Studie bei erwachsenen Patienten mit partiellen Anfällenab
| Körpersystem/ Nebenwirkungen | Prozent der Patienten, die Lamictal erhaltenc als Monotherapie (n = 43) | Prozent der Patienten, die ein niedrig dosiertes Valproat erhaltend Monotherapie (n = 44) |
| Körper als Ganzes | ||
| Schmerz | 5 | 0 |
| Infektion | 5 | 2 |
| Brustschmerzen | 5 | 2 |
| Verdauungs | ||
| Erbrechen | 9 | 0 |
| Dyspepsie | 7 | 2 |
| Brechreiz | 7 | 2 |
| Stoffwechsel und Ernährung | ||
| Gewichtsabnahme | 5 | 2 |
| Nervös | ||
| Koordinationsabnormalität | 7 | 0 |
| Schwindel | 7 | 0 |
| Angst | 5 | 0 |
| Schlaflosigkeit | 5 | 2 |
| Atemweg | ||
| Rhinitis | 7 | 2 |
| Urogenital (female patients only) | (n = 21) | (n = 28) |
| Dysmenorrhoe | 5 | 0 |
| a Nebenwirkungen, die bei mindestens 5% der mit Lamictal behandelten Patienten und bei einer größeren Inzidenz auftraten als von Valproat-behandelten Patienten. b Die Patienten in dieser Studie wurden aus der Zusatztherapie mit Carbamazepin oder Phenytoin in Lamictal- oder Valproat -Monotherapie umgewandelt. Patienten haben möglicherweise mehrere Nebenwirkungen während der Studie berichtet. Daher können Patienten in mehr als 1 Kategorie aufgenommen werden. c Bis zu 500 mg/Tag. d 1000 mg/Tag. |
Nebenwirkungen, die mit einer Häufigkeit von auftraten <5% and>2% der Patienten, die lamiktal und numerisch häufiger als Placebo erhielten als Placebo:
Körper als Ganzes: Asthenienfieber.
Verdauungs: Anorexie Trockener Mund rectal hemorrhage peptic ulcer.
Stoffwechsel und Ernährung: Peripheres Ödem.
Nervös System: Amnesieataxie -Depression Hypästhesie Libido Erhöhung verringerte Reflexe erhöhte Reflexe Nystagmus Reizbarkeit Suizidgedanke.
Atemweg: Epistaxis Bronchitis Dyspnoe.
Haut und Anhänge: Kontakt Dermatitis Trockener Hautschwitzen.
Besondere Sinne: Vision Abnormalität.
Inzidenz in kontrollierten Zusatzstudien bei pädiatrischen Patienten mit Epilepsie: Tabelle 11 listet unerwünschte Reaktionen auf, die bei 339 pädiatrischen Patienten mit partiellen Anfällen oder verallgemeinerten Anfällen des Lennox-Gastaut-Syndroms, die lamiktaler bis zu 15 mg/kg/Tag oder ein Maximum von 750 mg/Tag erhielten.
Tabelle 11: Nebenwirkungen in gepoolten, placebokontrollierten Zusatzstudien bei pädiatrischen Patienten mit Epilepsiea
| Körpersystem/ Nebenwirkungen | Prozent der Patienten, die Lamictal erhalten (n = 168) | Prozent der Patienten, die Placebo erhalten (n = 171) |
| Körper als Ganzes | ||
| Infektion | 20 | 17 |
| Fieber | 15 | 14 |
| Zufällige Verletzung | 14 | 12 |
| Bauchschmerzen | 10 | 5 |
| Asthenie | 8 | 4 |
| Grippyndrom | 7 | 6 |
| Schmerz | 5 | 4 |
| Gesichtsödem | 2 | 1 |
| Lichtempfindlichkeit | 2 | 0 |
| Herz -Kreislauf | ||
| Blutung | 2 | 1 |
| Verdauungs | ||
| Erbrechen | 20 | 16 |
| Durchfall | 11 | 9 |
| Brechreiz | 10 | 2 |
| Verstopfung | 4 | 2 |
| Dyspepsie | 2 | 1 |
| Hemisch und lymphatisch | ||
| Lymphadenopathie | 2 | 1 |
| Stoffwechsel und Ernährung | ||
| Ödem | 2 | 0 |
| Nervös system | ||
| Schläfrigkeit | 17 | 15 |
| Schwindel | 14 | 4 |
| Ataxia | 11 | 3 |
| Tremor | 10 | 1 |
| Emotionale Labilität | 4 | 2 |
| Gangstämmung | 4 | 2 |
| Anomalie denken | 3 | 2 |
| Konvulsions | 2 | 1 |
| Nervösness | 2 | 1 |
| Schwindel | 2 | 1 |
| Atemweg | ||
| Pharyngitis | 14 | 11 |
| Bronchitis | 7 | 5 |
| Erhöhter Husten | 7 | 6 |
| Sinusitis | 2 | 1 |
| Bronchospasmus | 2 | 1 |
| Haut | ||
| Ausschlag | 14 | 12 |
| Ekzem | 2 | 1 |
| Pruritus | 2 | 1 |
| Besondere Sinne | ||
| Diplopie | 5 | 1 |
| Verschwommenes Sehen | 4 | 1 |
| Visuelle Abnormalität | 2 | 0 |
| Urogenital Male and female patients | ||
| Harnwegsinfektion | 3 | 0 |
| a Nebenwirkungen, die bei mindestens 2% der mit Lamictal behandelten Patienten und bei einer größeren Inzidenz als Placebo auftraten. |
Bipolare Störung In Erwachsene
Die häufigsten nachteiligen Reaktionen, die in Verbindung mit der Verwendung von Lamictal als Monotherapie (100 bis 400 mg/Tag) bei erwachsenen Patienten (18 bis 82 Jahre) mit Lamictal beobachtet werden (im Alter von 18 bis 82 Jahren) bipolare Störung In den 2 doppeltblind-placebokontrollierten Studien mit 18 Monaten sind in Tabelle 12 enthalten. Nebenwirkungen bei mindestens 5%der Patienten waren während der Dosis-Eskalationsphase der Lamictal-Phase in diesen Studien (wenn Patienten möglicherweise mit der Monotherapie-Phase) (25%) (25%) (25%) (25%). (8%) Traumanomalie (6%) und Pruritus (6%).
Während der Monotherapiephase der doppelblinden placebokontrollierten Studien mit 18 Monaten Dauer 13% der 227 Patienten, die Lamictal (100 bis 400 mg/Tag) erhielten, 16% der 190 Patienten, die Placebo erhielten, und 23% von 166 Patienten, die eine Lithium-Lithium-Therapie wegen einer adveren Reaktion erhielten. Die unerwünschten Reaktionen, die am häufigsten zum Absetzen von Lamictal führten, waren Hautausschlag (3%) und Manie/Hypomanie/gemischte Stimmungsvergütung (2%). Ungefähr 16%von 2401 Patienten, die Lamictal (50 bis 500 mg/Tag) für bipolare Störungen bei Prämarketing -Studien erhielten, stellten die Therapie aufgrund einer negativen Reaktion am häufigsten aufgrund von Ausschlag (5%) und Manie/Hypomanie/gemischten Stimmungsvergütung (2%) ab.
Das allgemeine unerwünschte Reaktionsprofil für Lamictal war zwischen Frauen und Männern zwischen älteren und nicht älteren Patienten und zwischen Rassengruppen ähnlich.
Tabelle 12: Nebenwirkungen in 2 placebokontrollierten Studien bei erwachsenen Patienten mit bipolarer I-Störungab
| Körpersystem/ Nebenwirkungen | Prozent der Patienten, die Lamictal erhalten (n = 227) | Prozent der Patienten, die Placebo erhalten (n = 190) |
| Allgemein | ||
| Rückenschmerzen | 8 | 6 |
| Ermüdung | 8 | 5 |
| Bauchschmerzen | 6 | 3 |
| Verdauungs | ||
| Brechreiz | 14 | 11 |
| Verstopfung | 5 | 2 |
| Erbrechen | 5 | 2 |
| Nervös System | ||
| Schlaflosigkeit | 10 | 6 |
| Schläfrigkeit | 9 | 7 |
| Xerostomie (trockener Mund) | 6 | 4 |
| Atemweg | ||
| Rhinitis | 7 | 4 |
| Verschlimmerung des Hustens | 5 | 3 |
| Pharyngitis | 5 | 4 |
| Haut | ||
| Ausschlag (nonserious)c | 7 | 5 |
| a Nebenwirkungen, die bei mindestens 5% der mit Lamictal behandelten Patienten und bei einer größeren Inzidenz als Placebo auftraten. b Die Patienten in diesen Studien wurden in Lamictal (100 bis 400 mg/Tag) oder eine Placebo-Monotherapie aus der Add-On-Therapie mit anderen Psychopharmaka umgewandelt. Patienten haben möglicherweise mehrere Nebenwirkungen während der Studie berichtet. Daher können Patienten in mehr als 1 Kategorie aufgenommen werden. c In den klinischen Studien der bipolaren und anderen Stimmungsstörungen betrug die Rate schwerer Hautausschlag 0,08% (1 von 1233) von erwachsenen Patienten, die als anfängliche Monotherapie Lamictal erhielten WARNUNGS AND VORSICHTSMASSNAHMEN ]. |
Andere Reaktionen, die bei 5% oder mehr Patienten auftraten, jedoch gleich oder häufiger in der Placebo -Gruppe waren: Schwindel -Manie -Kopfschmerzinfektionsinfektion Influenza -Schmerzverletzungen Durchfall und Dyspepsie.
Nebenwirkungen, die mit einer Häufigkeit von auftraten <5% and>1% der Patienten, die lamiktal und numerisch häufiger als Placebo erhielten, waren:
Allgemein: Fieber neck pain.
Herz -Kreislauf: Migräne.
Verdauungs: Blähung.
Stoffwechsel und Ernährung: EDEMA Gewichtszunahme.
Muskuloskelett: Arthralgie myalgia.
Nervös System: Amnesie Depression Agitation emotionale Labilität Dyspraxie Abnormale Gedanken Traum Abnormalität Hypoästhesie.
Atemweg: Sinusitis.
Urogenital: Harnfrequenz.
Nebenwirkungens Following Abrupt Discontinuation
In den 2 kontrollierten klinischen Studien gab es keinen Anstieg der Schwere der Inzidenz oder der Art von Nebenwirkungen bei Patienten mit bipolarer Störung, nachdem die Therapie mit Lamictal abrupt beendet wurde. Im Programm für klinische Entwicklung bei Erwachsenen mit bipolarer Störung 2 Patienten erlebten kurz nach dem abrupten Rückzug von Lamictal [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Manie/Hypomanie/gemischte Episoden
Während der doppelblinden placebokontrollierten klinischen Studien in bipolare I -Störung, bei der Erwachsene mit Lamictal in eine Monotherapie umgewandelt wurden (100 bis 400 mg/Tag) von anderen Psychopharmaka und befolgt die Raten von bis zu 18 Monaten Manische oder hypomanische oder gemischte Stimmungs -Episoden, die als Nebenwirkungen gemeldet wurden, betrugen bei Patienten 5% behandelt mit lamictal (n = 227) 4% bei Patienten, die mit Lithium (n = 166) und 7% für Patienten behandelt wurden mit Placebo behandelte Patienten (n = 190). In allen bipolaren kontrollierten Studien kombinierten nachteiligen Reaktionen von Manie (einschließlich Hypomanie und Mischstimmungs -Episoden) wurden in 5% von berichtet Patienten, die mit Lamictal (n = 956) behandelt wurden, 3% der mit Lithium behandelten Patienten (n = 280) und 4% der mit Placebo behandelten Patienten (n = 803).
Andere nachteilige Reaktionen, die in allen klinischen Studien beobachtet wurden
Lamictal has been administered to 6694 individuals for whom complete adverse reaction data was captured during all clinical trials only some of which were placebo controlled. During these trials all adverse reactions were recorded by the clinical investigators using terminology of their own choosing. To provide a meaningful estimate of the proportion of individuals having adverse reactions similar types of adverse reactions were grouped into a smaller number of standardized categories using modified COSTART dictionary terminology. The frequencies presented represent the proportion of the 6694 individuals exposed to Lamictal who experienced an event of the type cited on at least 1 occasion while receiving Lamictal. All reported adverse reactions are included except those already listed in the previous tables or elsewhere in the labeling those too general to be informative and those not reasonably associated with the use of the drug.
Nebenwirkungen werden in den Kategorien des Körpersystems weiter klassifiziert und in der Reihenfolge der abnehmenden Häufigkeit unter Verwendung der folgenden Definitionen aufgezählt: Häufige Nebenwirkungen werden als solche definiert, die bei mindestens 1/100 Patienten auftreten; Seltene unerwünschte Reaktionen sind diejenigen, die bei 1/100 bis 1/1000 Patienten auftreten. Seltene Nebenwirkungen sind diejenigen, die bei weniger als 1/1000 Patienten auftreten.
Körper als Ganzes
Selten: Allergische Reaktionen kühfen Unwohlsein.
Herz -Kreislauf System
Selten: Spülen Hitzewallungen Hypertonie -Palpitationen Hypotonie Synkope Tachykardie Vasodilatation.
Dermatologisch
Selten: Akne Alopecia Hirsutismus makulopapuläre Hautausschlag Hautverfärbungen Urtikaria.
Selten: Angioödem Erytheme Exfoliative Dermatitis Pilz Dermatitis Herpes Zoster Leukoderma Multiforme erytheme petechiale Ausschlag Pustular Rash Stevens-Johnson-Syndrom vesikulobulöser Ausschlag.
Verdauungs System
Selten: Dysphagie -Euctation Gastritis Gingivitis erhöhte Appetit erhöhte Speichelungsleberfunktionstests abnormaler Mundgeschwüre.
Selten: Gastrointestinale Blutung Glossitis Gummi Blutung Zahnfleisch Hyperplasie Hämatemese Hämorrhagische Kolitis Hepatitis Melena Magen Ulkus -Stomatitis Zungenödem.
Endokrines System
Selten: Kropfhypothyreose.
Hämatologisches und lymphatisches System
Selten: Ecchymose Leukopenie.
Selten: Anämie Eosinophilie Fibrin -Verringerung der Fibrinogen -Verringerung von Eisenmangelanämie -Leukozytose -Lymphozytose Makrozytische Anämie Petechia Thrombozytopenie.
Stoffwechsel- und Ernährungsstörungen
Selten: Aspartattransaminase nahm zu.
Selten: Alkoholtoleranzalkalische Phosphatase erhöhen Alanintransaminase Erhöhung der Bilirubinämie Allgemeine Ödeme -Gamma -Glutamyltranspeptidase Erhöhen Sie die Hyperglykämie.
Muskuloskelett System
Selten: Arthritis Bein Krämpfe Myasthenia zuckt.
Selten: Bursitis -Muskelatrophie pathologische Fraktur -Tendernverträge.
Nervös System
Häufig: Verwirrung Parästhesie.
Selten: Akathisia Apathy Aphasie Zentralnervensystem Depression Depersonalisierung Dysarthrie Dyskinesie Euphorie Halluzinationen Feindseligkeit Hyperkinesie Hypertonia Libido verringerte das Gedächtnis verringern die Myoklonus -Panikangriff von Myoklonus -Angriffe paranoide Persönlichkeit, Psychose Psychose Psychose Psychose Psychose -Störungsstörungen Susicidal Ideal Idee.
Selten: Choreoathetose Delirium -Wahnvorstellungen Dysphorie Dystonie Extrapyramiden -Syndrom Ohnmacht Grand Mal Krampf Hemiplegie Hyperalgesie Hyperästhesie Hypokinesie Hypotonie Manische Depression Reaktion Muskeln Spasmus Neuralgia Neurose -Paralyse peripherer Neuritis.
Atemweg System
Selten: Gähnen.
Selten: Schluckauf -Hyperventilation.
Besondere Sinne
Häufig: Amblyopie.
Selten: Abnormalität der Unterbringung Konjunktivitis trockene Augen Ohrschmerzen Photophobie Geschmack Perversion Tinnitus.
Selten: Taubheitstörungsstörung Oszillopsie Parosmie Ptosis Strabismus Geschmack Verlust Uveitis -Felddefekt.
Urogenital System
Selten: Abnormale Ejakulationshämaturie Impotenz Menorrhagie -Polyurie -Harninkontinenz.
Selten: Akute Nierenversagen Anorgasmia Brust Abszess Brust Neoplasma Kreatinin Erhöhung Zystitis Dysurie Epididymitis Frauen Laktation Nierenversagen Nierenschmerzen Nocturia Harnretention Harnurinz.
Nebenwirkungen von Trissprintsc -Geburtenkontrolle
Nachmarkterfahrung
Die folgenden nachteiligen Reaktionen wurden während der Verwendung von Lamictal nach der Anbetung identifiziert. Da diese Reaktionen freiwillig aus einer Population unsicherer Größe berichtet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder ein kausales Verhältnis zur Arzneimittelexposition herzustellen.
Blut und Lymph
Agranulozytose Hämolytische Anämie -Lymphadenopathie nicht mit einer Überempfindlichkeitsstörung Pseudolymphom assoziiert.
Magen -Darm
Speiseröhre.
Lebertrakt und Bauchspeicheldrüse
Pankreatitis.
Immunologisch
Hypogammaglobulinämie lupus -ähnliche Reaktionsvaskulitis.
Untere Atemwege
Apnoe.
Muskuloskelett
Rhabdomyolyse wurde bei Patienten mit Überempfindlichkeitsreaktionen beobachtet.
Nervös System
Aggressionserbation der Parkinson-Symptome bei Patienten mit bereits bestehenden Parkinson-Krankheiten.
Nicht-Site-spezifischer
Progressive Immunsuppression.
Nieren- und Harnstörungen
Tubulointerstitielle Nephritis (wurde allein und in Verbindung mit Uveitis gemeldet).
Wechselwirkungen mit Arzneimitteln for Lamictal
In diesem Abschnitt werden signifikante Wechselwirkungen zwischen Arzneimitteln mit Lamictal zusammengefasst.
Uridin 5´-Diphospho-Glucuronyltransferasen (UGT) wurden als Enzyme identifiziert, die für den Stoffwechsel von Lamotrigin verantwortlich sind. Medikamente, die die Glucuronidierung induzieren oder hemmen, können daher die scheinbare Clearance von Lamotrigin beeinflussen. Starke oder mäßige Induktoren des Cytochrom -P450 3A4 (CYP3A4) -Enzyms, von denen auch bekannt ist, dass sie UGT induzieren, können auch den Metabolismus von Lamotrigin verbessern.
Diejenigen Medikamente, bei denen nachgewiesen wurde, dass sie einen klinisch signifikanten Einfluss auf den Lamotrigin -Metabolismus haben Dosierung und Verwaltung WARNUNGS AND VORSICHTSMASSNAHMEN ].
Weitere Details dieser Arzneimittelwechselwirkungsstudien finden Sie im Abschnitt Clinical Pharmacology [siehe Klinische Pharmakologie ].
Tabelle 13: etablierte und andere potenziell signifikante Arzneimittelwechselwirkungen
| Beglaubigungsdroge | Auswirkung auf die Konzentration von Lamotrigin oder zu einem gleichzeitigen Arzneimittel | Clinical Comment |
| Östrogenhaltige orale Kontrazeptive-Präparate mit 30 mcg Ethinylestradiol und 150 mcg Levonorgestrel | ↓ Lamotrigin | Verringerte Lamotriginkonzentrationen ungefähr 50%. |
| ↓ Levonorgestrel | Abnahme der Levonorgestrel -Komponente um 19%. | |
| Carbamazepin- und Carbamazepin -Epoxid | ↓ Lamotrigin | Die Zugabe von Carbamazepin verringert die Lamotriginkonzentration um ungefähr 40%. |
| ? Carbamazepin -Epoxid | Kann den Carbamazepin -Epoxidspiegel erhöhen. | |
| Lopinavir/Ritonavir | ↓ Lamotrigin | Verringerte Lamotriginkonzentration ca. 50%. |
| Atazanavir/Ritonavir | ↓ Lamotrigin | Verringerte Lamotrigin AUC ca. 32%. |
| Phenobarbital/ Primidon | ↓ Lamotrigin | Verringerte Lamotriginkonzentration ungefähr 40%. |
| Phable | ↓ Lamotrigin | Verringerte Lamotriginkonzentration ungefähr 40%. |
| Rifampin | ↓ Lamotrigin | Verringerte Lamotrigin AUC ca. 40%. |
| Valproat | ↑ Lamotrigin | Erhöhte Lamotrigin-Konzentrationen etwas mehr als 2-fach. |
| ? Valproat | Es gibt widersprüchliche Studienergebnisse bezüglich der Wirkung von Lamotrigin auf Valproat -Konzentrationen: 1) Eine durchschnittliche Abnahme der Valproat -Konzentrationen in gesunden Freiwilligen 2) keine Änderung der Valproat -Konzentrationen in kontrollierten klinischen Studien bei Patienten mit Epilepsie. | |
| ↓ = verringert (induziert Lamotrigin -Glucuronidation). ↑ = erhöht (hemmt die Lamotrigin -Glucuronidation). ? = Widersprüchliche Daten. |
Wirkung von Lamictal auf den organischen kationischen Transporter 2 Substraten
Lamotrigin ist ein Inhibitor der Nierenrohrsekretion über organische kationische Transporter 2 (OCT2) -Proteine [siehe Klinische Pharmakologie ]. This may result in increased plasma levels of certain drugs that are substantially excreted via this route. Coadministration of Lamictal with OCT2 substrates with a narrow therapeutic index (e.g. dofetilide) is not recommended.
Warnungen für Lamictal
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Abschnitt.
Vorsichtsmaßnahmen für Lamictal
Schwerwiegende Hautausschläge [siehe WARNUNG BOXED ]
Kinderbevölkerung
Die Inzidenz von schwerem Hautausschlag im Zusammenhang mit dem Krankenhausaufenthalt und der Abnahme von Lamictal in einer prospektiv gefolgten Kohorte von pädiatrischen Patienten (2 bis 17 Jahre) beträgt ungefähr 0,3% bis 0,8%. In einer prospektiv verfolgten Kohorte von pädiatrischen Patienten von 1983 (2 bis 16 Jahre) wurde ein Todesstrafe im Zusammenhang mit Ausschlag gemeldet, wobei die Epilepsie als Zusatztherapie Lamictal betraf. Zusätzlich gab es seltene Fälle von toxischer epidermaler Nekrolyse mit und ohne dauerhafte Folgen und/oder Tod in den Bereichen Ausland nach dem Stempeln.
Es gibt Hinweise darauf, dass die Einbeziehung von Valproat in ein Multidrug-Regime das Risiko einer schwerwiegenden potenziell lebensbedrohlichen Hautausschlag bei pädiatrischen Patienten erhöht. Bei pädiatrischen Patienten, die Valproat gleichzeitig für Epilepsie verwendeten, hatten 1,2% (6 von 482) einen schweren Ausschlag im Vergleich zu 0,6% (6 von 952) Patienten, die nicht Valproat einnahmen.
Erwachsene Bevölkerung
Ein schwerwiegender Ausschlag im Zusammenhang mit dem Krankenhausaufenthalt und der Abnahme von Lamictal trat bei 0,3% (11 von 3348) von erwachsenen Patienten auf, die Lamictal in prächtigen klinischen Studien zur Epilepsie erhielten. In den klinischen Studien bipolarer und anderer Stimmungsstörungen betrug die Rate eines schwerwiegenden Ausschlags 0,08% (1 von 1233) von erwachsenen Patienten, die als anfängliche Monotherapie Lamictal erhielten, und 0,13% (2 von 1538) von erwachsenen Patienten, die als Zusatztherapie eine Lamiktal -Therapie erhielten. Bei diesen Individuen traten keine Todesfälle auf. In der weltweiten Nachkriege nach dem Stempeln wurden jedoch seltene Fälle mit dem Ausschlag im Zusammenhang mit Hautausschlag gemeldet, aber ihre Zahlen sind zu wenig, um eine genaue Schätzung der Rate zu ermöglichen.
Unter den Hautausschlägen, die zum Krankenhausaufenthalt führten, gehörten das Stevens-Johnson-Syndrom Toxic Epidermal Necrolyse Angioödeme und diejenigen, die mit einer Multiorgan-Überempfindlichkeit assoziiert waren [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Es gibt Hinweise darauf, dass die Einbeziehung von Valproat in ein Multidrug-Regime das Risiko einer schwerwiegenden potenziell lebensbedrohlichen Hautausschlag bei Erwachsenen erhöht. Insbesondere von 584 Patienten, die Lamictal in Epilepsie -klinischen Studien mit Valproat verabreicht wurden, wurden 6 (1%) in Verbindung mit Ausschlag ins Krankenhaus eingeliefert; Im Gegensatz dazu wurden 4 (0,16%) von 2398 klinischen Studienpatienten und Freiwilligen, die in Abwesenheit von Valproat Lamictal verabreichten, ins Krankenhaus eingeliefert.
Patienten mit Allergie oder Hautausschlag gegen andere Antiepileptika
Das Risiko eines unsichereren Ausschlags kann erhöht werden, wenn die empfohlene anfängliche Dosis und/oder die Dosis -Eskalationsrate für Lamictal überschritten wird, und bei Patienten mit Allergie oder Ausschlag gegen andere AEDs.
Hämophagozytische lymphohistiozytose
Bei pädiatrischen und erwachsenen Patienten trat eine hämophagozytische lymphohistiozytose (HLH) auf, die für verschiedene Indikationen Lamictal einnehmen. HLH ist ein lebensbedrohliches Syndrom der pathologischen Immunaktivierung, das durch klinische Anzeichen und Symptome einer extremen systemischen Entzündung gekennzeichnet ist. Es ist mit hohen Sterblichkeitsraten verbunden, wenn sie nicht früh erkannt und behandelt wird. Zu den häufigen Befunden gehören Fever Hepatosplenomegalie -Ausschlag Lymphadenopathie Neurologische Symptome Zytopenien Hochserumferritin Hypertriglyceridämie und Leberfunktion und Koagulationsanomalien. In Fällen von HLH, die mit lamiktalen Patienten gemeldet wurden, haben Anzeichen einer systemischen Entzündung (Fever Rash Hepatosplenomegalie und Organsystemfunktionsstörung) und Blutdyscasias. Es wurde berichtet, dass die Symptome innerhalb von 8 bis 24 Tagen nach Beginn der Behandlung auftreten. Patienten, die frühe Manifestationen der pathologischen Immunaktivierung entwickeln, sollten sofort bewertet werden und eine Diagnose von HLH in Betracht gezogen werden. Lamictal sollte abgesetzt werden, wenn eine alternative Ätiologie für die Anzeichen oder Symptome nicht festgelegt werden kann.
Multiorgan -Überempfindlichkeitsreaktionen und Organversagen
Multiorgan -Überempfindlichkeitsreaktionen, die auch als Arzneimittelreaktion mit Eosinophilie bezeichnet werden, und systemische Symptome (Kleidung) sind mit Lamictal aufgetreten. Einige waren tödlich oder lebensbedrohlich. Kleider ist typischerweise, obwohl nicht ausschließlich Fieberausschlag und/oder Lymphadenopathie in Verbindung mit anderer Organsystem -Beteiligung wie Hepatitis -Nephritis Hämatologische Anomalien Myokarditis oder Myositis, die manchmal einer akuten viralen Infektion ähnelt. Eosinophilie ist oft vorhanden. Diese Störung ist in ihrem Ausdruck variabel, und andere hier nicht festgestellte Organsysteme sind möglicherweise beteiligt.
Bei 2 von 3796 erwachsenen Patienten und 4 von 2435 pädiatrischen Patienten, die in epilepsien klinischen Studien Lamictal erhielten, wurden Todesfälle im Zusammenhang mit einem akuten Multiorganversagen und verschiedenen Graden an Leberversagen berichtet. Seltene Todesfälle durch Multiorgan -Versagen wurden auch bei der Verwendung nach dem Stempeln gemeldet.
Isoliertes Leberversagen ohne Ausschlag oder Beteiligung anderer Organe wurde ebenfalls mit Lamictal gemeldet.
Es ist wichtig zu beachten, dass frühe Manifestationen der Überempfindlichkeit (z. B. Fieberlymphadenopathie) vorhanden sein können, obwohl ein Ausschlag nicht offensichtlich ist. Wenn solche Anzeichen oder Symptome vorliegen, sollte der Patient sofort bewertet werden. Lamictal sollte abgesetzt werden, wenn eine alternative Ätiologie für die Anzeichen oder Symptome nicht festgelegt werden kann.
Vor Beginn der Behandlung mit Lamictal sollte der Patient angewiesen werden, dass ein Hautausschlag oder andere Anzeichen oder Symptome einer Überempfindlichkeit (z. B. Fieber -Lymphadenopathie) ein schwerwiegendes medizinisches Ereignis einladen können und dass der Patient ein solches Auftreten eines Anbieters eines Gesundheitsdienstleisters sofort melden sollte.
Herzrhythmus und Leitungsstörungen
In -vitro -Tests zeigten, dass Lamictal die antiarrhythmische Aktivität der Klasse IB in therapeutisch relevanten Konzentrationen aufweist [siehe Klinische Pharmakologie ]. Based on these in vitro findings Lamictal could slow ventricular conduction (widen QRS) and induce proarrhythmia which can lead to sudden death in patients with clinically important structural or functional heart disease (i.e. patients with heart failure valvular heart disease congenital heart disease conduction system disease ventricular arrhythmias cardiac channelopathies [e.g. Brugada syndrome] clinically important ischemic heart disease or multiple risk factors for coronary artery disease). Any expected or observed benefit of Lamictal in an individual patient with clinically important structural or functional heart disease must be carefully weighed against the risks for serious arrythmias and/or death for that patient. Concomitant use of other sodium channel blockers may further increase the risk of proarrhythmia.
Blutdyscasias
Es gab Berichte über Blutdyscrasien, die mit einer Multiorgan -Überempfindlichkeit (auch als Kleid bekannt) in Verbindung gebracht werden können oder nicht [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]. These have included neutropenia leukopenia anemia thrombocytopenia pancytopenia and rarely aplastic anemia and pure red cell aplasia.
Selbstmordverhalten und Vorstellung
Antiepileptika, einschließlich lamiktaler, erhöhen das Risiko von Selbstmordgedanken oder Verhalten bei Patienten, die diese Medikamente für jegliche Indikation einnehmen. Patienten, die mit AED für eine Indikation behandelt werden, sollten auf Entstehung oder Verschlechterung von Selbstmordgedanken oder Verhalten und/oder ungewöhnlichen Veränderungen in der Stimmung oder des Verhaltens überwacht werden.
Poolierte Analysen von 199 placebokontrollierten klinischen Studien (Monotherapie und Zusatztherapie) von 11 verschiedenen AEDs zeigten, dass Patienten, die zu 1 der AEDs randomisiert wurden, ungefähr das doppelte Risiko aufwiesen (angepasstes relatives Risiko 1,8 95% CI: 1,2 2,7) des Selbstmorddenkens oder Verhaltens im Vergleich zu Patienten im Vergleich zu Patienten, die auf Placebo randomisiert wurden. In diesen Studien, die eine mediane Behandlungsdauer von 12 Wochen hatten, betrug die geschätzte Inzidenz von Suizidverhalten oder Ideen von 27863 AED-behandelten Patienten 0,43%, verglichen mit 0,24% bei 16029 mit Placebo behandelten Patienten mit einer Erhöhung eines Anstiegs von ungefähr 1 Fall von Suiziddenken oder Verhalten für alle behandelten Patienten. In den Studien gab es 4 Selbstmorde bei medikamenten behandelten Patienten, und keiner bei mit Placebo behandelten Patienten ist die Anzahl der Ereignisse zu klein, um eine Schlussfolgerung über die Wirksamkeit des Arzneimittels auf Selbstmord zu ermöglichen.
Das erhöhte Risiko für Selbstmordgedanken oder -verhalten mit AEDs wurde bereits 1 Woche nach Beginn der Behandlung mit AEDs beobachtet und für die Dauer der Bewertung der Behandlungsdauer bestehen. Da die meisten in die Analyse einbezogenen Studien nicht über 24 Wochen erstreckten, konnte das Risiko von Selbstmordgedanken oder Verhalten über 24 Wochen nicht bewertet werden.
Das Risiko von Selbstmordgedanken oder Verhaltensweisen war in den analysierten Daten im Allgemeinen konsistent. Die Feststellung eines erhöhten Risikos mit AEDs mit unterschiedlichem Wirkmechanismus und über eine Reihe von Indikationen legt nahe, dass das Risiko für alle AEDs gilt, die für jede Indikation verwendet werden. Das Risiko variierte in den analysierten klinischen Studien nicht wesentlich nach Alter (5 bis 100 Jahre).
Tabelle 7 zeigt ein absolutes und relatives Risiko durch Indikation für alle bewerteten AEDs.
Tabelle 7: Risiko durch Indikation für Antiepileptika in der gepoolten Analyse
| Anzeige | Placebo Patients with Events per 1000 Patients | Drogenpatienten mit Ereignissen pro 1000 Patienten | Relatives Risiko: Inzidenz von Ereignissen bei Drogenpatienten/ Inzidenz bei Placebo -Patienten | Risikounterschied: Zusätzliche Drogenpatienten mit Ereignissen pro 1000 Patienten |
| Epilepsie | 1.0 | 3.4 | 3.5 | 2.4 |
| Psychiatrisch | 5.7 | 8.5 | 1.5 | 2.9 |
| Andere | 1.0 | 1.8 | 1.9 | 0.9 |
| Gesamt | 2.4 | 4.3 | 1.8 | 1.9 |
Das relative Risiko für Selbstmordgedanken oder Verhalten war in klinischen Studien zur Epilepsie höher als in klinischen Studien für psychiatrische oder andere Erkrankungen, aber die absoluten Risikounterschiede waren für die Epilepsie- und psychiatrischen Indikationen ähnlich.
Jeder, der über die Verschreibung von Lamictal oder einem anderen AED in Betracht gezogen wird, muss das Risiko von Selbstmordgedanken oder Verhalten mit dem Risiko einer unbehandelten Krankheit in Einklang bringen. Epilepsie und viele andere Krankheiten, für die AEDs verschrieben werden, sind selbst mit Morbidität und Mortalität und einem erhöhten Risiko für Selbstmordgedanken und Verhalten verbunden. Sollten während der Behandlung Selbstmordgedanken und Verhalten auftreten, muss der Prescriber prüfen, ob das Auftreten dieser Symptome bei einem bestimmten Patienten mit der Behandlung der Krankheit zusammenhängt.
Patienten, die ihre Pflegekräfte und Familien betreuen, sollten darüber informiert werden, dass AEDs das Risiko von Selbstmordgedanken und Verhaltensweisen erhöhen, und sollten über die Notwendigkeit informiert werden, auf die Entstehung oder Verschlechterung der Anzeichen und Symptome einer Depression auf ungewöhnliche Stimmungsänderungen oder Verhaltensänderungen zu wachsam sein. Verhaltensweisen von Besorgnis sollten sofort an Gesundheitsdienstleister gemeldet werden.
Aseptische Meningitis
Die Therapie mit lamiktalem Erhöhung des Risikos einer aseptischen Meningitis. Aufgrund des Potenzials für schwerwiegende Ergebnisse einer unbehandelten Meningitis aufgrund anderer Ursachen sollten Patienten auch auf andere Ursachen für Meningitis bewertet und gegebenenfalls behandelt werden.
Nach dem Stempel von aseptischen Meningitis wurde bei pädiatrischen und erwachsenen Patienten berichtet, die für verschiedene Indikationen Lamictal einnehmen. Zu den Symptomen bei der Präsentation gehörten Kopfschmerzfieber Übelkeit Erbrechen und Nacke -Steifigkeit. Ausschlag Photophobie Myalgie Chills veränderte das Bewusstsein und die Schläfrigkeit auch in einigen Fällen. Es wurde berichtet, dass die Symptome innerhalb von 1 Tag bis eineinhalb Monaten nach Beginn der Behandlung auftreten. In den meisten Fällen wurde berichtet, dass sich Symptome nach Absetzen von Lamictal lösen. Die Wiederbelichtung führte zu einer schnellen Rückkehr von Symptomen (von innerhalb von 30 Minuten bis 1 Tag nach Wiedereinstellung der Behandlung), die häufig schwerwiegender waren. Einige der mit Lamictal behandelten Patienten, die eine aseptische Meningitis entwickelten, hatten zugrunde liegende Diagnosen systemischer Lupus erythematodes oder andere Autoimmunerkrankungen.
Cerebrospinalflüssigkeit (CSF), die zum Zeitpunkt der klinischen Darstellung analysiert wurde, wurde in den berichteten Fällen durch einen leichten bis mittelschweren Pleozytose -normalen Glukosespiegel und einen leichten bis mittelschweren Protein ansteigt. Die Anzahl der CSF -Anzahl der weißen Blutkörperchen zeigte in einem Großteil der Fälle eine Dominanz von Neutrophilen, obwohl in ungefähr einem Drittel der Fälle über eine Dominanz von Lymphozyten berichtet wurde. Einige Patienten hatten auch neue Anzeichen und Symptome einer Beteiligung anderer Organe (überwiegend Leber- und Nierenbeteiligung), was darauf hindeuten kann, dass in diesen Fällen die beobachtete aseptische Meningitis Teil einer Überempfindlichkeitsreaktion war [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Potenzielle Medikamentenfehler
Medikamentenfehler mit Lamictal sind aufgetreten. Insbesondere die Namen Lamictal oder Lamotrigin können mit den Namen anderer häufig verwendeter Medikamente verwechselt werden. Medikamentenfehler können auch zwischen den verschiedenen Lamictal -Formulierungen auftreten. Um das Potenzial von Medikamentenfehlern zu verringern, schreiben und sagen Lamictal klar. Darstellungen der Lamictal -Tabletten -Tabletten für die orale Suspension und die oral zersetzenden Tabletten finden Sie im Medikamentenführer, der das Produkt begleitet, um die charakteristischen Markierfarben und -formen hervorzuheben, die dazu dienen, die unterschiedlichen Präsentationen des Arzneimittels zu identifizieren, und möglicherweise dazu beitragen, das Risiko von Medikationsfehlern zu verringern. Um den Medikationsfehler bei der Verwendung des falschen Arzneimittels oder der Formulierung zu vermeiden, sollten Patienten stark empfohlen werden, ihre Tabletten visuell zu überprüfen, um zu überprüfen, ob sie bei jedem Füllen ihres Rezepts lamiktal und die korrekte Formulierung von Lamictal sind.
Gleichzeitige Verwendung mit östrogenhaltigen Produkten einschließlich oraler Kontrazeptiva
Es wurde gezeigt Klinische Pharmakologie ]. Dosierung adjustments will be necessary in most patients who start or stop estrogen-containing oral contraceptives while taking Lamictal [sehen Dosierung und Verwaltung ]. During the week of inactive hormone preparation (pill-free week) of oral contraceptive therapy plasma lamotrigine levels are expected to rise as much as doubling at the end of the week. Adverse reactions consistent with elevated levels of lamotrigine such as Schwindel ataxia and diplopia could occur. Andere oral contraceptive and other estrogen-containing therapies (such as HRT ) have not been studied though they may similarly affect lamotrigine pharmacokinetic parameters.
Rückzugsanfälle
Wie bei anderen AEDs sollte Lamictal nicht abrupt abgebrochen werden. Bei Patienten mit Epilepsie besteht die Möglichkeit einer zunehmenden Anfallsfrequenz. In klinischen Studien bei Erwachsenen mit bipolarer Erkrankung 2 erlebten 2 Patienten kurz nach dem abrupten Rückzug von Lamictal. Es sei denn, Sicherheitsbedenken erfordern einen schnelleren Rückzug Die Dosis von Lamictal sollte über einen Zeitraum von mindestens 2 Wochen verjüngt werden (ca. 50% Reduktion pro Woche) [siehe Dosierung und Verwaltung ].
Status epilepticus
Gültige Schätzungen der Inzidenz von Behandlung mit Behandlungsstatus bei Patienten, die mit Lamictal behandelt wurden, sind schwer zu erhalten, da Reporter, die an klinischen Studien teilnahmen, nicht alle identische Regeln für die Identifizierung von Fällen verwendet haben. Mindestens 7 von 2343 erwachsenen Patienten hatten Episoden, die eindeutig als Status epilepticus beschrieben werden konnten. Zusätzlich wurden eine Reihe von Berichten über variabel definierte Episoden der Anfallsverlängerung (z. B. Anfälle von Anfällen anfällige Überflüsse) gemacht.
Zugabe von Lamictal zu einem Multidrug -Regime, das Valproat beinhaltet
Da Valproat die Clearance von Lamotrigin die Dosierung von Lamictal in Gegenwart von Valproat verringert Dosierung und Verwaltung Wechselwirkungen mit Arzneimitteln ].
Bindung im Auge und anderen melaninhaltigen Geweben
Da Lamotrigin an Melanin bindet, könnte es sich im Laufe der Zeit in melaninreichen Geweben ansammeln. Dies erhöht die Möglichkeit, dass Lamotrigin in diesen Geweben nach längerem Gebrauch Toxizität verursachen kann. Obwohl ophthalmologische Tests in einer kontrollierten klinischen Studie durchgeführt wurden, war die Tests nicht ausreichend, um subtile Effekte oder Verletzungen auszuschließen, die nach Langzeitexposition auftraten. Darüber hinaus ist die Kapazität verfügbarer Tests, um potenziell nachteilige Folgen zu erkennen, wenn eine der Lamotrigin -Bindung an Melanin unbekannt ist [siehe Klinische Pharmakologie ].
Obwohl es keine spezifischen Empfehlungen für periodische ophthalmologische Überwachungsverschreibungen gibt, sollten sich die Möglichkeiten der Möglichkeit einer langfristigen ophthalmologischen Wirkung bewusst sein.
Labortests
Falschpositive Drogentestergebnisse
Es wurde berichtet, dass Lamotrigin den Assay in einigen schnellen Urin-Arzneimittel-Screensen beeinträchtigt, was zu falsch positiven Messungen insbesondere für Phencyclidin (PCP) führen kann. Eine spezifischere analytische Methode sollte verwendet werden, um ein positives Ergebnis zu bestätigen.
Plasmakonzentrationen von Lamotrigin
Der Wert der Überwachung der Plasmakonzentrationen von Lamotrigin bei Patienten, die mit Lamictal behandelt wurden, wurde nicht festgestellt. Aufgrund der möglichen pharmakokinetischen Wechselwirkungen zwischen Lamotrigin und anderen Arzneimitteln, einschließlich AEDs (siehe Tabelle 13), können insbesondere während der Dosierungsanpassungen insbesondere während der Dosierungsanpassungen angezeigt werden. Im Allgemeinen sollte die klinische Beurteilung bezüglich der Überwachung der Plasmaspiegel von Lamotrigin und anderen Arzneimitteln und der Frage, ob Dosierungsanpassungen erforderlich sind oder nicht, ausgeübt werden.
Patientenberatungsinformationen
Raten Sie dem Patienten, die von der FDA zugelassene Patientenkennzeichnung zu lesen ( Medikamentenhandbuch ).
Ausschlag
Vor Beginn der Behandlung mit lamictalem Patienten, dass ein Hautausschlag oder andere Anzeichen oder Symptome der Überempfindlichkeit (z. B. Fieber -Lymphadenopathie) ein schwerwiegendes medizinisches Ereignis einläuten und sie anweisen können, ihren Gesundheitsdienstleistern ein solches Ereignis sofort zu berichten.
Hämophagozytische lymphohistiozytose
Vor Beginn der Behandlung mit lamictaler Patienten, dass eine übermäßige Immunaktivierung bei Lamictal auftreten kann und dass sie Anzeichen oder Symptome wie Fieberausschlag oder Lymphadenopathie an einem Gesundheitsdienstleister sofort melden sollten.
Multiorgan -Überempfindlichkeitsreaktionen Blutdykrasien und Organversagen
Informieren Sie Patienten, dass Multiorgan -Überempfindlichkeitsreaktionen und ein akutes Multiorganversagen bei Lamictal auftreten können. Es kann auch ein isoliertes Organversagen oder isolierte Blutkrasien ohne Anzeichen einer Multiorgan -Überempfindlichkeit auftreten. Weisen Sie die Patienten an, ihre Gesundheitsdienstleister sofort zu kontaktieren, wenn sie Anzeichen oder Symptome dieser Erkrankungen haben [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Herzrhythmus und Leitungsstörungen
Informieren Sie die Patienten, dass Lamictal aufgrund seines Wirkungsmechanismus zu unregelmäßigem oder verlangsamtem Herzrhythmus führen könnte. Dieses Risiko ist bei Patienten mit zugrunde liegenden Herzerkrankungen oder Herzleitungsproblemen erhöht oder die andere Medikamente einnehmen, die sich auf die Herzleitung auswirken. Die Patienten sollten sofort auf Herzzeichen oder Symptome des Gesundheitsdienstleisters aufmerksam gemacht werden und berichten. Patienten, die Synkope entwickeln, sollten sich mit erhöhten Beinen hinlegen und sich an ihren Gesundheitsdienstleister wenden [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Selbstmorddenken und Verhalten
Informieren Sie den Patienten ihre Betreuer und Familien darüber, dass AEDs einschließlich Lamictal das Risiko von Selbstmordgedanken und Verhalten erhöhen können. Weisen Sie sie an, auf die Entstehung oder Verschlechterung von Depressionssymptomen auf ungewöhnliche Veränderungen in der Stimmung oder des Verhaltens oder der Entstehung von Selbstmordgedanken oder Verhalten oder Gedanken über Selbstverletzung aufmerksam zu machen. Weisen Sie sie an, ihren Gesundheitsdienstleistern sofort Verhaltensweisen zu melden.
Verschlechterung von Anfällen
Weisen Sie die Patienten an, ihre Gesundheitsdienstleister zu benachrichtigen, wenn sich die Beschlagnahmungskontrolle verschlechtert.
Nebenwirkungen des Zentralnervensystems
Informieren Sie die Patienten, dass Lamictal Schwindel -Schläfrigkeit und andere Symptome und Anzeichen einer Depression des Zentralnervensystems verursachen kann. Weisen Sie sie dementsprechend weder an, ein Auto zu fahren noch andere komplexe Maschinen zu betreiben, bis sie ausreichend Erfahrung auf Lamictal gesammelt haben, um zu beurteilen, ob sie ihre geistige und/oder motorische Leistung nachteilig beeinflusst oder nicht.
Schwangerschaft und Krankenpflege
Weisen Sie die Patienten an, ihre Gesundheitsdienstleister zu benachrichtigen, wenn sie schwanger werden oder beabsichtigen, während der Therapie schwanger zu werden, und wenn sie stillen möchten oder ein Kind stillen.
Ermutigen Sie die Patienten, sich in das NAAED -Schwangerschaftsregister einzuschreiben, wenn sie schwanger werden. Dieses Register sammelt Informationen über die Sicherheit von AEDs während der Schwangerschaft. Um Patienten einzuschreiben, können die gebührenfreie Nummer 1-888-233-2334 aufrufen [siehe Verwendung in bestimmten Populationen ].
Informieren Sie Patienten, die zu stillen wollen, dass Lamictal in der Muttermilch vorhanden ist, und raten Sie ihnen, ihr Kind auf mögliche nachteilige Auswirkungen dieses Arzneimittels zu überwachen. Besprechen Sie die Vorteile und Risiken des fortgesetzten Stillens.
Verwendung von östrogenhaltigen Produkten einschließlich oraler Kontrazeptiva
Weisen Sie Frauen an, ihre Gesundheitsdienstleister zu benachrichtigen, wenn sie planen, orale Kontrazeptiva oder andere weibliche hormonelle Präparate (einschließlich HRT) zu beginnen oder zu stoppen. Das Starten von Östregencontaining-Produkten einschließlich oraler Kontrazeptiva kann den Lamotrigin-Plasmaspiegel signifikant verringern und die östrogenhaltigen oralen Kontrazeptiva (einschließlich des Pillen-Freeweek) verhindern WARNUNGS AND VORSICHTSMASSNAHMEN Klinische Pharmakologie ]. Also instruct women to promptly notify their healthcare providers if they experience adverse reactions or changes in menstrual pattern (e.g. breakthrough bleeding) while receiving Lamictal in combination with these medications.
Lamictal einstellen
Weisen Sie die Patienten an, ihre Gesundheitsdienstleister zu benachrichtigen, wenn sie aus irgendeinem Grund aufhören, Lamictal zu nehmen, und nicht Lamictal wieder aufzunehmen, ohne ihre Gesundheitsdienstleister zu konsultieren.
Aseptische Meningitis
Informieren Sie Patienten, dass Lamictal eine aseptische Meningitis verursachen kann. Weisen Sie sie an, ihre Gesundheitsdienstleister sofort zu benachrichtigen, wenn sie Anzeichen und Symptome einer Meningitis entwickeln, wie z. B. Kopfschmerzfieber Übelkeit Übelkeit, erbricht steifem Halsausschlag abnormaler Empfindlichkeit gegenüber leichten Myalgie Chills Verwirrung oder Schläfrigkeit, während er Lamictal einnimmt.
Potenzielle Medikamentenfehler
Um einen Medikationsfehler bei der Verwendung des falschen Arzneimittels oder der Formulierung zu vermeiden, raten Sie den Patienten nachdrücklich, ihre Tabletten visuell zu überprüfen, um zu überprüfen Dosierung Forms And Strengths Wie geliefert / Lagerung und Handhabung ]. Refer the patient to the Medikamentenhandbuch that provides depictions of the Lamictal tablets tablets for oral suspension and orally disintegrating tablets.
Lamictal and Lamictal ODT are trademarks owned by or licensed to the GSK group of companies. The other brands listed are trademarks owned by or licensed to their respective owners and are not owned by or licensed to the GSK group of companies. The makers of these brands are not affiliated with and do not endorse the GSK group of companies or its products.
Nichtklinische Toxikologie
Karzinogenese -Mutagenese -Beeinträchtigung der Fruchtbarkeit
Bei Mäusen oder Ratten nach oraler Verabreichung von Lamotrigin für bis zu 2 Jahre in Dosen von bis zu 30 mg/kg/Tag bzw. 10 bis 15 mg/kg/Tag wurde kein Hinweis auf Karzinogenität beobachtet. Die höchsten getesteten Dosen sind weniger als die menschliche Dosis von 400 mg/Tag auf der Basis der Körperoberfläche (mg/m²).
Lamotrigin war in der In -vitro -Genmutation (AMES- und Maus -Lymphom -TK) -Assays sowie in der Clastogenität (In -vitro -Assays für humane Lymphozyten und In -vivo -Ratten -Ratten -Knochenmark).
Bei Ratten wurde bei oralen Dosen von Lamotrigin von bis zu 20 mg/kg/Tag keine Beweise für eine beeinträchtigte Fruchtbarkeit festgestellt. Die höchste getestete Dosis ist weniger als die menschliche Dosis von 400 mg/Tag mg/m².
Verwendung in bestimmten Populationen
Schwangerschaft
Schwangerschaft Exposure Registry
Es gibt ein Schwangerschafts -Expositionsregister, das die Schwangerschaftsergebnisse bei Frauen, die AEDs einschließlich Lamictal während der Schwangerschaft ausgesetzt sind, überwacht. Ermutigen Sie Frauen, die während der Schwangerschaft Lamictal einnehmen, sich in das nordamerikanische Antiepileptika-Arzneimittel (NAAED) -Verschwangerschaftsregister unter der Telefonnummer 1-888-233-2334 oder unter https://www.aedpregnancyregistry.org/ zu besuchen.
Risikozusammenfassung
Daten aus mehreren prospektiven Schwangerschafts -Expositionsregistern und epidemiologischen Untersuchungen schwangerer Frauen haben keine erhöhte Häufigkeit wichtiger angeborener Missbildungen oder ein konsistentes Muster von Fehlbildungen bei Frauen festgestellt, die im Vergleich zur Allgemeinbevölkerung Lamotrigin ausgesetzt sind (siehe Daten ). The majority of Lamictal pregnancy exposure data are from women with epilepsy. In animal studies administration of lamotrigine during pregnancy resulted in developmental toxicity (increased mortality decreased body weight increased structural variation neurobehavioral abnormalities) at doses lower than those administered clinically.
Lamotrigin verringerte die fetalen Folatkonzentrationen bei Ratten einen Effekt, von dem bekannt ist Daten ).
Das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburt für die angegebene Bevölkerung ist unbekannt. In der US -allgemeinen Bevölkerung beträgt das geschätzte Hintergrundrisiko für größere Geburtsfehler und eine Fehlgeburt bei klinisch anerkannten Schwangerschaften 2% bis 4% bzw. 15% bis 20%.
Clinical Considerations
Wie bei anderen AEDs können physiologische Veränderungen während der Schwangerschaft die Lamotriginkonzentrationen und/oder die therapeutische Wirkung beeinflussen. Es gab Berichte über verringerte Lamotrigin-Konzentrationen während der Schwangerschaft und die Wiederherstellung von Vor-Schwangerschaftskonzentrationen nach der Entbindung. Dosisanpassungen können erforderlich sein, um das klinische Ansprechen aufrechtzuerhalten.
Daten
Menschliche Daten
Daten from several international pregnancy registries have not shown an increased risk for malformations overall. The International Lamotrigine Schwangerschaft Registry reported major congenital malformations in 2.2% (95% CI: 1.6% 3.1%) of 1558 infants exposed to lamotrigine monotherapy in the first trimester of pregnancy. The NAAED Schwangerschaft Registry reported major congenital malformations among 2.0% of 1562 infants exposed to lamotrigine monotherapy in the first trimester. EURAP a large international pregnancy registry focused outside of North America reported major birth defects in 2.9% (95% CI: 2.3% 3.7%) of 2514 exposures to lamotrigine monotherapy in the first trimester. The frequency of major congenital malformations was similar to estimates from the general population.
Das NAAED-Schwangerschaftsregister beobachtete ein erhöhtes Risiko für isolierte orale Spalten: Bei 2200 Säuglingen, die zu Beginn der Schwangerschaft Lamotrigin ausgesetzt waren, betrug das Risiko für orale Spalten 3,2 pro 1000 (95% CI: 1,4 6,3). Dieser Befund wurde in anderen großen internationalen Schwangerschaftsregistern nicht beobachtet. Darüber hinaus berichtete eine Fall-Kontroll-Studie, die auf 21 angeborenen Anomalie-Registern, die über 10 Millionen Geburten in Europa abdecken, über ein bereinigtes Quotenverhältnis für isolierte orale Spalten mit Lamotrigin-Exposition von 1,45 (95% CI: 0,8 2,63).
Mehrere Metaanalysen haben nach Lamotrigin-Exposition in der Schwangerschaft im Vergleich zu gesunden und krankheitsübergreifenden Kontrollpersonen kein erhöhtes Risiko für wichtige angeborene Fehlbildungen berichtet. Es wurden keine Muster spezifischer Missbildungstypen beobachtet.
Dieselben Metaanalysen bewerteten das Risiko zusätzlicher Mütter- und Säuglingsergebnisse, einschließlich der vorzeitigen Geburtsgeburten für die fetale Todesfälle für Schwangerschaftsalter und neurologische Entwicklungsverzögerung. Obwohl es keine Daten gibt, die auf ein erhöhtes Risiko dieser Ergebnisse mit Lamotrigin -Monotherapie -Expositionsunterschieden in den Unterschieden in der Ergebnisdefinition und den Vergleichsgruppen hinweisen, begrenzen die Schlussfolgerungen, die gezogen werden können,.
Tierdaten
Wenn Schwangere Mäuse Ratten oder Kaninchen während der Organogenese (orale Dosen von bis zu 125 25 bzw. 30 mg/kg) verabreicht wurde, reduzierte das fetale Körpergewicht und erhöhte Inzidenzen von fetalen Skelettschwankungen bei Mäusen und Ratten bei Dosen, die auch matnnal giftig waren. Die No-Effect-Dosen für die Embryofetalentwicklung bei Mäusenratten und Kaninchen (75 6,25 bzw. 30 mg/kg) ähneln (Mäuse und Kaninchen) oder weniger als (Ratten) der menschlichen Dosis von 400 mg/Tag auf einer Körperfläche (mg/m²).
In einer Studie, in der schwangere Ratten während des Zeitraums der Organogenese und der Nachkommen in beiden Dosen Lamotrigin (orale Dosen von 0 5 oder 25 mg/kg) während des Zeitraums der Organogenese und der Nachkommen verabreicht wurden, wurden postnatal neurobehaviorale Anomalien beobachtet. Die niedrigste Effektdosis für die Entwicklungsneurotoxizität bei Ratten ist unter mg/m² weniger als die menschliche Dosis von 400 mg/Tag.
Wenn schwangere Ratten während des letzten Teils der Schwangerschaft Lamotrigin (orale Dosen von 0 5 10 oder 20 mg/kg) verabreicht wurden und während der gesamten Laktation die Nachkommensterblichkeit (einschließlich Totgeburten) in allen Dosen erhöhte. Die niedrigste Effektdosis für die vor- und postnatale Entwicklungstoxizität bei Ratten ist weniger als die menschliche Dosis von 400 mg/Tag mg/m². Die mütterliche Toxizität wurde bei den 2 getesteten Dosen beobachtet.
Bei Verabreichung an schwangere Ratten verringerte Lamotrigin die fetalen Folatkonzentrationen bei Dosen größer oder gleich 5 mg/kg/Tag, was weniger als die menschliche Dosis von 400 mg/Tag auf mg/m² ist.
Stillzeit
Risikozusammenfassung
Lamotrigin ist in Milch von stillenden Frauen vorhanden, die Lamictal einnehmen (siehe Daten ). Neonates and young infants are at risk for high serum levels because maternal serum and milk levels can rise to high levels postpartum if lamotrigine dosage has been increased during pregnancy but is not reduced after delivery to the pre-pregnancy dosage. Glucuronidation is required for drug clearance. Glucuronidation capacity is immature in the infant and this may also contribute to the level of lamotrigine exposure. Events including Ausschlag apnea Schläfrigkeit poor sucking and poor weight gain (requiring hospitalization in some cases) have been reported in infants who have been human milk-fed by mothers using lamotrigine; whether or not these events were caused by lamotrigine is unknown. No data are available on the effects of the drug on milk production.
Die Entwicklungs- und gesundheitlichen Vorteile des Stillens sollten zusammen mit dem klinischen Bedarf der Mutter nach Lamictal und potenziellen nachteiligen Auswirkungen des gestillten Kindes aus Lamictal oder aus dem zugrunde liegenden mütterlichen Zustand berücksichtigt werden.
verschreibungspflichtige Schmerzflecken für Rückenschmerzen
Clinical Considerations
Mit milchmilchgefütterten Säuglingen sollten auf unerwünschte Ereignisse, die aus Lamotrigin resultieren, genau überwacht werden. Die Messung der Säuglingsserumspiegel sollte durchgeführt werden, um die Toxizität auszuschließen, wenn Bedenken auftreten. Menschliche Milchernährung sollte bei Säuglingen mit Lamotrigin-Toxizität abgesetzt werden.
Daten
Daten from multiple small studies indicate that lamotrigine plasma levels in nursing infants have been reported to be as high as 50% of maternal plasma concentrations.
Pädiatrische Verwendung
Epilepsie
Lamictal is indicated as adjunctive therapy in patients aged 2 years and older for partial-onset seizures the generalized seizures of Lennox-Gastaut syndrome and PGTC seizures.
Sicherheit und Wirksamkeit von Lamictal, die als zusätzliche Behandlung bei partiellen Anfällen verwendet wurden, wurden bei einer kleinen randomisierten, doppelblinden, placebokontrollierten Abzugsstudie bei sehr jungen pädiatrischen Patienten nicht nachgewiesen (1 bis 24 Monate im Alter von 1 bis 24 Monaten). Lamictal war mit einem erhöhten Risiko für infektiöse unerwünschte Reaktionen (Lamictal 37% Placebo 5%) und Atemwegsreaktionen (Lamictal 26% Placebo 5%) verbunden. Infektiöse unerwünschte Reaktionen umfassten Bronchiolitis -Bronchitis -Ohrinfektion Augeninfektion Otitis externa Pharyngitis Harnwegsinfektion und Virusinfektion. Atemwegs unerwünschte Reaktionen umfassten Husten und Apnoe von Nasenverbrauch.
Bipolare Störung
Sicherheit und Wirksamkeit von Lamictal für die Aufrechterhaltung der bipolaren Störung wurde in einer doppelblinden randomisierten, placebokontrollierten Studie nicht festgelegt, in der 301 pädiatrische Patienten im Alter von 10 bis 17 Jahren mit einer aktuellen manisch/hypomanischen depressiven oder gemischten Stimmungs-Episode bewertet wurden, die durch DSM-IV-TR definiert wurde. In der randomisierten Phase der Studie waren unerwünschte Reaktionen bei mindestens 5% der Patienten, die Lamictal (n = 87) einnahmen, und waren doppelt so häufig im Vergleich zu Patienten, die Placebo (n = 86) einnahmen (n = 86), Influenza (lamictal 8% Placebo 2%) Oropharyngealschmerzen (lamict 8% igen) Erbrechen (Lamict -Abbrand). Schmerzen (Lamictal 5% Placebo 1%) und Selbstmordgedanken (Lamictal 5% Placebo 0%).
Jugendliche Tierdaten
In einer juvenilen Tierstudie, in der Lamotrigin (orale Dosen von 0 5 15 oder 30 mg/kg) jungen Ratten vom postnatalen Tag 7 bis 62 verabreicht wurde, wurden die Verringerung der Lebensfähigkeit und das Wachstum bei der höchsten getesteten Dosis-getesteten Dosis-Testen und Langzeit-Langzeit-Defikiten mit hohen Delaktiven und Langzeit-Langzeit-Defiziten bei den Haufen. Die No-Effect-Dosis für unerwünschte Entwicklungseffekte bei jugendlichen Tieren ist weniger als die menschliche Dosis von 400 mg/Tag auf mg/m².
Geriatrische Verwendung
Clinical trials of Lamictal for epilepsy and bipolare Störung did not include sufficient numbers of patients aged 65 years and older to determine whether they respond differently from younger patients or exhibit a different safety profile than that of younger patients. In general dose selection for an elderly patient should be cautious usually starting at the low end of the dosing range reflecting the greater frequency of decreased hepatic renal or cardiac function and of concomitant disease or other drug therapy.
Hepatische Beeinträchtigung
Die Erfahrung bei Patienten mit Leberbeeinträchtigungen ist begrenzt. Basierend auf einer klinischen Pharmakologie -Studie an 24 Probanden mit leichten mittelschweren und schweren Leberbeeinträchtigungen [siehe Klinische Pharmakologie ] Die folgenden allgemeinen Empfehlungen können abgegeben werden. Bei Patienten mit leichter Leberbehinderung ist keine Dosierungsanpassung erforderlich. Die anfänglichen Eskalations- und Erhaltungsdosen sollten bei Patienten mit mittelschwerer und schwerer Leberbeeinträchtigung ohne Aszites im Allgemeinen um etwa 25% und bei Patienten mit schwerer Leberbeeinträchtigung mit Aszites reduziert werden. Eskalations- und Wartungsdosen können nach klinischer Reaktion angepasst werden [siehe Dosierung und Verwaltung ].
Nierenbehinderung
Lamotrigin wird hauptsächlich durch Glucuronsäurekonjugation metabolisiert, wobei die meisten Metaboliten im Urin gewonnen werden. In einer kleinen Studie, in der eine einzige Dosis Lamotrigin bei Probanden mit unterschiedlichen Nierenbeeinträchtigungen mit gesunden Freiwilligen verglichen wurde Chronischer Nierenversagen [sehen Klinische Pharmakologie ].
Die anfänglichen Dosen von Lamictal sollten auf Patienten mit Patienten beruhen. Reduzierte Erhaltungsdosen können bei Patienten mit einer signifikanten Nierenbeeinträchtigung wirksam sein. Während der chronischen Behandlung mit Lamotrigin wurden nur wenige Patienten mit schwerer Nierenbeeinträchtigung untersucht. Da in dieser Bevölkerung unzureichende Erfahrungen bei diesen Patienten mit Vorsicht vorgebracht werden sollten [siehe Dosierung und Verwaltung ].
Überdosierungsinformationen für Lamictal
Menschliche Überdosierungserfahrung
Für Lamictal wurden Überdosierungen mit bis zu 15 g gemeldet, von denen einige tödlich waren. Überdosierung hat zu Ataxie-Nystagmus-Anfällen (einschließlich tonisch-klonischer Anfälle) geführt, die das Ausmaß des Bewusstseinsverzögerung des Bewusstseins und der intraventrikulären Leitungsverzögerung verringert haben.
Management der Überdosis
Es gibt keine spezifischen Gegenmittel für Lamotrigin. Nach einem mutmaßlichen Krankenhausaufenthalt des Patienten wird empfohlen. Eine allgemeine unterstützende Versorgung wird angezeigt, einschließlich der häufigen Überwachung von Vitalfunktionen und einer engen Beobachtung des Patienten. Wenn angegeben wird, sollte die Erbrechen induziert werden; Es sollten übliche Vorsichtsmaßnahmen getroffen werden, um die Atemwege zu schützen. Es sollte beachtet werden, dass Lamotrigin sofortiger Freisetzung schnell absorbiert wird [siehe Klinische Pharmakologie ]. It is uncertain whether hemodialysis is an effective means of removing lamotrigine from the blood. In 6 renal failure patients about 20% of the amount of lamotrigine in the body was removed by hemodialysis during a 4-hour session. A Poison Control Center should be contacted for information on the management of overdosage of Lamictal.
Kontraindikationen für Lamictal
Lamictal is contraindicated in patients who have demonstrated hypersensitivity (e.g. Ausschlag angioedema acute urticaria extensive pruritus mucosal ulceration) to the drug or its ingredients [sehen WARNUNG BOXED WARNUNGS AND VORSICHTSMASSNAHMEN ].
Klinische Pharmakologie for Lamictal
Wirkungsmechanismus
Die genauen Mechanismus, durch die Lamotrigin seine antikonvulsive Wirkung ausübt, sind unbekannt. In Tiermodellen, die zum Nachweis von Antikonvulsivitätsaktivität entwickelt wurden, verhindern Lamotrigin bei der Verbreitung von Anfällen im maximalen Elektroschock (MES) und Pentylenetetrazol (SCMMM) -Tests und verhinderte Anfälle bei der visuellen und elektrisch elektrisch Evoced After Entlarv (EEAD) -Tests für Antiepileptika. Lamotrigin zeigte auch hemmende Eigenschaften im Kindling -Modell bei Ratten, sowohl während der Entschärfenentwicklung als auch im voll entzündeten Zustand. Die Relevanz dieser Modelle für die menschliche Epilepsie ist jedoch nicht bekannt.
Ein vorgeschlagener Wirkungsmechanismus von Lamotrigin Die Relevanz, deren Einwirkung auf Natriumkanäle im Menschen noch festgestellt werden muss. Pharmakologische In-vitro-Studien legen nahe, dass Lamotrigin die spannungsempfindlichen Natriumkanäle hemmt, wodurch neuronale Membranen stabilisieren und folglich die vornaptische Senderfreisetzung von exzitatorischen Aminosäuren (z. B. Glutamat und Aspartat) modulieren.
Wirkung von Lamotrigin auf die vermittelte Aktivität des N-Methyl-D-Aspartatrezeptors
Lamotrigin hemmte keine N-Methyl-D-Aspartat (NMDA) -induzierten Depolarisierungen in kortikalen Rattenschnitten oder NMDA-induzierten cyclischen GMP-Bildung in unreifen Ratten-Kleinhirn, oder Lamotriginverbindungen verdrängen entweder kompetitive oder nicht-competitive Ligands in diesem Glutamatrezeptkomplex (CNQX-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CG-CGS-Komplex). Der IC50 für Lamotrigin-Effekte auf NMDA-induzierte Ströme (in Gegenwart von 3 & mgr; m Glycin) in kultivierten Hippocampus-Neuronen überstieg 100 μm.
Die Mechanismen, durch die Lamotrigin seine therapeutische Wirkung bei bipolarer Störung ausübt, wurden nicht festgestellt.
Pharmakodynamik
Folatstoffwechsel
In -vitro -Lamotrigin inhibierte Dihydrofolatreduktase das Enzym, das die Reduktion von Dihydrofolat zum Tetrahydrofolat katalysiert. Die Hemmung dieses Enzyms kann die Biosynthese von Nukleinsäuren und Proteinen stören. Wenn schwangere Ratten während der Organogenese während der Organogenese -Plazenta- und mütterliche Folatkonzentrationen orale tägliche Lamotrigin -Dosen verabreicht wurden. Signifikant reduzierte Folatkonzentrationen sind mit der Teratogenese assoziiert [siehe Verwendung in bestimmten Populationen ]. Folate concentrations were also reduced in male rats given repeated oral doses of Lamotrigin. Reduced concentrations were partially returned to normal when supplemented with folinic acid.
Herzelektrophysiologie
Wirkung von Lamotrigin
In -vitro -Studien zeigen, dass Lamotrigin in therapeutisch relevanten Konzentrationen die antiarrhythmische Aktivität der Klasse IB aufweist. Es hemmt menschliche Herz -Natriumkanäle mit schnellem Einsetzen und Offset -Kinetik und starker Spannungsabhängigkeit im Einklang mit anderen Antiarrhythmikern der Klasse IB. Bei therapeutischen Dosen verlangsamte Lamictal bei gesunden Personen in einer gründlichen QT -Studie nicht langsame ventrikuläre Leitung (Widen QRs). Bei Patienten mit klinisch wichtigen strukturellen oder funktionellen Herzerkrankungen (d. H. Patienten mit Herzinsuffizienzerkrankungen angeborener Herzerkrankungen Leitungssystem -Krankheiten ventrikulärer Arrhythmien -Herzkanalopathien [z. B. Brugada -Syndrom) klinisch wichtige ischämische Herzerkrankungen oder multiple Risikofaktoren für Koronararterien) können Lamiktal -Lamiktal -Lamiktal -Lamiktal -Lamikte, die zu einem plötzlichen Ventikum führen, (wehte QRS -Krankheiten). Eine erhöhte Herzfrequenz könnte auch das Risiko einer Verlangsamung der ventrikulären Leitung durch Lamictal erhöhen.
Wirkung von Lamotrigin Metabolite
Bei Hunden wird Lamotrigin ausgiebig metabolisiert zu einem 2-Nmethyl-Metaboliten. Dieser Metaboliten verursacht eine dosisabhängige Verlängerung der PR-Intervallverbreiterung des QRS-Komplexes und bei höheren Dosen vollständiger AV-Leitungsblock. Die in vitro elektrophysiologischen Wirkungen dieses Metaboliten wurden nicht untersucht. Ähnliche kardiovaskuläre Wirkungen aus diesem Metaboliten werden beim Menschen nicht erwartet, da nur Spuren des 2-N-Methylmetaboliten (<0.6% of lamotrigine dose) have been found in human urine [sehen Klinische Pharmakologie ]. However it is conceivable that plasma concentrations of this metabolite could be increased in patients with a reduced capacity to glucuronidate lamotrigine (e.g. in patients with liver disease patients taking concomitant medications that inhibit glucuronidation).
Ansammlung in Nieren
Lamotrigin in der Niere der männlichen Ratte, die eine chronische fortschreitende Nephrose -Nekrose und Mineralisierung verursacht. Diese Befunde werden auf α-2-Mikroglobulin-A-Spezies und geschlechtsspezifisches Protein zurückgeführt, das beim Menschen oder anderen Tierarten nicht nachgewiesen wurde.
Melaninbindung
Lamotrigin bindet an melaninhaltige Gewebe, z. in der Auge und in pigmentierter Haut. Es wurde im Uveal -Trakt bis zu 52 Wochen nach einer einzelnen Dosis bei Nagetieren gefunden.
Pharmakokinetik
Die Pharmakokinetik von Lamotrigin wurde bei Probanden mit gesunden jungen und älteren Freiwilligen von Epilepsie mit chronischem Nierenversagen untersucht. Lamotrigin pharmakokinetische Parameter für erwachsene und pädiatrische Probanden und gesunde normale Freiwillige sind in den Tabellen 14 und 16 zusammengefasst.
Tabelle 14: Mittlere pharmakokinetische Parametera Bei gesunden Freiwilligen und erwachsenen Probanden mit Epilepsie
| Erwachsenenstudienpopulation | Anzahl der Themen | Tmax: Zeit der maximalen Plasmakonzentration (H) | T½ Elimination Halbwertszeit (H) | CL/F: Scheinbare Plasmafreiheit (ml/min/kg) |
| Gesunde Freiwillige, die keine anderen Medikamente einnehmen: | ||||
| Eindosis Lamictal | 179 | 2,2 (0,25-12,0) | 32.8 (14.0-103.0) | 0,44 (0,12-1,10) |
| Mehrfachdosis Lamictal | 36 | 1,7 (0,5-4,0) | 25,4 (11.6-61,6) | 0,58 (0,24-1,15) |
| Gesunde Freiwillige einnehmen Valproate: | ||||
| Eindosis Lamictal | 6 | 1,8 (1.0-4.0) | 48,3 (31.5-88,6) | 0,30 (0,14-0,42) |
| Mehrfachdosis Lamictal | 18 | 1,9 (0,5-3,5) | 70,3 (41.9-113.5) | 0,18 (0,12-0,33) |
| Probanden mit Epilepsie nur Valproat einnehmen: | ||||
| Eindosis Lamictal | 4 | 4,8 (1,8-8,4) | 58,8 (30,5-88,8) | 0,28 (0,16-0,40) |
| Probanden mit Epilepsie, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmenb Plus Valproate: | ||||
| Eindosis Lamictal | 25 | 3.8 (1.0-10.0) | 27,2 (11.2-51.6) | 0,53 (0,27-1,04) |
| Probanden mit Epilepsie, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmen:b | ||||
| Eindosis Lamictal | 24 | 2,3 (0,5-5,0) | 14.4 (6.4-30,4) | 1.10 (0,51-2,22) |
| Mehrfachdosis Lamictal | 17 | 2,0 (0,75-5,93) | 12,6 (7,5-23.1) | 1,21 (0,66-1,82) |
| a Der Großteil der in jeder Studie ermittelten Parameterwerte hatte Variationskoeffizienten zwischen 20% und 40% für die Halbwertszeit und CL/F und zwischen 30% und 70% für TMAX. Die Gesamtwertwerte wurden aus einzelnen Studien berechnet, die auf der Grundlage der Anzahl der Freiwilligen/Probanden in jeder Studie gewichtet wurden. Die Zahlen in Klammern unter jedem Parametermittelwert repräsentieren den Bereich der einzelnen Freiwilligen-/Subjektwerte über Studien hinweg. b Es wurde gezeigt, dass Carbamazepin -Phenytoin -Phenobarbital und Primidon die scheinbare Clearance von Lamotrigin erhöhen. Östrogenhaltige orale Kontrazeptiva und andere Arzneimittel wie Rifampin- und Protease-Inhibitoren Lopinavir/Ritonavir und Atazanavir/Ritonavir, die Lamotrigin-Glucuronidierung induzieren Wechselwirkungen mit Arzneimitteln ]. |
Absorption
Lamotrigin ist nach oraler Verabreichung mit vernachlässigbarem Erstpassstoffwechsel schnell und vollständig absorbiert (absolute Bioverfügbarkeit beträgt 98%). Die Bioverfügbarkeit wird nicht von Lebensmitteln beeinflusst. Spitzen -Plasmakonzentrationen treten zwischen 1,4 und 4,8 Stunden nach der Verabreichung von Arzneimitteln auf. Es wurde festgestellt, dass die Lamotrigin -Tabletten für die orale Suspension gleichwertig sind, unabhängig davon, ob er als in Wasser gekaute und verschluckte oder verschluckte oder geschluckte Ganze an den Lamotrigin -Drucktabletten in Bezug auf die Rate und das Ausmaß der Absorption geschluckt wurde. In Bezug auf die Geschwindigkeit und das Ausmaß der Absorptionslamotrigin lösten sich die Tafel oral auf, unabhängig davon, ob sie im Mund zerfallen oder mit Wasser das ganze Ganze verschluckt wurden, den mit Wasser verschluckten Lamotrigin -Drucktabletten entspricht.
Dosis Verhältnismäßigkeit
Bei gesunden Freiwilligen, die keine anderen Medikamente erhielten, und einzelne Dosen erhöhten die Plasmakonzentrationen von Lamotrigin in direktem Verhältnis zur Dosis, die über den Bereich von 50 bis 400 mg verabreicht wurde. In 2 kleinen Studien (n = 7 und 8) von Patienten mit Epilepsie, die auf anderen AEDs gehalten wurden, gab es auch eine lineare Beziehung zwischen Dosis und Lamotrigin -Plasmakonzentrationen im stationären Zustand nach Dosen von 50 bis 350 mg zweimal täglich.
Verteilung
Schätzungen des mittleren scheinbaren Verteilungsvolumens (VD/F) von Lamotrigin nach oraler Verabreichung lagen zwischen 0,9 und 1,3 l/kg. VD/F ist unabhängig von der Dosis und nach einzelnen und mehreren Dosen bei beiden Patienten mit Epilepsie und bei gesunden Freiwilligen ähnlich.
Proteinbindung
Daten from in vitro studies indicate that lamotrigine is approximately 55% bound to human plasma proteins at plasma lamotrigine concentrations from 1 to 10 mcg/mL (10 mcg/mL is 4 to 6 times the trough plasma concentration observed in the controlled efficacy trials). Because lamotrigine is not highly bound to plasma proteins clinically significant interactions with other drugs through competition for protein binding sites are unlikely. The binding of lamotrigine to plasma proteins did not change in the presence of therapeutic concentrations of phable phenobarbital or valproate. Lamotrigine did not displace other AEDs (Carbamazepin phable phenobarbital) from protein-binding sites.
Stoffwechsel
Lamotrigin wird vorwiegend durch Glucuronsäure -Konjugation metabolisiert; Der Hauptmetabolit ist ein inaktives 2-N-Glucuronid-Konjugat. Nach oraler Verabreichung von 240 mg von 14C-Lamotrigin (15 μCI) bis 6 gesunde Freiwillige 94% wurden im Urin gewonnen und 2% wurden in den Kot gewonnen. Die Radioaktivität im Urin bestand aus unveränderten Lamotrigin (10%) dem 2-N-Glucuronid (76%) A 5-N-Glucuronid (10%) A 2-N-Methyl-Metabolit (0,14%) und anderer nicht identifizierter kleiner Metaboliten (4%).
Enzyminduktion
Die Auswirkungen von Lamotrigin auf die Induktion spezifischer Familien von Oxidase-Isozymen mit gemischter Funktion wurden nicht systematisch bewertet.
Nach mehreren Verabreichungen (150 mg zweimal täglich) an normale Freiwillige, die keine anderen Medikamente einnahmen, induzierte Lamotrigin seinen eigenen Metabolismus, was zu einer Abnahme von T½ und einer Anstieg des CL/F -Anstiegs von 37% im stationären Zustand im Vergleich zu den Werten, die bei derselben Freiwilligen nach einer einzelnen Dosis erhalten wurden. Evidence gathered from other sources suggests that self-induction by lamotrigine may not occur when lamotrigine is given as adjunctive therapy in patients receiving enzyme-inducing drugs such as carbamazepine phenytoin phenobarbital primidone or other drugs such as rifampin and the protease inhibitors lopinavir/ritonavir and atazanavir/ritonavir that induce Lamotrigin -Glucuronidation [siehe Wechselwirkungen mit Arzneimitteln ].
Beseitigung
Die Eliminierungs halbe Leben und offensichtliche Clearance von Lamotrigin nach oraler Verabreichung von Lamictal an erwachsene Probanden mit Epilepsie und gesunden Freiwilligen ist in Tabelle 14 zusammengefasst. Die Halbwertszeit und die offensichtliche orale Clearance variieren je nach gleichzeitiger AEDs.
Wechselwirkungen mit Arzneimitteln
Die offensichtliche Clearance von Lamotrigin wird durch die gleichzeitige Verabreichung bestimmter Medikamente beeinflusst [siehe WARNUNGS AND VORSICHTSMASSNAHMEN Wechselwirkungen mit Arzneimitteln ].
Die Nettoeffekte von Arzneimittelwechselwirkungen mit Lamotrigin sind in den Tabellen 13 und 15 zusammengefasst, gefolgt von Details der nachstehenden Arzneimittelwechselwirkungsstudien.
Tabelle 15: Zusammenfassung der Wechselwirkungen zwischen Arzneimitteln mit Lamotrigin
| Arzneimittel | Arzneimittel Plasma Concentration with Adjunctive Lamotriginea | Lamotrigin -Plasmakonzentration mit Zusatzmedikamentenb |
| Orale Kontrazeptiva (z. B. Ethinylestradiol/Levonorgestrel)c | ↔d | ↓ |
| Aripiprazol | Nicht bewertet | ↔e |
| Atazanavir/Ritonavir | ↔f | ↓ |
| Bupropion | Nicht bewertet | ↔ |
| Carbamazepin | ↔ | ↓ |
| Carbamazepin epoxideg | ? | |
| Felbamat | Nicht bewertet | ↔ |
| Gabapentin | Nicht bewertet | ↔ |
| Lacosamid | Nicht bewertet | ↔ |
| Levetiracetam | ↔ | ↔ |
| Lithium | ↔ | Nicht bewertet |
| Lopinavir/Ritonavir | ↔e | ↓ |
| Olanzapin | ↔ | ↔e |
| Oxcarbazepin | ↔ | ↔ |
| 10-monohydroxy Oxcarbazepin-Metabolith | ↔ | |
| Perampanel | Nicht bewertet | ↔e |
| Phenobarbital/ Primidon | ↔ | ↓ |
| Phable | ↔ | ↓ |
| Pregabalin | ↔ | ↔ |
| Rifampin | Nicht bewertet | ↓ |
| Risperidon | ↔ | Nicht bewertet |
| 9-Hydroxyrisperidonei | ↔ | |
| Topiramat | ↔j | ↔ |
| Valproat | ↓ | ↑ |
| Valproat + phable and/or Carbamazepin | Nicht bewertet | ↔ |
| Zonisamid | Nicht bewertet | ↔ |
| a Aus zusätzlichen klinischen Studien und Freiwilligenversuchen. b Die Nettoeffekte wurden geschätzt, indem die mittleren Clearance -Werte in zusätzlichen klinischen Studien und Freiwilligenversuchen verglichen wurden. c Die Wirkung anderer hormoneller Verhütungsvorbereitungen oder Hormonersatztherapie auf die Pharmakokinetik von Lamotrigin wurde in klinischen Studien nicht systematisch bewertet, obwohl der Effekt der mit den Kombinationen von Ethinylestradiol/Levonorgestrel ähnlich sein kann. d Eine bescheidene Abnahme der Levonorgestrel. e Eine geringfügige Abnahme nicht erwartet, dass sie klinisch sinnvoll ist. f Verglichen mit historischen Kontrollen. g Nicht verabreicht, sondern ein aktiver Metaboliten aus Carbamazepin. h Nicht verabreicht, sondern ein aktiver Metaboliten Oxcarbazepin. i Nicht verabreicht, sondern ein aktiver Metaboliten Risperidon. j Leichter Anstieg nicht erwartet, dass er klinisch sinnvoll ist. ↔ = kein signifikanter Effekt. ? = Widersprüchliche Daten. |
Östrogenhaltige orale Kontrazeptiva
Bei 16 weiblichen Freiwilligen mündeten eine orale Verhütungsvorbereitung, die 30 mcg Ethinylestradiol und 150 mcg Levonorgestel enthielt, die scheinbare Clearance von Lamotrigin (300 mg/Tag) um ungefähr 2-fach mit einem durchschnittlichen Abfall der AUC von 52% und in CMAX von 39%. In dieser Studie nahmen die Lamotrigin-Konzentrationen des Serums von Trogs allmählich zu und waren am Ende der Woche des inaktiven Hormonpräparats im Durchschnitt um durchschnittlich 2-fach im Vergleich zu Trough-Lamotrigin-Konzentrationen am Ende des aktiven Hormonzyklus.
Gradual transient increases in lamotrigine plasma levels (approximate 2-fold increase) occurred during the week of inactive hormone preparation (pill-free week) for women not also taking a drug that increased the clearance of lamotrigine (carbamazepine phenytoin phenobarbital primidone or other drugs such as rifampin and the protease inhibitors lopinavir/ritonavir and Atazanavir/Ritonavir, die Lamotrigin -Glucuronidation induzieren) [siehe Wechselwirkungen mit Arzneimitteln ]. The increase in lamotrigine plasma levels will be greater if the dose of Lamictal is increased in the few days before or during the pill-free week. Increases in lamotrigine plasma levels could result in dose-dependent adverse reactions.
In derselben Studie hatte die gleichzeitige Verabreichung von Lamotrigin (300 mg/Tag) bei 16 Freiwilligen weibliche Freiwillige die Pharmakokinetik der Ethinylestradiolkomponente der oralen Verhütungsvorbereitung nicht beeinflusst. Die AUC und Cmax der Levonorgestrel -Komponente von 19% bzw. 12% gab es durchschnittliche Abnahmen. Die Messung des Serum-Progesterons ergab, dass es bei keinem der 16 Freiwilligen hormonelle Hinweise auf einen Eisprung gab, obwohl die Messung von Serum-FSH-LH und Östradiol darauf hinwies, dass es einen gewissen Verlust der Unterdrückung der hypothalamushopisch-ovarianischen Achse gab.
Die Auswirkungen von anderen Lamotrigin -Dosen außer 300 mg/Tag wurden in kontrollierten klinischen Studien nicht systematisch bewertet. Studien mit anderen weiblichen hormonellen Präparaten (einschließlich Progesteron/Progesteron-haltigem HRT) wurden nicht durchgeführt.
Die klinische Bedeutung der beobachteten hormonellen Veränderungen bei der ovulatorischen Aktivität ist unbekannt. Die Möglichkeit einer verminderten Verhütungswirksamkeit bei einigen Patienten kann jedoch nicht ausgeschlossen werden. Daher sollten die Patienten angewiesen werden, unverzüglich Änderungen in ihrem Menstruationsmuster (z. B. durch Break-Through-Blutungen) zu melden.
Dosierung adjustments may be necessary for women receiving estrogen-containing products including oral contraceptive preparations [sehen Dosierung und Verwaltung ].
Andere Hormonal Contraceptives Or Hormone Replacement Therapy
Die Wirkung anderer hormoneller Verhütungsvorbereitungen oder Hormonersatztherapie auf die Pharmakokinetik von Lamotrigin wurde nicht systematisch bewertet. Es wurde berichtet, dass Ethinylestradiol nicht Progestogene die Clearance von Lamotrigin auf das 2-fache erhöhten und die Pillen nur für Progestin keinen Einfluss auf den Lamotrigin-Plasmakegel hatten. Daher wird die Anpassungen der Dosierung von Lamictal in Gegenwart von Gestagenen allein wahrscheinlich nicht benötigt.
Aripiprazol
Bei 18 Patienten mit bipolarer Störung auf einem stabilen Regime von 100 bis 400 mg/Tag Lamotrigin wurden Lamotrigin AUC und Cmax bei Patienten, die Aripiprazol 10 bis 30 mg/Tag für 7 Tage nach Aripiprazol erhielten, um etwa 10% reduziert, gefolgt von 30 mg/Tag für weitere 7 Tage. Diese Verringerung der Lamotrigin -Exposition wird nicht als klinisch aussagekräftig angesehen.
Atazanavir/Ritonavir
In einer Studie an gesunden Freiwilligen tägliche Dosen von Atazanavir/Ritonavir (300 mg/100 mg) reduzierten die Plasma-AUC und Cmax von Lamotrigin (Single 100 mg Dosis) um durchschnittlich 32% bzw. 6% und verkürzte die Elimination halbwertsfreie um 27%. In Gegenwart von Atazanavir/Ritonavir (300 mg/100 mg) wurde das Verhältnis von Metabolit zu Lamotrigin von 0,45 auf 0,71 im Einklang mit der Induktion der Glucuronidation erhöht. Die Pharmakokinetik von Atazanavir/Ritonavir war in Gegenwart eines gleichzeitigen Lamotrigins in den historischen Daten der Pharmakokinetik in Abwesenheit von Lamotrigin ähnlich.
Bupropion
Die Pharmakokinetik einer 100-mg-Einzeldosis Lamotrigin bei gesunden Freiwilligen (n = 12) wurde durch die gleichzeitige Verabreichung von Bupropion-Formulierung von Bupropion (150 mg zweimal täglich) ab 11 Tagen vor Lamotrigin nicht verändert.
Carbamazepin
Lamotrigin hat keinen nennenswerten Einfluss auf die Carbamazepin-Plasmakonzentration im stationären Zustand. Begrenzte klinische Daten deuten darauf hin, dass bei Patienten, die Carbamazepin mit Lamotrigin erhalten, eine höhere Inzidenz von Diplopia -Ataxie und verschwommenem Sehvermögen vorliegt als bei Patienten, die andere AEDs mit Lamotrigin erhalten [siehe Nebenwirkungen ]. The mechanism of this interaction is unclear. The effect of lamotrigine on plasma concentrations of Carbamazepin-epoxide is unclear. In a small subset of patients (n = 7) studied in a placebo-controlled trial lamotrigine had no effect on Carbamazepin-epoxide plasma concentrations but in a small uncontrolled study (n = 9) Carbamazepin-epoxide levels increased.
Die Zugabe von Carbamazepin verringert die Lamotrigin-Steady-State-Konzentrationen um ungefähr 40%.
Felbamat
In einer Studie an 21 gesunden Freiwilligen, die mit Felbamat (1200 mg zweimal täglich) mit Lamotrigin (100 mg zweimal täglich für 10 Tage) nicht relevante Auswirkungen auf die Pharmakokinetik von Lamotrigin zu haben schienen.
Folsäureinhibitoren
Lamotrigin ist ein schwacher Inhibitor der Dihydrofolatreduktase. Die Verschreiber sollten sich dieser Aktion bewusst sein, wenn sie andere Medikamente verschreiben, die den Folatstoffwechsel hemmen.
Gabapentin
Basierend auf einer retrospektiven Analyse der Plasmaspiegel bei 34 Probanden, die Lamotrigin sowohl mit als auch ohne Gabapentin Gabapentin erhielten, scheint die scheinbare Clearance von Lamotrigin nicht zu ändern.
Lacosamid
Die Plasmakonzentrationen von Lamotrigin wurden durch gleichzeitige Lacosamid (200 400 oder 600 mg/Tag) in placebokontrollierten klinischen Studien bei Patienten mit partiellen Anfällen nicht beeinflusst.
Levetiracetam
Potentielle Arzneimittelwechselwirkungen zwischen Levetiracetam und Lamotrigin wurden bewertet, indem die Serumkonzentrationen beider Wirkstoffe während placebokontrollierter klinischer Studien bewertet wurden. Diese Daten zeigen, dass Lamotrigin die Pharmakokinetik von Levetiracetam nicht beeinflusst und dass Levetiracetam die Pharmakokinetik von Lamotrigin nicht beeinflusst.
Lithium
Die Pharmakokinetik von Lithium wurde bei gesunden Probanden (n = 20) durch gleichzeitige Verabreichung von Lamotrigin (100 mg/Tag) für 6 Tage nicht verändert.
Lopinavir/Ritonavir
Die Zugabe von Lopinavir (400 mg zweimal täglich)/Ritonavir (100 mg zweimal täglich) verringerte bei 18 gesunden Probanden die AUC-CMAX- und Eliminierungs-Halbwertszeit von Lamotrigin um etwa 50% bis 55,4%. Die Pharmakokinetik von Lopinavir/Ritonavir war im Vergleich zu historischen Kontrollen ähnlich wie bei gleichzeitiger Lamotrigin.
Olanzapin
Die AUC und Cmax von Olanzapin waren nach Zugabe von Olanzapin (15 mg einmal täglich) zu Lamotrigin (200 mg einmal täglich) bei gesunden männlichen Freiwilligen (n = 16) im Vergleich zu AUC und Cmax bei gesunden männlichen Freiwilligen, die Allein Olanzapin empfangen (n = 16).
In derselben Studie wurden die AUC und Cmax von Lamotrigin nach Zugabe von Olanzapin zu Lamotrigin bei gesunden männlichen Freiwilligen durchschnittlich um 24% bzw. 20% reduziert. Es wird nicht erwartet, dass diese Verringerung der Lamotrigin -Plasmakonzentrationen klinisch aussagekräftig ist.
Oxcarbazepin
Die AUC und Cmax von Oxcarbazepin und sein aktiver 10-monohydroxy-Oxcarbazepin-Metaboliten waren nach Zugabe von Oxcarbazepin (600 mg zweimal täglich) nicht signifikant unter Lamotrigin (200 mg) in gesunden männlichen Freiwilligen (n = 13).
In derselben Studie waren die AUC und Cmax von Lamotrigin nach Zugabe von Oxcarbazepin (600 mg zweimal täglich) zu Lamotrigin bei gesunden männlichen Freiwilligen ähnlich, verglichen mit denen, die Lamotrigin allein erhielten. Begrenzte klinische Daten deuten auf eine höhere Inzidenz von Kopfschmerz -Schwindel -Übelkeit und Schläfrigkeit bei der gleichzeitigen Verabreichung von Lamotrigin und Oxcarbazepin im Vergleich zu Lamotrigin allein oder Oxcarbazepin hin.
Perampanel
In einer gepoolten Analyse von Daten aus 3 placebokontrollierten klinischen Studien, in denen zusätzliche Perampanel bei Patienten mit teilweise auftretenden und PGTC-Anfällen die höchste Perampanel-Dosis bewertet wurde (12 mg/Tag) erhöhte die Lamotrigin-Clearance durch <10%. An effect of this magnitude is not considered to be clinically relevant.
Phenobarbital -Primidon
Die Zugabe von Phenobarbital oder Primidon verringert die Lamotrigin-Steady-State-Konzentrationen um ungefähr 40%.
Phable
Lamotrigin wirkt sich bei Patienten mit Epilepsie keinen nennenswerten Einfluss auf die Phenytoin-Plasmakonzentrationen im stationären Zustand. Die Zugabe von Phenytoin verringert die Lamotrigin-Steady-State-Konzentrationen um ungefähr 40%.
Pregabalin
Steady-State-Trog-Plasmakonzentrationen von Lamotrigin wurden durch die gleichzeitige Verabreichung von Pregabalin (200 mg 3-mal täglich) nicht beeinflusst. Es gibt keine pharmakokinetischen Wechselwirkungen zwischen Lamotrigin und Pregabalin.
Rifampin
Bei 10 männlichen Freiwilligen Rifampin (600 mg/Tag für 5 Tage) erhöhte die scheinbare Clearance einer einzelnen 25-mg-Dosis Lamotrigin um ungefähr 2-fach signifikant (AUC nahm um ungefähr 40%ab).
Risperidon
In einer 14 gesunden Freiwilligenstudie hatten mehrere orale Dosen Lamotrigin täglich keine klinisch signifikanten Auswirkungen auf die Pharmakokinetik von Risperidon 2 mg und ihr aktives Metaboliten 9-OH Risperidon. Nach der gleichzeitigen Verabreichung von Risperidon 2 mg mit Lamotrigin 12 der 14 Freiwilligen berichteten die Schläfrigkeit im Vergleich zu 1 von 20, als Risperidon allein verabreicht wurde, und keine, als Lamotrigin allein verabreicht wurde.
Topiramat
Topiramat resulted in no change in plasma concentrations of Lamotrigin. Administration of lamotrigine resulted in a 15% increase in topiramate concentrations.
Valproat
Wenn Lamotrigin an gesunde Freiwillige verabreicht wurde (n = 18), die Valproat erhielten, nahm die Trog-Stationsstate-Valproat-Plasmakonzentrationen über einen Zeitraum von 3 Wochen um durchschnittlich 25% ab und stabilisierten sich dann. Das Hinzufügen von Lamotrigin zu der vorhandenen Therapie verursachte jedoch keine Änderung der Valproat -Plasmakonzentrationen bei erwachsenen oder pädiatrischen Patienten in kontrollierten klinischen Studien.
Die Zugabe von Valproat erhöhte die Lamotrigin-Steady-State-Konzentrationen bei normalen Freiwilligen um etwas mehr als das 2-fache. In 1 Studie wurde die maximale Hemmung der Lamotrigin -Clearance in Valproat -Dosen zwischen 250 und 500 mg/Tag erreicht und stieg nicht an, da die Valproat -Dosis weiter erhöht wurde.
Zonisamid
In einer Studie an 18 Patienten mit der gleichzeitigen Verabreichung von Zonisamid (200 bis 400 mg/Tag) mit Lamotrigin (150 bis 500 mg/Tag für 35 Tage) hatten keine signifikante Auswirkungen auf die Pharmakokinetik von Lamotrigin.
Bekannte Induktoren oder Inhibitoren der Glucuronidierung
Arzneimittels other than those listed above have not been systematically evaluated in combination with Lamotrigin. Since lamotrigine is metabolized predominately by glucuronic acid conjugation drugs that are known to induce or inhibit glucuronidation may affect the apparent clearance of lamotrigine and doses of lamotrigine may require adjustment based on clinical response.
Andere
In-vitro-Bewertung der inhibitorischen Wirkung von Lamotrigin bei OCT2 zeigt, dass Lamotrigin, jedoch nicht der N (2) -Glucuronid-Metaboliten ein Inhibitor von OCT2 bei potenziell klinisch relevanten Konzentrationen mit IC50-Wert von 53,8 μm ist [siehe Wechselwirkungen mit Arzneimitteln ].
Die Ergebnisse von In -vitro -Experimenten legen nahe, dass die Clearance von Lamotrigin durch die gleichzeitige Verabreichung von Amitriptylin -Clonazepam -Clozapin -Fluoxetin -Haloperidol -Lorazepam -Phenelzin -Sertralin oder Trazodon nicht verringert wird.
Die Ergebnisse von In -vitro -Experimenten legen nahe, dass Lamotrigin die Clearance von Arzneimitteln nicht verringert, die überwiegend durch CYP2D6 eliminiert wurden.
Spezifische Populationen
Patienten mit Nierenbehinderung
Zwölf Freiwillige mit chronischem Nierenversagen (mittlere Kreatinin-Clearance: 13 ml/min Reichweite: 6 bis 23) und weitere 6 Personen, die sich einer Hämodialyse unterzogen hatten, erhielten jeweils eine einzelne 100-mg-Dosis Lamotrigin. Die in der Studie festgelegten mittleren Plasma-Halbwertszeiten betrugen 42,9 Stunden (chronischer Nierenversagen) 13,0 Stunden (während der Hämodialyse) und 57,4 Stunden (zwischen der Hämodialyse) im Vergleich zu 26,2 Stunden bei gesunden Freiwilligen. Im Durchschnitt ungefähr 20% (Bereich: 5,6 bis 35,1) der im Körper vorhandenen Lamotriginmenge wurde durch Hämodialyse während einer 4-stündigen Sitzung beseitigt [siehe Dosierung und Verwaltung ].
Patienten mit Leberbehinderung
Die Pharmakokinetik von Lamotrigin nach einer einzelnen 100-mg-Dosis Lamotrigin wurde bei 24 Probanden mit leichter mittelschwerer und schwerer Leberbeeinträchtigung (Kinder-Pugh-Klassifizierungssystem) bewertet und mit 12 Probanden ohne Leberbeeinträchtigung verglichen. Die Probanden mit schwerer Leberbeeinträchtigung waren ohne Aszites (n = 2) oder mit Aszites (n = 5). Die mittleren scheinbaren Clearances von Lamotrigin bei Probanden mit mildem (n = 12) mittelschwerer (n = 5) ohne Aszites (n = 2) und schwerer mit Aszites (n = 5) Leber -Beeinträchtigung betrugen 0,30 ± 0,09 0,24 ± 0,1 0,21 ± 0,04 und 0,15 ± 0,09 ml/kg im Vergleich zu 0,37 ± 0,09 ml/kg. Durchschnittliche Halbwertszeiten von Lamotrigin bei Probanden mit leicht mittelschwerer schwerer schwerer und schwerer Aszites mit Aszites-Leber-Beeinträchtigung waren 46 ± 20 72 ± 44 67 ± 11 bzw. 100 ± 48 Stunden im Vergleich zu 33 ± 7 Stunden in gesunden Kontrollen [siehe Dosierung und Verwaltung ].
Pädiatrische Patienten
Die Pharmakokinetik von Lamotrigin nach einer einzelnen 2-mg/kg-Dosis wurde in 2 Studien an pädiatrischen Probanden bewertet (n = 29 für Probanden im Alter von 10 Monaten bis 5,9 Jahren und n = 26 für Probanden im Alter von 5 bis 11 Jahren). 43 Probanden erhielten eine gleichzeitige Therapie mit anderen AEDs und 12 Probanden erhielten Lamotrigin als Monotherapie. Lamotrigin pharmakokinetische Parameter für pädiatrische Patienten sind in Tabelle 16 zusammengefasst.
Populations pharmakokinetische Analysen, an denen Probanden im Alter von 2 bis 18 Jahren beteiligt waren, zeigten, dass die Lamotrigin -Clearance vorwiegend durch das Gesamtkörpergewicht und die gleichzeitige AED -Therapie beeinflusst wurde. Die orale Clearance von Lamotrigin war bei pädiatrischen Patienten auf Körpergewicht höher als bei Erwachsenen. Die Gewichtsnormalisierte lamotrigin <30 kg compared with those weighing>30 kg. Dementsprechend wiegen Patienten <30 kg may need an increase of as much as 50% in maintenance doses based on clinical response as compared with subjects weighing>30 kg werden dieselben AEDs verabreicht [siehe Dosierung und Verwaltung ]. These analyses also revealed that after accounting for body weight lamotrigine clearance was not significantly influenced by age. Thus the same weight-adjusted doses should be administered to children irrespective of differences in age. Concomitant AEDs which influence lamotrigine clearance in adults were found to have similar effects in children.
Tabelle 16: mittlere pharmakokinetische Parameter bei pädiatrischen Probanden mit Epilepsie
| Population für pädiatrische Studien | Anzahl der Themen | Tmax (h) | t½ (h) | CL/F (ml/min/kg) |
| Alter 10 Monate bis 5,3 Jahre | ||||
| Probanden, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmena | 10 | 3.0 (1.0-5.9) | 7.7 (5.7-11.4) | 3.62 (2.44-5.28) |
| Probanden, die Antiepileptika einnehmen, ohne dass die scheinbare Clearance von Lamotrigin bekannt ist | 7 | 5.2 (2.9-6.1) | 19.0 (12.9-27.1) | 1.2 (0,75-2,42) |
| Probanden, die nur Valproat einnehmen | 8 | 2.9 (1.0-6.0) | 44.9 (29,5-52.5) | 0.47 (0,23-0,77) |
| Alter 5-11 Jahre | ||||
| Probanden, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmena | 7 | 1.6 (1.0-3.0) | 7.0 (3.8-9.8) | 2.54 (1,35-5,58) |
| Probanden, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmena Plus Valproate | 8 | 3.3 (1.0-6.4) | 19.1 (7.0-31.2) | 0.89 (0,39-1,93) |
| Probanden, die nur Valproat einnehmenb | 3 | 4.5 (3.0-6.0) | 65.8 (50.7-73.7) | 0.24 (0,21-0,26) |
| Alter 13-18 Jahre | ||||
| Probanden, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmena | 11 | -c | -c | 1.3 |
| Probanden, die Carbamazepin -Phenytoin -Phenobarbital oder Primidon einnehmena Plus Valproate | 8 | -c | -c | 0.5 |
| Probanden, die nur Valproat einnehmen | 4 | -c | -c | 0.3 |
| a Carbamazepin phable phenobarbital and primidone have been shown to increase the apparent clearance of Lamotrigin. Estrogen-containing oral contraceptives rifampin and the protease inhibitors lopinavir/ritonavir and atazanavir/ritonavir have also been shown to increase the apparent clearance of lamotrigine [sehen Wechselwirkungen mit Arzneimitteln ]. b Zwei Probanden wurden in die Berechnung des mittleren Tmax einbezogen. c Parameter nicht geschätzt. |
Geriatrische Patienten
Die Pharmakokinetik von Lamotrigin nach einer einzelnen 150-mg-Dosis Lamotrigin wurde bei 12 älteren Freiwilligen zwischen 65 und 76 Jahren bewertet (mittlere Kreatinin-Clearance = 61 ml/min Bereich: 33 bis 108 ml/min). Die mittlere Halbwertszeit von Lamotrigin bei diesen Probanden betrug 31,2 Stunden (Bereich: 24,5 bis 43,4 Stunden) und die mittlere Clearance 0,40 ml/min/kg (Bereich: 0,26 bis 0,48 ml/min/kg).
Männliche und weibliche Patienten
Die Clearance von Lamotrigin wird nicht vom Geschlecht beeinflusst. Während der Dosis Eskalation von Lamotrigin in 1 klinischer Studie bei Patienten mit Epilepsie bei einer stabilen Dosis von Valproat (n = 77) waren die mittleren Trough -Lamotrigin -Konzentrationen für Gewicht bei den Frauen bei Männern bei Männern bei Männern jedoch bei Männern nicht mehr angepasst.
Rassistische oder ethnische Gruppen
Die scheinbare orale Clearance von Lamotrigin war bei Nichtkaukasiern 25% niedriger als Kaukasier.
Clinical Studies
Epilepsie
Monotherapie With Lamictal In Erwachsene With Partial-Onset Seizures Already Receiving Treatment With Carbamazepin Phable Phenobarbital Or Primidone As The Single Antiepileptic Arzneimittel
Die Wirksamkeit der Monotherapie mit Lamictal wurde in einer multizentrischen doppelblinden klinischen Studie festgelegt, in der 156 ambulante Patienten mit partiellen Anfällen eingeschrieben sind. Bei den Patienten lernte während der 2 aufeinanderfolgenden 4-wöchigen Zeiträume mindestens 4 einfache partielle teilweise partielle und/oder sekundär verallgemeinerte Anfälle auf, während er während der Basislinie Carbamazepin oder Phenytoin-Monotherapie erhielt. Lamictal (Zieldosis von 500 mg/Tag) oder Valproat (1000 mg/Tag) wurde über einen Zeitraum von 4 Wochen entweder zu Carbamazepin oder Phenytoin-Monotherapie gegeben. Die Patienten wurden dann in den nächsten 4 Wochen mit Lamictal oder Valproat in eine Monotherapie umgewandelt und dann für einen weiteren Zeitraum von 12 Wochen fortgesetzt.
Versuchendpunkte waren die Abschluss aller Wochen der Versuchsbehandlung oder erfüllten ein Fluchtkriterium. Die Kriterien für die Flucht im Verhältnis zur Ausgangsgrenze waren: (1) Verdoppelung der durchschnittlichen monatlichen Anfallszahl (2) Verdoppelung der höchsten 2-Tage-Anfallsfrequenz (3) Entstehung eines neuen Anfallstyps (definiert als eine Anfalls, die während der 8-wöchigen Basislinie nicht als Anfallsanschlag auftrat), bei der während der Studienbehandlung eine größere Ansiedlung auftritt. Die primäre Wirksamkeitsvariable war der Anteil der Patienten in jeder Behandlungsgruppe, die sich mit Fluchtkriterien erfüllten.
Die Prozentsätze der Patienten, die sich mit Fluchtkriterien erfüllten, betrugen 42% (32/76) in der Gruppe, die Lamictal erhielt, und 69% (55/80) in der Valproate -Gruppe. Der Unterschied im Prozentsatz der Patienten, die die Fluchtkriterien erfüllen, war statistisch signifikant (p = 0,0012) zugunsten von Lamictal. Es wurden keine Unterschiede in der Wirksamkeit auf der Grundlage des Altersgeschlechts oder der Rasse festgestellt.
Patienten in der Kontrollgruppe wurden absichtlich mit einer relativ geringen Dosis von Valproat behandelt. Als solches bestand das einzige Ziel dieser Studie darin, die Wirksamkeit und Sicherheit der Monotherapie mit Lamictal zu demonstrieren und kann nicht interpretiert werden, um die Überlegenheit von Lamictal gegenüber einer angemessenen Dosis von Valproat zu implizieren.
Zusatztherapie With Lamictal In Erwachsene With Partial-Onset Seizures
Die Wirksamkeit von Lamictal als zusätzliche Therapie (zu anderen AEDs) wurde zunächst in 3 entscheidenden multizentrischen placebokontrollierten doppelblinden klinischen Studien bei 355 Erwachsenen mit refraktärem partiellem Anfall festgelegt. Die Patienten hatten eine Anamnese von mindestens 4 partiellen Anfällen pro Monat, obwohl sie 1 oder mehr AEDs in therapeutischen Konzentrationen erhalten hatten, und in 2 der Studien wurden an ihrem etablierten AED-Regime während der Baselinien, die zwischen 8 und 12 Wochen variierten, beobachtet. In der dritten Studie wurden Patienten nicht in einer prospektiven Basis beobachtet. Bei Patienten, die weiterhin mindestens 4 Anfälle pro Monat während des Basis -Lamictal oder Placebo haben, wurden dann der vorhandenen Therapie hinzugefügt. In allen 3 Versuchen, die sich von der Anfallsfrequenz von der Basislinie ändern, war das Hauptmaß für die Wirksamkeit. Die nachstehend angegebenen Ergebnisse sind für alle partiellen Beschlagnahmen in der Absicht, in der Intent-to-Treat-Population (alle Patienten, die mindestens 1 Dosis einer Behandlung erhalten haben) in jeder Studie zu tun, sofern nicht anders angegeben. Die mittlere Anfallsfrequenz zu Studienbeginn betrug 3 pro Woche, während der Mittelwert zu Studienbeginn bei allen Patienten, die in Wirksamkeitsstudien eingeschlossen waren, 6,6 pro Woche betrug.
Ein Versuch (n = 216) war eine doppelblinde, placebokontrollierte parallele Studie, die aus einer 24-wöchigen Behandlungszeit bestand. Die Patienten konnten nicht mehr als 2 andere Antikonvulsiva haben und Valproat war nicht erlaubt. Die Patienten erhielten randomisiert, um Placebo eine Zieldosis von 300 mg/Tag Lamictal oder eine Zieldosis von 500 mg/Tag Lamictal zu erhalten. Die mediane Verringerung der Häufigkeit aller partiellen Anfälle im Vergleich zu Ausgangswert betrug 8% bei Patienten, die bei Patienten, die 300 mg/Tag Lamictal erhielten, Placebo 20% und bei Patienten, die 500 mg/Tag Lamictal erhalten, 36% erhielten. Die Verringerung der Anfallsfrequenz war in der 500-mg/Tages-Gruppe statistisch signifikant im Vergleich zur Placebo-Gruppe, jedoch nicht in der Gruppe von 300 mg/Tages.
Eine zweite Studie (n = 98) war eine doppelblinde, placebokontrollierte randomisierte Crossover-Studie, die aus zwei 14-wöchigen Behandlungszeiten (die die letzten 2 Wochen bestand, die aus einer Dosisverjüngung bestand), die durch eine 4-wöchige Auswaschzeit getrennt war. Die Patienten konnten nicht mehr als 2 andere Antikonvulsiva haben und Valproat war nicht erlaubt. Die Zieldosis von Lamictal betrug 400 mg/Tag. Als die ersten 12 Wochen der Behandlungszeiträume analysiert wurden<0.001).
Die dritte Studie (n = 41) war eine doppelblinde placebokontrollierte Crossover-Studie, die aus zwei 12-wöchigen Behandlungszeiten bestand, die durch eine 4-wöchige Auswaschzeit getrennt waren. Die Patienten konnten nicht mehr als 2 andere Antikonvulsiva haben. Dreizehn Patienten befanden sich auf einem gleichzeitigen Valproat; Diese Patienten erhielten 150 mg/Tag Lamictal. Die 28 anderen Patienten hatten eine Zieldosis von 300 mg/Tag Lamictal. Die mediane Änderung der Anfallsfrequenz war eine Verringerung der Lamictal im Vergleich zu Placebo (P.<0.01).
Es wurden keine Unterschiede in der Wirksamkeit auf der Grundlage des Altersgeschlechts oder der Rasse gemessen, gemessen durch Veränderungen der Anfallsfrequenz.
Zusatztherapie With Lamictal In Pädiatrische Patienten With Partial-Onset Seizures
Die Wirksamkeit von Lamictal als zusätzliche Therapie bei pädiatrischen Patienten mit partiellen Anfällen wurde in einer multizentrischen Doppelblind-Placebokontrollstudie bei 199 Patienten im Alter von 2 bis 16 Jahren festgelegt (n = 98 auf Lamictal N = 101 auf Placebo). Nach einer 8-wöchigen Basisphase wurden die Patienten auf 18 Wochen Behandlung mit Lamictal oder Placebo randomisiert zu ihrem derzeitigen AED-Regime von bis zu 2 Medikamenten. Die Patienten wurden auf der Grundlage des Körpergewichts und des Valproat -Gebrauchs dosiert. Die Zieldosen wurden für Patienten, die Valproat einnahmen (maximale Dosis: 250 mg/Tag) und 15 mg/kg/Tag für die Patienten, die nicht Valproat einnehmen (maximale Dosis: 750 mg/Tag), ca. Der primäre Wirksamkeitsendpunkt war die prozentuale Veränderung gegenüber dem Ausgangswert bei allen partiellen Anfällen. Für die Absicht, die Bevölkerung zu behandeln<0.01).
Zusatztherapie With Lamictal In Pediatric And Adult Patients With Lennox-Gastaut Syndrome
Die Wirksamkeit von Lamictal als zusätzliche Therapie bei Patienten mit Lennox-Gastaut-Syndrom wurde in einer multizentrischen doppelblinden placebokontrollierten Studie bei 169 Patienten im Alter von 3 bis 25 Jahren festgelegt (n = 79 auf Lamictal n = 90 auf Placebo). Nach einer 4-wöchigen Einblind-Placebo-Phase wurden die Patienten auf 16 Wochen Behandlung mit Lamictal oder Placebo randomisiert, das zu ihrem derzeitigen AED-Regime von bis zu 3 Arzneimitteln hinzugefügt wurde. Die Patienten wurden auf einem festgelegten Regime mit festem Dosis verlegt, das auf Körpergewicht und Valproat verwendet wurde. Die Zieldosen wurden für Patienten, die Valproat einnahmen (maximale Dosis: 200 mg/Tag) und 15 mg/kg/Tag für Patienten, die nicht Valproat einnehmen (maximale Dosis: 400 mg/Tag), ungefähr 5 mg/kg/Tag (maximale Dosis: 400 mg/Tag) ca. Der primäre Wirksamkeitsendpunkt war die prozentuale Veränderung gegenüber dem Ausgangswert bei großen motorischen Anfällen (atonic tonic myoklonische und Tonic-Clonic-Anfälle). Für die Intent-to-Treat-Population betrug die mediane Reduzierung der motorischen Anfälle bei Patienten bei Patienten, die mit Lamictal behandelt wurden, und 9% auf Placebo einen Unterschied, der statistisch signifikant war<0.05). Drop attacks were significantly reduced by Lamictal (34%) compared with placebo (9%) as were tonic-clonic seizures (36% reduction versus 10% increase for Lamictal and placebo respectively).
Zusatztherapie With Lamictal In Pediatric And Adult Patients With Primary Allgemeinized Tonic-Clonic Seizures
Die Wirksamkeit von Lamictal als zusätzliche Therapie bei Patienten mit PGTC-Anfällen wurde in einer multizentrischen Doppelblind-Placebokontrollstudie bei 117 pädiatrischen und erwachsenen Patienten ab 2 Jahren (n = 58 auf Lamictal n = 59 auf Placebo) festgelegt. Patienten mit mindestens 3 PGTC-Anfällen während einer 8-wöchigen Basisphase wurden auf 19 bis 24 Wochen Behandlung mit Lamictal oder Placebo randomisiert, das zu ihrem derzeitigen AED-Regime von bis zu 2 Medikamenten hinzugefügt wurde. Die Patienten wurden mit einem festgelegten Regime mit Zieldosen von 3 bis 12 mg/kg/Tag für pädiatrische Patienten und von 200 bis 400 mg/Tag für erwachsene Patienten, die auf begleitenden AEDs basieren, verabreicht.
Der primäre Wirksamkeitsendpunkt war die prozentuale Veränderung gegenüber dem Ausgangswert bei PGTC -Anfällen. Bei der Absicht, die Bevölkerung zu behandeln, betrug die durchschnittliche prozentuale Verringerung der PGTC-Anfälle bei Patienten, die mit Lamictal behandelt wurden, und 34% auf Placebo-Ein-Differenz, der statistisch signifikant war (P = 0,006).
Bipolare Störung
Erwachsene
Die Wirksamkeit von Lamictal bei der Erhaltung der bipolaren I-Störung wurde in 2 multizentrischen doppelblinden placebokontrollierten Studien bei erwachsenen Patienten (im Alter von 18 bis 82 Jahren) festgelegt, die die DSM-IV-Kriterien für die bipolare I-Störung erfüllten. In Studie 1 wurden Patienten mit einer aktuellen oder jüngsten (innerhalb von 60 Tagen) depressiven Episode gemäß DSM-IV und Studie 2 eingeschlossen, die Patienten mit einer aktuellen oder aktuellen (innerhalb von 60 Tagen) Folge von Manie oder Hypomanie gemäß DSM-IV definiert wurden. Beide Studien umfassten eine Kohorte von Patienten (30% der 404 Probanden in Studie 1 und 28% der 171 Patienten in Studie 2) mit einer schnellen bipolaren Störung des Zyklus (4 bis 6 Episoden pro Jahr).
In beiden Studien wurden die Patienten zu einer Zieldosis von 200 mg Lamictal als Add-On-Therapie oder als Monotherapie mit allmählichem Entzug psychotroper Medikamente während einer 8- bis 16-wöchigen offenen Zeitraummedikamente titriert. Insgesamt 81% von 1305 Patienten, die an der Open-Label-Periode teilnahmen, erhielten 1 oder mehr andere Psychopharmaka, darunter Benzodiazepine selektive Serotonin-Wiederaufnahmehemmer (SSRIS) atypischer Antipsychotika (einschließlich Olanzapin) Valproat oder Lithium während der Titration von Lamictal. Patienten mit einem CGI-Severity-Score von 3 oder weniger, die mindestens 4 kontinuierliche Wochen gehalten wurden, einschließlich mindestens der letzten Woche der Monotherapie mit Lamictal, wurden bis zu 18 Monate lang in eine placebokontrollierte Doppelblind-Behandlungszeit randomisiert. Der primäre Endpunkt war Zeit (Zeit für eine Intervention für eine Stimmungs -Episode oder eine Zeit, die Zeit für ein Abbruch für ein unerwünschtes Ereignis war, das als mit bipolarer Störung oder aus wirksamer Wirksamkeit in Verbindung gebracht wurde). Die Stimmungsepisode könnte Depression Mania Hypomania oder eine gemischte Episode sein.
In Studie erhielten 1 Patienten eine doppelblinde Monotherapie mit Lamictal 50 mg/Tag (n = 50) lamictal 200 mg/Tag (n = 124) Lamictal 400 mg/Tag (n = 47) oder Placebo (n = 121). Lamictal (200- und 400-mg/Tag-Behandlungsgruppen zusammen) war Placebo überlegen, um die Zeit auf das Auftreten einer Stimmungssepisode zu verzögern (Abbildung 1). Separate Analysen der Dosisgruppen von 200 und 400 mg/Tag ergaben keinen zusätzlichen Nutzen aus der höheren Dosis.
In Studie erhielten 2 Patienten eine doppelblinde Monotherapie mit Lamictal (100 bis 400 mg/Tag n = 59) oder Placebo (n = 70). Lamictal war Placebo in verzögerter Zeit überlegen, um eine Stimmungssepisode aufzustehen (Abbildung 2). Die mittlere Dosis Lamictal betrug ungefähr 211 mg/Tag.
Obwohl diese Studien nicht so konzipiert waren, dass die Zeit auf das Auftreten von Depressionen oder Manie separat bewertet wurde, ergab eine kombinierte Analyse für die beiden Studien einen statistisch signifikanten Nutzen für Lamictal über Placebo, um die Zeit auf das Auftreten von Depressionen und Manie zu verzögern, obwohl der Befund für Depressionen robuster war.
Abbildung 1: Kaplan-Meier-Schätzung des kumulativen Anteils der Patienten mit Stimmungs-Episode (Studie 1)
| |
Abbildung 2: Kaplan-Meier-Schätzung des kumulativen Anteils der Patienten mit Stimmungs-Episode (Studie 2)
| |
Patienteninformationen für Lamictal
Lamictal
(La-mik-tal) (Lamotrigin) Tabletten
Lamictal
(Lamotrigin-) Tabletten zur oralen Suspension
Lamictal ODT
(Lamotrigin) oral zerfetzen Tabletten
Was sind die wichtigsten Informationen, die ich über Lamictal wissen sollte?
1. Lamictal kann einen schweren Hautausschlag verursachen, der dazu führen kann, dass Sie ins Krankenhaus eingeliefert werden oder sogar zum Tod führen. Es gibt keine Möglichkeit zu erkennen, ob ein milder Ausschlag ernster wird. Ein schwerwiegender Hautausschlag kann jederzeit während Ihrer Behandlung mit Lamictal auftreten, ist jedoch in den ersten 2 bis 8 Wochen der Behandlung eher auftreten. Kinder und Jugendliche im Alter zwischen 2 und 17 Jahren haben eine höhere Chance, diesen ernsthaften Hautausschlag zu bekommen, während sie Lamictal einnehmen.
Das Risiko, einen schweren Hautausschlag zu bekommen, ist höher, wenn Sie:
- Nehmen Sie Lamictal, während Sie Valproat [Depaken (Valproinsäure) oder Depakote (Divalprox -Natrium) einnehmen].
- Nehmen Sie eine höhere Startdosis Lamictal als Ihr vorgeschriebener Gesundheitsdienstleister.
- Erhöhen Sie Ihre Dosis Lamictal schneller als vorgeschrieben.
Rufen Sie Ihren Gesundheitsdienstleister sofort an, wenn Sie Folgendes haben:
- ein Hautausschlag
- Blasenbildung oder Schälen Ihrer Haut
- Nesselsucht
- Schmerzhafte Wunden in Ihrem Mund oder um Ihre Augen
Diese Symptome können die ersten Anzeichen einer schwerwiegenden Hautreaktion sein. Ein Gesundheitsdienstleister sollte Sie untersuchen, um zu entscheiden, ob Sie weiterhin Lamictal einnehmen sollten.
2. Andere schwerwiegende Reaktionen, einschließlich schwerwiegender Blutprobleme oder Leberprobleme. Lamictal can also cause other types of allergic reactions or serious problems that may affect organs and other parts of your body like your liver or blood cells. You may or may not have a Ausschlag with these types of reactions. Call your healthcare provider right away if you have any of these symptoms:
- Fieber
- Häufige Infektionen
- Schwere Muskelschmerzen
- Schwellung Ihrer Gesichtsaugen Lippen oder Zunge
- Geschwollene Lymphdrüsen
- ungewöhnliche Blutergüsse oder Blutungen, die blass aussehen
- Schwäche fatigue
- vergilbt Ihrer Haut oder des weißen Teils Ihrer Augen
- Probleme beim Gehen oder Sehen
- Anfälle zum ersten Mal oder häufiger vorkommen
- Schmerzen und/oder Zärtlichkeit im Bereich bis zur Spitze Ihres Magens (vergrößerte Leber und/oder Milz)
3. Bei Patienten mit bekannten Herzproblemen kann der Einsatz von Lamictal zu einem schnellen Herzschlag führen. Rufen Sie Ihren Gesundheitsdienstleister sofort an, wenn Sie:
Was wird TribeZor verwendet, um es zu behandeln?
- einen schnellen langsamen oder pochenden Herzschlag haben.
- Fühle dein Herz über einen Schlag.
- Atemnot haben.
- Brustschmerzen haben.
- fühle mich benommen.
4. Wie andere Antiepileptika können Lamictal in einer sehr geringen Anzahl von Menschen um 1 zu 500 Selbstmordgedanken oder Handlungen verursachen.
Rufen Sie sofort einen Gesundheitsdienstleister an, wenn Sie eines dieser Symptome haben, insbesondere wenn sie neu sind, oder Sie besorgen Sie:
- Gedanken über Selbstmord oder Sterben
- Versuch, Selbstmord zu begehen
- Neue oder schlechtere Depression
- Neue oder schlechtere Angst
- aufgeregt oder unruhig fühlen
- Panikattacken
- Probleme beim Schlafen (Schlaflosigkeit)
- Neue oder schlechtere Reizbarkeit
- aggressiv handeln, wütend oder gewalttätig zu sein
- auf gefährliche Impulse wirken
- Eine extreme Zunahme von Aktivität und Reden (Manie)
- Andere ungewöhnliche Verhaltensänderungen in Verhalten oder Stimmung
Halten Sie Lamictal nicht auf, ohne zuerst mit einem Gesundheitsdienstleister zu sprechen.
- Lamictal zu stoppen kann plötzlich schwerwiegende Probleme verursachen.
- Selbstmordgedanken oder Handlungen können durch andere Dinge als Medikamente verursacht werden. Wenn Sie Selbstmordgedanken oder Handlungen haben, kann Ihr Gesundheitsdienstleister nach anderen Ursachen überprüfen.
Wie kann ich nach frühen Symptomen von Selbstmordgedanken und Handlungen in mir oder einem Familienmitglied achten?
- Achten Sie auf Änderungen, insbesondere plötzliche Veränderungen im Stimmungsverhalten Gedanken oder Gefühle.
- Führen Sie alle Follow-up-Besuche bei Ihrem Gesundheitsdienstleister wie geplant.
- Rufen Sie Ihren Gesundheitsdienstleister zwischen den Besuchen nach Bedarf an, insbesondere wenn Sie sich Sorgen um Symptome machen.
5. Lamictal kann eine schwere Entzündung der Schutzmembran zu einer aseptischen Meningitis zu einer schweren Entzündung der Hirn und des Rückenmarks verursachen.
Rufen Sie Ihren Gesundheitsdienstleister sofort an, wenn Sie eines der folgenden Symptome haben:
- Kopfschmerzen
- Fieber
- Brechreiz
- Erbrechen
- steifer Hals
- Ausschlag
- ungewöhnliche Empfindlichkeit gegenüber Licht
- Muskelschmerzen
- Schüttelfrost
- Verwirrung
- Schläfrigkeit
Meningitis hat viele andere Ursachen als Lamictal, auf die Ihr Arzt nachsehen würde, wenn Sie eine Meningitis entwickeln, während Sie Lamictal einnehmen.
Lamictal can cause other serious side effects. Weitere Informationen finden Sie in Ihrem Gesundheitsdienstleister oder Apotheker. Sagen Sie Ihrem Gesundheitsdienstleister, wenn Sie einen Nebeneffekt haben, der Sie stört. Lesen Sie unbedingt den folgenden Abschnitt mit dem Titel Was sind die möglichen Nebenwirkungen von Lamictal?
6. Menschen verschrieben Lamictal haben manchmal die falsche Medizin erhalten, da viele Medikamente Namen ähnlich wie Lamictal haben, also überprüfen Sie immer, ob Sie Lamictal erhalten.
Das Einnehmen falscher Medikamente kann schwerwiegende Gesundheitsprobleme verursachen. Wenn Ihr Gesundheitsdienstleister Ihnen ein Rezept für Lamictal gibt:
- Stellen Sie sicher, dass Sie es klar lesen können.
- Sprechen Sie mit Ihrem Apotheker, um zu überprüfen, ob Sie das richtige Medikament erhalten.
- Überprüfen Sie jedes Mal, wenn Sie Ihr Rezept füllen, die Tablets, die Sie an den Bildern der folgenden Tablets erhalten.
Diese Bilder zeigen die ausgeprägten Formulierungsfarben und Formen der Tabletten, die dazu beitragen, die richtige Stärke von Lamictal -Tabletten -Tabletten für die mündliche Suspension und die mündliche Auflösungstabletten zu identifizieren. Rufen Sie Ihren Apotheker sofort an, wenn Sie ein Lamictal -Tablet erhalten, das nicht wie eines der unten gezeigten Tablets aussieht, da Sie möglicherweise die falschen Medikamente erhalten haben.
Lamictal (lamotrigine) tablets
| |
Lamictal (Lamotrigin-) Tabletten zur oralen Suspension
| |
Lamictal ODT (Lamotrigin) oral zerfetzen Tabletten
| |
Was ist Lamictal?
- Lamictal is a prescription medicine used:
- zusammen mit anderen Medikamenten zur Behandlung bestimmter Arten von Anfällen (partielle Anfälle primärer verallgemeinerter tonic-klonischer Anfälle verallgemeinerten Anfällen des Lennox-Gastaut-Syndroms) bei Menschen ab 2 Jahren.
- allein bei der Wechsel von 1 anderen Medikamenten zur Behandlung von teilweise einsetzenden Anfällen bei Menschen ab 16 Jahren.
- Für die langfristige Behandlung der bipolaren I-Störung, um die Zeit zwischen Stimmungs-Episoden bei Menschen zu verlängern, die mit anderen Medikamenten wegen Stimmungs Episoden behandelt wurden.
- Es ist nicht bekannt, ob Lamictal bei Menschen unter 18 Jahren mit Stimmungs Episoden wie bipolarer Störung oder Depression sicher oder wirksam ist.
- Es ist nicht bekannt, ob Lamictal sicher oder wirksam ist, wenn sie allein als erste Behandlung von Anfällen verwendet wird.
- Es ist nicht bekannt, ob Lamictal für Menschen mit Stimmungs -Episoden, die noch nicht mit anderen Medikamenten behandelt wurden, sicher oder wirksam ist.
- Lamictal should not be used for acute treatment of manic or mixed mood episodes.
Nehmen Sie nicht Lamictal:
- Wenn Sie eine allergische Reaktion auf Lamotrigin oder gegen eine der inaktiven Inhaltsstoffe in Lamictal hatten. Eine vollständige Liste von Zutaten in Lamictal finden Sie im Ende dieser Flugblatt.
Bevor Sie Lamictal einnehmen, teilen Sie Ihrem Gesundheitsdienstleister alle Ihre Gesundheitszustände mit, einschließlich dessen, ob Sie:
- Habe eine Hautausschlag oder allergische Reaktion auf eine andere Antiseizure -Medizin gehabt.
- Depressionen Stimmungsprobleme oder Selbstmordgedanken oder Verhalten hatten.
- Haben Sie eine Vorgeschichte von Herzproblemen oder unregelmäßigen Herzschlägen oder eines Ihrer Familienmitglieder haben Herzprobleme, einschließlich genetischer Anomalien.
- hatten eine aseptische Meningitis nach Einnahme von Lamictal- oder Lamictal XR (Lamotrigin).
- nehmen östrogenhaltige Produkte wie orale Kontrazeptiva (Antibabypillen) oder andere weibliche hormonelle Medikamente (wie Hormonersatztherapie) ein. Beginnen Sie nicht oder hören Sie auf, Antibabypillen oder andere weibliche hormonelle Medizin zu nehmen, bis Sie mit Ihrem Gesundheitsdienstleister gesprochen haben. Teilen Sie Ihrem Gesundheitsdienstleister mit, ob Sie Änderungen in Ihrem Menstruationsmuster wie Durchbruchblutungen haben. Das Anhalten dieser Medikamente während der Einnahme von Lamictal kann Nebenwirkungen verursachen (z. B. Schwindelmangel an Koordination oder doppeltem Sehen). Das Starten dieser Medikamente kann verringern, wie gut lamictal funktioniert.
- sind schwanger oder planen, schwanger zu werden. Es ist nicht bekannt, ob Lamictal Ihrem ungeborenen Baby schaden kann. Wenn Sie schwanger werden, während Sie Lamictal mit Ihrem Gesundheitsdienstleister über die Registrierung mit dem nordamerikanischen Antiepileptika -Schwangerschaftsregister sprechen. Sie können sich in dieser Registrierung unter 1-888-233-2334 anmelden. Der Zweck dieses Registers ist es, Informationen über die Sicherheit von Antiepileptika während der Schwangerschaft zu sammeln.
- stillen. Lamictal geht in Muttermilch über und kann bei einem gestillten Baby Nebenwirkungen verursachen. Wenn Sie stillen, während Sie Lamictal einnehmen, beobachten Sie Ihr Baby genau, um Schwierigkeiten zu unterhalten, wie sie vorübergehend die Atmung des Atmens oder das schlechte Saugen einhalten. Rufen Sie den Gesundheitsdienstleister Ihres Babys sofort an, wenn Sie eines dieser Probleme sehen. Sprechen Sie mit Ihrem Gesundheitsdienstleister darüber, wie Sie Ihr Baby am besten füttern können, wenn Sie Lamictal einnehmen.
Teilen Sie Ihrem Gesundheitsdienstleister über alle Medikamente, die Sie einnehmen einschließlich verschreibungspflichtiger und rezeptfreier Medikamente Vitamine und Kräuterpräparate. Lamictal und bestimmte andere Medikamente können miteinander interagieren.
Dies kann schwerwiegende Nebenwirkungen verursachen.
Kennen Sie die Medikamente, die Sie einnehmen. Halten Sie eine Liste von ihnen, um Ihren Gesundheitsdienstleister und Apotheker zu zeigen, wenn Sie ein neues Medikament erhalten.
Wie soll ich Lamictal einnehmen?
- Nehmen Sie Lamictal genau wie vorgeschrieben.
- Ihr Gesundheitsdienstleister kann Ihre Dosis ändern. Ändern Sie Ihre Dosis nicht, ohne mit Ihrem Gesundheitsdienstleister zu sprechen.
- Hören Sie nicht auf, Lamictal einzunehmen, ohne mit Ihrem Gesundheitsdienstleister zu sprechen. Lamictal zu stoppen kann plötzlich schwerwiegende Probleme verursachen. Wenn Sie beispielsweise Epilepsie haben und aufhören, Lamictal plötzlich zu nehmen, haben Sie möglicherweise Anfälle, die nicht aufhören. Sprechen Sie mit Ihrem Gesundheitsdienstleister darüber, wie Sie Lamictal langsam stoppen können.
- Wenn Sie eine Dosis Lamictal verpassen, nehmen Sie es sobald Sie sich erinnern. Wenn es fast Zeit für Ihre nächste Dosis ist, überspringen Sie einfach die verpasste Dosis. Nehmen Sie die nächste Dosis zu Ihrer regulären Zeit. Nehmen Sie keine 2 Dosen gleichzeitig.
- Wenn Sie zu viel lamictal nehmen, rufen Sie Ihren Gesundheitsdienstleister oder Ihr örtliches Giftkontrollzentrum an oder gehen Sie sofort in die nächstgelegene Notaufnahme des Krankenhauses.
- Möglicherweise spüren Sie mehrere Wochen lang nicht die volle Wirkung von Lamictal.
- Wenn Sie Epilepsie haben, teilen Sie Ihrem Gesundheitsdienstleister, wenn sich Ihre Anfälle verschlimmern oder wenn Sie neue Arten von Anfällen haben.
- Lamictal Tabletten Ganze schlucken.
- Wenn Sie Probleme haben, Lamictal -Tabletten zu schlucken, teilen Sie Ihrem Gesundheitsdienstleister mit, da es möglicherweise eine andere Form von Lamictal gibt, die Sie annehmen können.
- Lamictal ODT should be placed on the tongue and moved around the mouth. The tablet will rapidly disintegrate can be swallowed with or without water and can be taken with or without food.
- Lamictal tablets for oral suspension may be swallowed whole chewed or mixed in water or fruit juice mixed withwater. If the tablets are chewed drink a small amount of water or fruit juice mixed with water to help in swallowing. To break up Lamictal tablets for oral suspension add the tablets to a small amount of liquid (1 teaspoon or enough to cover the medicine) in a glass or spoon. Wait at least 1 minute or until the tablets are completely broken up mix the solution together and take the whole amount right away.
- Wenn Sie Lamictal in einem Blasenpaket erhalten, untersuchen Sie das Blisterpaket vor dem Gebrauch. Verwenden Sie nicht, wenn Blasen zerrissen oder fehlt.
Was soll ich vermeiden, während ich Lamictal einnehme?
Fahren Sie nicht mit Maschinen oder führen Sie andere gefährliche Aktivitäten durch, bis Sie wissen, wie sich Lamictal auf Sie auswirkt.
Was sind die möglichen Nebenwirkungen von Lamictal?
Lamictal can cause serious side effects.
Sehen Sie, was die wichtigsten Informationen über Lamictal sind?
Zu den häufigen Nebenwirkungen von Lamictal gehören:
- Schwindel
- Schläfrigkeit
- Tremor
- Rückenschmerzen
- Kopfschmerzen
- Brechreiz Erbrechen
- Ausschlag
- Durchfall
- verschwommener oder doppelter Sehen
- Müdigkeit
- Fieber
- Schlaflosigkeit
- Mangel an Koordination
- Trockener Mund
- abdominal pain
- verstopfte Nase
- Infektionen einschließlich saisonaler Grippe
- Halsschmerzen
Dies sind nicht alle möglichen Nebenwirkungen von Lamictal.
Rufen Sie Ihren Arzt an, um medizinische Beratung zu Nebenwirkungen zu erhalten. Sie können die FDA bei 1-800-FDA-1088 Nebenwirkungen melden.
Wie soll ich Lamictal aufbewahren?
- Lamictal bei Raumtemperatur zwischen 68 ° F und 77 ° F (25 ° C) aufbewahren.
Halten Sie Lamictal und alle Medikamente außerhalb der Reichweite der Kinder.
Allgemein information about the safe and effective use of Lamictal.
Medikamente werden manchmal für andere Zwecke als die in einem Medikamentenhandbuch aufgeführten Zwecke verschrieben. Verwenden Sie Lamictal nicht für eine Erkrankung, für die es nicht verschrieben wurde. Geben Sie anderen Menschen nicht Lamictal, auch wenn sie die gleichen Symptome haben, die Sie haben. Es kann ihnen schaden.
Wenn Sie einen Urin -Arzneimittel -Screening -Test einnehmen, kann Lamictal das Testergebnis positiv für ein anderes Medikament machen. Wenn Sie einen Urin -Arzneimittel -Screening -Test benötigen, geben Sie dem medizinischen Fachmann mit, dass Sie den Test durchführen, den Sie Lamictal durchführen.
Sie können Ihren Gesundheitsdienstleister oder Apotheker um Informationen zu Lamictal bitten, die für Angehörige der Gesundheitsberufe geschrieben wurden.
Was sind die Zutaten in Lamictal?
Lamictal tablets
Wirkstoff: Lamotrigin.
Inaktive Zutaten: Laktose; Magnesiumstearat mikrokristallin Cellulose -Povidon -Natriumstärkeglykolat FD
Lamictal tablets for oral suspension
Wirkstoff: Lamotrigin.
Inaktive Zutaten: Schwarzjäger-Geschmack Calciumcarbonat niedrig substituiertes Hydroxypropylcellulose-Magnesium-Aluminium-Silikat-Magnesium-Stearat-Povidon-Saccharin-Natrium und Natriumstärkglykolat.
Lamictal ODT orally disintegrating tablets
Wirkstoff: Lamotrigin.
Inaktive Zutaten: künstlicher Kirschgeschmack Crospovidon Ethylcellulose Magnesium Stearat Mannitol Polyethylen und Sucralose.
Dieser Medikamentenführer wurde von der US -amerikanischen Food and Drug Administration genehmigt