Nolvadex
Die Informationen Auf Dieser Website Stellen Keine Medizinische Beratung Dar. Wir Verkaufen Nichts. Die Richtigkeit Der Übersetzung Wird Nicht Garantiert. Haftungsausschluss
Drogenzusammenfassung
Was ist Nolvadex?
Nolvadex (Tamoxifen Citrat) ist ein nichtsteroidales Antiöstrogen zur Behandlung von Brustkrebs, das sich auf andere Körperteile (metastasierter Brustkrebs) ausgebreitet hat, um Brustkrebs bei bestimmten Patienten nach Operation und Strahlentherapie zu behandeln und die Wahrscheinlichkeit von Brustkrebs bei Hochrisikopatienten zu verringern.
Was sind Nebenwirkungen von Nolvadex?
Zu den häufigen Nebenwirkungen von Nolvadex gehören:
- Hitzewallungen
- spülen
- Änderungen der Menstruationsperioden
- Brechreiz
- Beinkrämpfe
- Bauchkrämpfe
- Knochenschmerzen
- Muskelschmerzen
- Husten
- Schwellung
- Ermüdung
- Haarverdünnung
- Kopfschmerzen
- Depression und
- Verlust von sexuellen Fähigkeiten/Interessen (bei Männern).
Sagen Sie Ihrem Arzt, ob Sie unwahrscheinlich, aber ernsthafte Nebenwirkungen von Nolvadex haben, einschließlich:
- Sehveränderungen (z. B. verschwommenes Sehen)
- Augenschmerzen
- einfache Blutergüsse oder Blutungen
- Mental/Stimmungsänderungen
- Schwellung of ankles or feet or
- ungewöhnliche Müdigkeit.
Dosierung für Nolvadex
Die empfohlene tägliche Dosis von Nolvadex bei Patienten mit Brustkrebs beträgt 20-40 mg pro Tag in Tablettenform.
Welche Medikamentensubstanzen oder Nahrungsergänzungsmittel interagieren mit Nolvadex?
Nolvadex kann mit Antikoagulanzien vom Cumarin-Typ Anastrozol Rifampin Aminoglutethimid Phenobarbital Rifampin Bromociptine SSRI-Antidepressiva und Cimeditdin interagieren. Sagen Sie Ihrem Arzt alle Medikamente und Nahrungsergänzungsmittel, die Sie verwenden.
Nolvadex während der Schwangerschaft und Stillen
Es kann Risiken für den Fötus bestehen, wenn Nolvadex von schwangeren Frauen eingenommen wird. Der Nutzen des Arzneimittels kann jedoch trotz der potenziellen Risiken seinen Einsatz rechtfertigen. Es wurde berichtet, dass Nolvadex die Laktation hemmt. Es ist nicht bekannt, ob das Medikament durch die Muttermilch geleitet wird, sondern aufgrund der potenziellen Risiken für die Fötus -Frauen, die Nolvadex einnehmen, sollten nicht stillen.
Weitere Informationen
Unser Nolvadex -Nebenwirkungen Arzneimittelzentrum bietet einen umfassenden Überblick über die verfügbaren Arzneimittelinformationen über die potenziellen Nebenwirkungen bei der Einnahme dieses Medikaments.
FDA -Drogeninformationen
- Drogenbeschreibung
- Indikationen
- Dosierung
- Nebenwirkungen
- Wechselwirkungen mit Arzneimitteln
- Warnungen
- Vorsichtsmaßnahmen
- Überdosis
- Klinische Pharmakologie
- Medikamentenhandbuch
WARNUNG
Für Frauen mit duktalem Karzinom in situ (DCIS) und Frauen mit hohem Brustkrebsrisiko: Zu den schwerwiegenden und lebensbedrohlichen Ereignissen, die mit Nolvadex (Tamoxifen Citrat) im Rahmen der Risikominderung (Frauen mit hohem Risiko für Krebs und Frauen mit DCIS) verbunden sind, gehören unternehmerische Malignitäten und Lungenembolie. Die Inzidenzraten für diese Ereignisse wurden aus der NSABP P-1-Studie geschätzt (siehe Klinische Pharmakologie- Klinische Studien - Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko Frauen ). Uterus-Malignitäten bestehen sowohl aus Endometriumadenokarzinomen (Inzidenzrate pro 1000 Frauenjahre von 2,20 für Nolvadex (Tamoxifen Citrat) gegenüber 0,71 für Placebo) als auch für Placebo) und für Uterussarkom (Inzidenzrate pro 1000 Frauenjahre von 0,17 für Nolvadex)*. Für Schlaganfall betrug die Inzidenzrate pro 1000 Frauenjahre 1,43 für Nolvadex (Tamoxifen Citrat) gegenüber 1,00 für Placebo **. Für die Lungenembolie betrug die Inzidenzrate pro 1000 Frauenjahre 0,75 für Nolvadex (Tamoxifen Citrat) gegenüber 0,25 für Placebo **.
Einige der Schlaganfälle der Lungenembolien und der Uterus -Malignitäten waren tödlich.
Gesundheitsdienstleister sollten die potenziellen Vorteile gegenüber den potenziellen Risiken dieser schwerwiegenden Ereignisse bei Frauen mit hohem Brustkrebsrisiko und Frauen mit DCIs unter Berücksichtigung von Nolvadex (Tamoxifen Citrat) erörtern, um ihr Risiko für die Entwicklung von Brustkrebs zu verringern.
Die Vorteile von Nolvadex (Tamoxifen Citrat) überwiegen seine Risiken bei Frauen, die bereits mit Brustkrebs diagnostiziert wurden.
Referenzen
*Aktualisierte Langzeit-Follow-up-Daten (die mediane Länge der Nachuntersuchung beträgt 6,9 Jahre) in der NSABP P-1-Studie. Sehen WARNUNGS : Auswirkungen auf den Uterus-Endometriumkrebs und den Uterussarkom .
** Siehe Tabelle 3 unter Klinische Pharmakologie- Klinische Studien .
Beschreibung für Nolvadex
Nolvadex® (Tamoxifen Citrat) Tabletten Ein nichtsteroidales Antiöstrogen dient zur oralen Verabreichung. Nolvadex (Tamoxifen Citrat) Tabletten sind als:
10 mg Tabletten
Jedes Tablet enthält 15,2 mg Tamoxifen -Citrat, was 10 mg Tamoxifen entspricht.
20 mg Tabletten
Jedes Tablet enthält 30,4 mg Tamoxifen -Citrat, was 20 mg Tamoxifen entspricht.
Inaktive Inhaltsstoffe: Carboxymethylcellulose Calcium Magnesium Stearat Mannitol und Stärke.
Chemisch Nolvadex (Tamoxifen Citrat) ist das Trans-Isomer eines Triphenylethylen-Derivats. Der chemische Name ist (z) 2- [4- (12-Diphenyl-1-butenyl) -Phänoxy-N-N-Dimethylethanamin 2 Hydroxy-123-PropanetricArboxylat (1: 1). Die strukturellen und empirischen Formeln sind:
 |
Tamoxifen -Citrat hat ein Molekulargewicht von 563,62 Das PKA 'beträgt 8,85 Die Gleichgewichtslöslichkeit in Wasser bei 37 ° C beträgt 0,5 mg/ml und in 0,02 n HCl bei 37 ° C 0,2 mg/ml.
Verwendung für Nolvadex
Metastasierter Brustkrebs
Nolvadex (Tamoxifen Citrat) ist bei der Behandlung von metastasiertem Brustkrebs bei Frauen und Männern wirksam. Bei prämenopausalen Frauen mit metastasiertem Brustkrebs Nolvadex (Tamoxifen Citrat) ist eine Alternative zur oophorektomischen oder ovarären Bestrahlung. Verfügbare Hinweise deuten darauf hin, dass Patienten, deren Tumoren Östrogenrezeptor positiv sind, mit größerer Wahrscheinlichkeit von der Nolvadex -Therapie (Tamoxifen -Citrat) profitieren.
Adjuvante Behandlung von Brustkrebs
Nolvadex (Tamoxifencitrat) ist für die Behandlung von Knotenpositiven Brustkrebs bei Frauen nach einer Gesamtmastektomie oder einer segmentalen Mastektomie-axillären Dissektion und Brustbestrahlung angezeigt. In einigen Nolvadex (Tamoxifen Citrat) studierten adjuvante Studien der größte Teil des bisherigen Nutzens in der Untergruppe mit vier oder mehr positiven axillären Knoten.
Nolvadex (Tamoxifen-Citrat) ist für die Behandlung von axillären Knoten-negativen Brustkrebs bei Frauen nach einer vollständigen Mastektomie oder einer segmentalen Mastektomie-axillären Dissektion und Brustbestrahlung angezeigt.
Die Östrogen- und Progesteron -Rezeptorwerte können helfen, vorherzusagen, ob die adjuvante nolvadex (Tamoxifen -Citrat) -Therapie wahrscheinlich vorteilhaft ist.
Nolvadex (Tamoxifencitrat) verringert das Auftreten von kontralateralem Brustkrebs bei Patienten, die eine adjuvante Nolvadex -Therapie (Tamoxifen Citrat) bei Brustkrebs erhalten.
Duktalkarzinom in situ (DCIS)
Bei Frauen mit DCIS nach Brustoperation und Strahlung Nolvadex (Tamoxifen Citrat) ist es angezeigt, dass das Risiko eines invasiven Brustkrebs verringert wird (siehe WARNUNG BOXED zu Beginn des Etiketts). Die Entscheidung über die Therapie mit Nolvadex (Tamoxifen Citrat) für die Verringerung der Inzidenz von Brustkrebs sollte auf einer individuellen Bewertung der Vorteile und Risiken der Nolvadex -Therapie (Tamoxifen -Citrat) beruhen.
Aktuelle Daten aus klinischen Studien unterstützen die fünf Jahre adjuvante Nolvadex -Therapie (Tamoxifen Citrat) bei Patienten mit Brustkrebs.
Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko
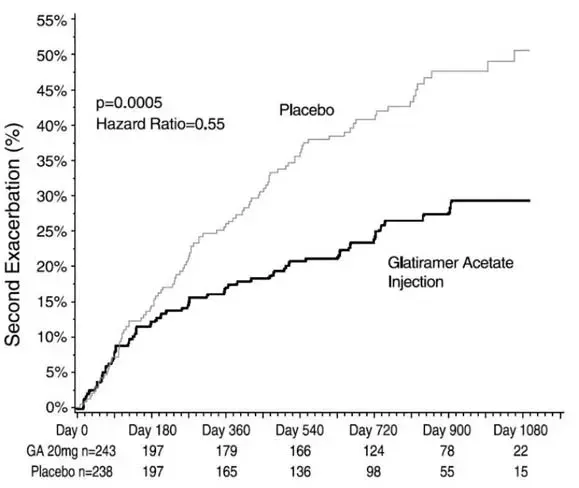
Nolvadex (Tamoxifen -Citrat) ist angezeigt, um die Inzidenz von Brustkrebs bei Frauen mit hohem Brustkrebsrisiko zu verringern. Dieser Effekt wurde in einer Studie von 5 Jahren geplanter Dauer mit einer mittleren Nachbeobachtungszeit von 4,2 Jahren gezeigt. 25 Prozent der Teilnehmer erhielten 5 Jahre lang Drogen. Die längerfristigen Effekte sind nicht bekannt. In dieser Studie gab es keinen Einfluss von Tamoxifen auf die Mortalität des Gesamt- oder Brustkrebs (siehe WARNUNG BOXED zu Beginn des Etiketts).
Nolvadex (Tamoxifen-Citrat) ist nur für Frauen mit hohem Risiko angezeigt. Ein hohes Risiko ist definiert als Frauen, die mindestens 35 Jahre alt sind, wobei ein 5-Jahres-Risiko für Brustkrebs ≥ 1,67%, wie durch das GAIL-Modell berechnet, berechnet wird.
Beispiele für Kombinationen von Faktoren, die ein 5-Jahres-Risiko von ≥ 1,67% vorhersagen, sind:
Alter 35 oder älter und eine der folgenden Kombination von Faktoren:
- Ein Verhältnis erster Grad mit einer Vorgeschichte von Brustkrebs 2 oder mehr gutartigen Biopsien und einer Vorgeschichte einer Brustbiopsie, die eine atypische Hyperplasie zeigt; oder
- Mindestens 2 Verwandte ersten Grades mit Brustkrebsgeschichte und einer persönlichen Vorgeschichte von mindestens einer Brustbiopsie; oder
- LCIS
Alter 40 oder älter und eine der folgenden Kombination von Faktoren:
- Ein Verhältnis erster Grad mit einer Vorgeschichte von Brustkrebs 2 oder mehr gutartige Biopsien Alter bei der ersten Lebendgeburte ab 25 Jahren und Alter bei Menarche 11 oder jünger; oder
- Mindestens 2 Verwandte erster Grad mit Brustkrebs und Alter bei der ersten Lebendgeburte 19 oder jünger; oder
- Ein Verhältnis erster Grad mit einer Vorgeschichte von Brustkrebs und einer persönlichen Vorgeschichte einer Brustbiopsie, die eine atypische Hyperplasie zeigt.
Alter 45 oder älter und eine der folgenden Kombination von Faktoren:
- Mindestens 2 Verwandte ersten Grades mit Brustkrebs und Alter bei der ersten Lebendgeburt 24 oder jünger; oder
- Ein Verhältnis erster Grad mit einer Vorgeschichte von Brustkrebs mit einer persönlichen Vorgeschichte eines gutartigen Brustbiopsie -Zeitalters bei Menarche 11 oder weniger und Alter bei der ersten Lebendgeburte 20 oder mehr.
Alter 50 oder älter und eine der folgenden Kombination von Faktoren:
- Mindestens 2 Verwandte ersten Grades mit Brustkrebsgeschichte; oder
- Vorgeschichte einer Brustbiopsie, die eine atypische Hyperplasie zeigt und bei der ersten Lebendgeburt 30 oder älter und Alter bei Menarche 11 oder weniger; oder
- Geschichte von mindestens zwei Brustbiopsien mit einer Geschichte atypischer Hyperplasie und Alter bei der ersten Lebendgeburte 30 oder mehr.
Alter 55 oder älter und eine der folgenden Kombination von Faktoren:
- Ein Verhältnis erster Grad mit einer Vorgeschichte von Brustkrebs mit einer persönlichen Vorgeschichte einer gutartigen Brustbiopsie und eines Alters bei Menarche 11 oder weniger; oder
- Vorgeschichte von mindestens 2 Brustbiopsien mit einer Geschichte atypischer Hyperplasie und Alter bei der ersten Lebendgeburte ab 20 Jahren.
Alter 60 oder älter und:
- 5-Jahres-prognostiziertes Risiko für Brustkrebs ≥ 1,67%, wie durch das GAIL-Modell berechnet.
Für Frauen, deren Risikofaktoren in den obigen Beispielen nicht beschrieben sind, ist das GAIL -Modell erforderlich, um das absolute Brustkrebsrisiko abzuschätzen. Angehörige der Gesundheitsberufe können ein Tool zur Bewertung des GAIL-Modells einholen, indem sie 1-800-544-2007 wählen.
Es sind nicht genügend Daten zur Auswirkung von Nolvadex (Tamoxifen Citrat) auf die Inzidenz von Brustkrebs bei Frauen mit ererbten Mutationen (BRCA1 BRCA2) verfügbar, um spezifische Empfehlungen zur Wirksamkeit von Nolvadex (Tamoxifen Citrat) bei diesen Patienten abzugeben.
Nach einer Bewertung des Risikos, Brustkrebs zu entwickeln, sollte die Entscheidung über die Therapie mit Nolvadex (Tamoxifen Citrat) über die Verringerung der Brustkrebsinzidenz auf einer individuellen Bewertung der Vorteile und Risiken von Nolvadex (Tamoxifen Citrat) -Therapie beruhen. In der NSABP-P-1-Studie hat Nolvadex (Tamoxifen Citrat) die Behandlung des Risikos einer Brustkrebs während der Nachbeobachtungszeit der Studie verringert, jedoch nicht das Risiko von Brustkrebs beseitigt (siehe Tabelle 3 in Klinische Pharmakologie ).
Dosierung für Nolvadex
Bei Patienten mit Brustkrebs beträgt die empfohlene tägliche Dosis 20-40 mg. Dosierungen von mehr als 20 mg pro Tag sollten in geteilten Dosen (Morgen und Abend) angegeben werden.
In drei Einzelagenten -adjuvanten Studien an Frauen wurde eine Tablette von 10 mg Nolvadex (Tamoxifen -Citrat) zwei Jahre lang zwei Jahre lang täglich zwei (ECOG und NATO) oder drei (Toronto) verabreicht. In der NSABP B-14 Adjuvans-Studie an Frauen mit Knoten-negativem Brustkrebs wurde eine Tablette von 10 mg Nolvadex (Tamoxifen Citrat) für mindestens 5 Jahre zweimal täglich verabreicht. Die Ergebnisse der B-14-Studie legen nahe, dass die Fortsetzung der Therapie über fünf Jahre hinaus keinen zusätzlichen Nutzen bietet (siehe Klinische Pharmakologie ). In der Übersicht über die EBCTCG von 1995 war die Verringerung von Rezidiven und Mortalität in den Studien größer, in denen Tamoxifen etwa 5 Jahre lang verwendet wurden als bei denen, die Tamoxifen für eine kürzere Therapiezeit verwendeten. There was no indication that doses greater than 20 mg per day were more effective. Current data from clinical trials support 5 years of adjuvant Nolvadex (Tamoxifen Citrat) therapy for patients with breast cancer.
Duktalkarzinom in situ (DCIS)
Die empfohlene Dosis ist Nolvadex (Tamoxifen Citrat) 20 mg täglich für 5 Jahre täglich.
Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko
Die empfohlene Dosis ist Nolvadex (Tamoxifen Citrat) 20 mg täglich für 5 Jahre täglich. There are no data to support the use of Nolvadex (Tamoxifen Citrat) other than for 5 years (Sehen Klinische Pharmakologie- Klinische Studien - Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko Frauen ).
Wie geliefert
10 mg Tabletten Enthält Tamoxifen als Citrat in einer Menge, die zu 10 mg Tamoxifen entspricht (runde biconvex unbeschichtete weiße Tablette, identifiziert mit Nolvadex (Tamoxifen -Citrat) 600 auf der einen Seite und einer auf der anderen Seite besiegten Cameo) werden in Flaschen von 60 Tabletten versorgt. NDC 0310-0600-60.
20 mg Tabletten Enthält Tamoxifen als Citrat in einer Menge, die 20 mg Tamoxifen entspricht (runde biconvex unbeschichtete weiße Tablette, identifiziert mit Nolvadex (Tamoxifen -Citrat) 604 auf der einen Seite und einer auf der anderen Seite besiegten Cameo) werden in Flaschen von 30 Tabletten versorgt. NDC 0310-0604-30.
Lagern Sie bei kontrollierter Raumtemperatur 20-25 ° C (68-77 ° F) [siehe USP]. In einem gut abgeschlossenen, lichtbeständigen Behälter geben.
*Coumadin® ist eine eingetragene Marke von Bristol-Myers Squibb Pharmaceuticals. Alle anderen Marken sind Eigentum der AstraZeneca-Gruppe AstraZeneca Pharmaceuticals LP Wilmington Delaware 19850-5437. Rev. 09-27-05. FDA Revision Datum: 09.03.2006
Nebenwirkungen for Nolvadex
Nebenwirkungen auf Nolvadex (Tamoxifen -Citrat) sind relativ mild und selten schwerwiegend genug, um die Behandlung der Behandlung bei Brustkrebspatienten zu erfordern.
Weitere klinische Studien haben zu weiteren Informationen geführt, die besser auf die Inzidenz von unerwünschten Reaktionen mit Nolvadex (Tamoxifen Citrat) im Vergleich zu Placebo hinweisen.
Metastasierter Brustkrebs
Es sind erhöhte Knochen- und Tumorschmerzen und auch lokale Krankheiten aufgetreten, die manchmal mit einer guten Tumorreaktion verbunden sind. Patienten mit erhöhten Knochenschmerzen benötigen möglicherweise zusätzliche Analgetika. Patienten mit Weichteilerkrankungen können plötzlich die Größe bereits bestehender Läsionen aufweisen, die manchmal mit einem ausgeprägten Erythem innerhalb und der Umgebung der Läsionen und/oder der Entwicklung neuer Läsionen verbunden sind. Wenn sie auftreten, werden die Knochenschmerzen oder die Krankheitsflackern kurz nach dem Beginn von Nolvadex (Tamoxifen Citrat) beobachtet und lassen sich im Allgemeinen schnell ab.
Bei Patienten, die mit Nolvadex (Tamoxifen -Citrat) gegen metastasiertes Brustkrebs behandelt wurden, sind die häufigsten nachteiligen Reaktion auf Nolvadex (Tamoxifen -Citrat) Heißhochbluten.
Andere nachteilige Reaktionen, die selten zu sehen sind, sind Hyperkalzämie-Periphere-Ödeme gegen Nahrungsmittel-Pruritus vulvae Depression Schwindel.
Prämenopausale Frauen
Die folgende Tabelle fasst die Inzidenz von unerwünschten Reaktionen zusammen, die bei einer Häufigkeit von 2% oder mehr aus klinischen Studien (Ingle Pritchard Buchanan) gemeldet wurden, die die Therapie von Nolvadex (Tamoxifen Citrat) mit der Ovarialablation bei prämenopausalen Patienten mit metastasiertem Brustkrebs verglichen.
| Nebenwirkungen* | Nolvadex (Tamoxifen Citrat) Alle Effekte % von % von Frauen n = 104 | Eierstockablation Alle Effekte % der Frauen n = 100 |
| Spülen | 33 | 46 |
| Amenorrhoe | 16 | 69 |
| Veränderte Menstruation | 13 | 5 |
| Oligomenorrhoe | 9 | 1 |
| Knochenschmerzen | 6 | 6 |
| Menstruationsstörung | 6 | 4 |
| Brechreiz | 5 | 4 |
| Husten/Husten | 4 | 1 |
| Ödem | 4 | 1 |
| Ermüdung | 4 | 1 |
| Muskoloskelettschmerzen | 3 | 0 |
| Schmerz | 3 | 4 |
| Eierstockzysten (en) | 3 | 2 |
| Depression | 2 | 2 |
| Bauchkrämpfe | 1 | 2 |
| Anorexie | 1 | 2 |
| *Einige Frauen hatten mehr als eine Nebenwirkungen. |
Männlicher Brustkrebs
Nolvadex (Tamoxifen Citrat) is well tolerated in males with breast cancer. Reports from the literature Und case reports suggest that the safety profile of Nolvadex (Tamoxifen Citrat) in males is similar to that seen in women. Loss of libido Und impotence have resulted in discontinuation of tamoxifen therapy in male patients. Also in oligospermic males treated with tamoxifen LH FSH testosterone Und estrogen levels were elevated. No significant clinical changes were reported.
Adjuvanter Brustkrebs
In der NSABP B-14-Studie wurden Frauen mit axillärem Knotennegativen Brustkrebs auf 5 Jahre Nolvadex (Tamoxifen Citrat) 20 mg/Tag oder Placebo nach der primären Operation randomisiert. Die berichteten nachteiligen Effekte sind nachstehend tabellarisch (mittlere Follow-up von ungefähr 6,8 Jahren), die auf Nolvadex (Tamoxifen Citrat) häufiger als auf Placebo häufiger auftreten. Die Inzidenz von Hitzewallungen (64% gegenüber 48%) vaginaler Entladung (30% gegenüber 15%) und unregelmäßige Menstruation (25% gegenüber 19%) war mit Nolvadex (Tamoxifen Citrat) im Vergleich zu Placebo höher. Alle anderen nachteiligen Wirkungen traten mit ähnlicher Häufigkeit in den 2 Behandlungsgruppen mit Ausnahme thrombotischer Ereignisse auf. Bei Nolvadex (Tamoxifen Citrat) wurde eine höhere Inzidenz beobachtet, die behandelt wurden (über 5 Jahre 1,7% gegenüber 0,4%). Zwei der mit Nolvadex (Tamoxifen Citrat) behandelten Patienten mit thrombotischen Ereignissen starben.
| NSABP B-14-Studie | ||
| Nebenwirkung | % der Frauen | |
| Nolvadex (n = 1422) | Placebo (n = 1437) | |
| Hitzewallungen | 64 | 48 |
| Flüssigkeitsretention | 32 | 30 |
| Vaginalausfluss | 30 | 15 |
| Brechreiz | 26 | 24 |
| Unregelmäßige Menstruation | 25 | 19 |
| Gewichtsverlust (> 5%) | 23 | 18 |
| Hautveränderungen | 19 | 15 |
| Erhöhte SGOT | 5 | 3 |
| Erhöhte Bilirubin | 2 | 1 |
| Erhöhtes Kreatinin | 2 | 1 |
| Thrombozytopenie* | 2 | 1 |
| Thrombotische Ereignisse | ||
| Deep Vein Thrombosis | 0.8 | 0.2 |
| Lungenemboliensm | 0.5 | 0.2 |
| Superficial Phlebitis | 0.4 | 0.0 |
| *Definiert als Thrombozytenzahl von <100000/mm3 |
In der Eastern Cooperative Oncology Group (ECOG) adjuvante Brustkrebs -Studie Nolvadex (Tamoxifen Citrat) oder Placebo wurde Frauen nach Mastektomie 2 Jahre lang verabreicht. Im Vergleich zu Placebo Nolvadex (Tamoxifen -Citrat) zeigten eine signifikant höhere Inzidenz von Hitzewallungen (19% gegenüber 8% für Placebo). Die Inzidenz aller anderen Nebenwirkungen war in den beiden Behandlungsgruppen mit Ausnahme der Thrombozytopenie ähnlich, bei der die Inzidenz für Nolvadex (Tamoxifen -Citrat) 10% gegenüber 3% für Placebo betrug.
In anderen adjuvanten Studien, die Toronto und Nolvadex (Tamoxifen Citrat) adjuvante Studienorganisation (NATO) Frauen (NATO) erhielten, erhielten entweder Nolvadex (Tamoxifen Citrat) oder keine Therapie. In der Toronto -Studie wurden bei 29% der Patienten für Nolvadex (Tamoxifen Citrat) in 29% der Patienten in der unbehandelten Gruppe Hitzewallungen beobachtet. In den NATO -Versuchsversuchs wurden bei 2,8% bzw. 2,0% der Frauen für Nolvadex (Tamoxifen Citrat) im Vergleich zu 0,2% für jeweils in der unbehandelten Gruppe bei 2,8% bzw. 2,0% der vaginalen Blutungen berichtet.
Anastrozol adjuvante Studie - Studie über Anastrozol im Vergleich zu Nolvadex (Tamoxifen Citrat) zur adjuvanten Behandlung von frühes Brustkrebs (sehen Klinische Pharmakologie - Klinische Studien ).
Bei einer medianen Follow-up von 33 Monaten zeigte die Kombination von Anastrozol und Nolvadex (Tamoxifencitrat) im Vergleich zu Nolvadex (Tamoxifen-Citrat) -Therapie im Vergleich zu Nolvadex (Tamoxifen-Citrat) -Therapie, die bei allen Patienten allein gegeben wurden, keinen Vorteil. Dieser Behandlungsarm wurde aus der Studie abgebrochen. Die mediane Dauer der adjuvanten Behandlung zur Sicherheitsbewertung betrug 59,8 Monate und 59,6 Monate für Patienten, die Anastrozol 1 mg bzw. Nolvadex (Tamoxifen Citrat) 20 mg erhielten.
In der folgenden Tabelle werden unerwünschte Ereignisse mit einer Inzidenz von mindestens 5% in einer Behandlungsgruppe während der Behandlung oder innerhalb von 14 Tagen nach dem Ende der Behandlung vorgestellt.
Unerwünschte Ereignisse mit einer Inzidenz von mindestens 5% in einer Behandlungsgruppe während der Behandlung oder innerhalb von 14 Tagen nach dem Ende der Behandlung
| Körpersystem und unerwünschtes Ereignis durch Costart-bevorzugte Begriff* | Anastrozol 1 mg (N = 3092) | Nolvadex 20 mg (N = 3094) |
| Körper als Ganzes | ||
| Asthenia | 575 (19) | 544 (18) |
| Schmerz | 533 (17) | 485 (16) |
| Back pain | 321 (10) | 309 (10) |
| Headache | 314 (10) | 249 (8) |
| Abdominal pain | 271 (9) | 276 (9) |
| Infection | 285 (9) | 276 (9) |
| Accidental injury | 311 (10) | 303 (10) |
| Flu syndrome | 175 (6) | 195 (6) |
| Chest pain | 200 (7) | 150 (5) |
| Neoplasm | 162 (5) | 144 (5) |
| Cyst | 138 (5) | 162 (5) |
| Herz -Kreislauf | ||
| Vasodilatation | 1104 (36) | 1264 (41) |
| Hypertension | 402 (13) | 349 (11) |
| Verdauungs | ||
| Brechreiz | 343 (11) | 335 (11) |
| Verstopfung | 249 (8) | 252 (8) |
| Diarrhea | 265 (9) | 216 (7) |
| Dyspepsia | 206 (7) | 169 (6) |
| Gastrointestinal disorder | 210 (7) | 158 (5) |
| Hemisch und lymphatisch | ||
| Lymphoedema | 304 (10) | 341 (11) |
| Anemia | 113 (4) | 159 (5) |
| Stoffwechsel und Ernährung | ||
| Peripheral edema | 311 (10) | 343 (11) |
| Weight gain | 285 (9) | 274 (9) |
| Hypercholesterolemia | 278 (9) | 108 (3,5) |
| Muskuloskelett | ||
| Arthritis | 512 (17) | 445 (14) |
| Arthralgia | 467 (15) | 344 (11) |
| Osteoporosis | 325 (11) | 226 (7) |
| Fracture | 315 (10) | 209 (7) |
| Bone pain | 201 (7) | 185 (6) |
| Arthrosis | 207 (7) | 156 (5) |
| Joint Disorder | 184 (6) | 160 (5) |
| Myalgia | 179 (6) | 160 (5) |
| Nervensystem | ||
| Depression | 413 (13) | 382 (12) |
| Insomnia | 309 (10) | 281 (9) |
| Dizziness | 236 (8) | 234 (8) |
| Anxiety | 195 (6) | 180 (6) |
| Paraesthesia | 215 (7) | 145 (5) |
| Atemweg | ||
| Pharyngitis | 443 (14) | 422 (14) |
| Cough increased | 261 (8) | 287 (9) |
| Dyspnea | 234 (8) | 237 (8) |
| Sinusitis | 184 (6) | 159 (5) |
| Bronchitis | 167 (5) | 153 (5) |
| Haut und Anhänge | ||
| Rash | 333 (11) | 387 (13) |
| Sweating | 145 (5) | 177 (6) |
| Besondere Sinne | ||
| Cataract Specified | 182 (6) | 213 (7) |
| Urogenital | ||
| Leukorrhea | 86 (3) | 286 (9) |
| Urinary tract infection | 244 (8) | 313 (10) |
| Breast pain | 251 (8) | 169 (6) |
| Breast Neoplasm | 164 (5) | 139 (5) |
| Vulvovaginitis | 194 (6) | 150 (5) |
| Vaginal Hemorrhage† | 122 (4) | 180 (6) |
| Vaginitis | 125 (4) | 158 (5) |
| Costart -Codierungssymbole für den Thesaurus von nachteiligen Reaktionsbegriffen. N = Anzahl der Patienten, die die Behandlung erhalten. *Ein Patient hatte möglicherweise mehr als 1 unerwünschtes Ereignis, einschließlich mehr als 1 unerwünschter Ereignis im selben Körpersystem. † Vaginalblutung ohne weitere Diagnose. ** Der Kombinationsarm wurde aufgrund mangelnder Wirksamkeitsguthaben bei 33 Monaten der Nachuntersuchung eingestellt. |
Bestimmte unerwünschte Ereignisse und Kombinationen von unerwünschten Ereignissen wurden prospektiv für die Analyse auf der Grundlage der bekannten pharmakologischen Eigenschaften und Nebenwirkungsprofile der beiden Arzneimittel spezifiziert (siehe folgende Tabelle).
Anzahl (%) von Patienten mit vorgegebenem unerwünschtem Ereignis in der Anastrozol-Adjuvans-Studie1
| Anastrozole N = 3092 (%) | Nolvadex (Tamoxifen Citrat) N = 3094 (%) | Odds-Reatio4 | 95% dort4 | |
| Hitzewallungen | 1104 (36) | 1264 (41) | 0.80 | 0,73 - 0,89 |
| Muskuloskelett Ereignisse2 | 1100 (36) | 911 (29) | 1.32 | 1.19 - 1.47 |
| Ermüdung/Asthenia | 575 (19) | 544 (18) | 1.07 | 0,94 - 1,22 |
| Stimmungsstörungen | 597 (19) | 554 (18) | 1.10 | 0,97 - 1,25 |
| Brechreiz Und Vomiting | 393 (13) | 384 (12) | 1.03 | 0,88 - 1,19 |
| Alle Brüche | 315 (10) | 209 (7) | 1.57 | 1,30 - 1,88 |
| Fractures of Spine Hip or Wrist | 133 (4) | 91 (3) | 1.48 | 1.13 - 1,95 |
| Wrist/Colles' fractures | 67 (2) | 50 (2) | ||
| Spine fractures | 43 (1) | 22 (1) | ||
| Hip fractures | 28 (1) | 26 (1) | ||
| Katarakte | 182 (6) | 213 (7) | 0.85 | 0,69 - 1,04 |
| Vaginalblutung | 167 (5) | 317 (10) | 0.50 | 0,41 - 0,61 |
| Ischämische Herz -Kreislauf -Erkrankungen | 127 (4) | 104 (3) | 1.23 | 0,95 - 1,60 |
| Vaginalausfluss | 109 (4) | 408 (13) | 0.24 | 0,19 - 0,30 |
| Venöse thromboembolische Ereignisse | 87 (3) | 140 (5) | 0.61 | 0,47 - 0,80 |
| Deep Venous Thromboembolic | 48 (2) | 74 (2) | 0.64 | 0,45 - 0,93 |
| Ereignisse | ||||
| Ischämischer zerebrovaskuläres Ereignis | 62 (2) | 88 (3) | 0.70 | 0,50 - 0,97 |
| Endometriumkrebs3 | 4 (0,2) | 13 (0,6) | 0.31 | 0,10 - 0,94 |
| 1Patienten mit mehreren Ereignissen in derselben Kategorie werden in dieser Kategorie nur einmal gezählt. 2Bezieht sich auf Gelenksymptome, einschließlich Arthritis -Arthrose und Arthralgie mit Gelenkstörung. 3Prozentsätze berechnet auf der Grundlage der Anzahl der Patienten mit einer intakten Gebärmutter zu Studienbeginn. 4Die Quotenverhältnisse <1.00 favor Anastrozole and those> 1,00 bevorzugt Nolvadex (Tamoxifen Citrat) |
Patienten, die Anastrozol erhielten, hatten eine Zunahme von Gelenkstörungen (einschließlich Arthritis Arthrose und Arthralgie) im Vergleich zu Patienten, die Nolvadex (Tamoxifen Citrat) erhielten. Patienten, die Anastrozol erhielten, hatten eine Zunahme der Inzidenz aller Frakturen (insbesondere Frakturen von Wirbelsäulenhip und Handgelenk) [315 (10%)], verglichen mit Patienten, die Nolvadex (Tamoxifen Citrat) erhalten [209 (7%)]. Patienten, die Anastrozol erhielten, hatten eine Verringerung der Taginalblutungen der Vaginalausgabe Endometriumkrebs venöse thromboembolische Ereignisse und ischämische zerebrovaskuläre Ereignisse im Vergleich zu Patienten, die Nolvadex erhielten (Tamoxifen -Citrat).
Patienten, die Nolvadex (Tamoxifen Citrat) erhielten, verzeichneten eine Abnahme der Hypercholesterinämie (108 [3,5%]) im Vergleich zu Patienten, die Anastrozol erhielten (278 [9%]). Angina pectoris wurde bei 71 [2,3%] Patienten im Anastrozolarm und 51 [1,6%] Patienten im Nolvadex -Arm (Tamoxifen) -Arm berichtet; Myokardinfarkt wurde bei 37 [1,2%] Patienten im Anastrozolarm und bei 34 [1,1%] Patienten im Nolvadex (Tamoxifen Citrat) -Sarm berichtet.
Die Ergebnisse der adjuvanten Studie -Knochensubstudie nach 12 und 24 Monaten zeigten, dass Patienten, die Anastrozol erhielten, sowohl die Lumbalwirbelsäule als auch die Gesamt -Hüftknochen -Mineraldichte (BMD) im Vergleich zu Ausgangswert aufwiesen. Patienten, die Nolvadex (Tamoxifen -Citrat) erhielten, hatten im Vergleich zu Ausgangswert eine durchschnittliche Erhöhung der Lendenwirbelsäule und des gesamten Hip -BMD.
Duktalkarzinom in situ (DCIS)
Die Art und Häufigkeit von unerwünschten Ereignissen in der NSABP B-24-Studie stimmten mit denen überein, die in den anderen mit Nolvadex (Tamoxifen Citrat) durchgeführten adjuvanten Studien beobachtet wurden.
Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko
In der NSABP P-1-Studie gab es einen Anstieg der fünf schwerwiegenden nachteiligen Auswirkungen in der Nolvadex-Gruppe (Tamoxifen-Citrat): Endometriumkrebs (33 Fälle in der Gruppe Nolvadex (Tamoxifen Citrat) -Gruppe gegenüber 14 in der Placebo-Gruppe); Lungenembolie (18 Fälle in der Gruppe Nolvadex (Tamoxifen Citrat) -Gruppe gegenüber 6 in der Placebo -Gruppe); tiefe Venenthrombose (30 Fälle in der Gruppe Nolvadex (Tamoxifen Citrat) Gruppe gegenüber 19 in der Placebo -Gruppe); Schlaganfall (34 Fälle in der Nolvadex -Gruppe (Tamoxifen Citrat) gegenüber 24 in der Placebo -Gruppe); Kataraktbildung (540 Fälle in der Gruppe Nolvadex (Tamoxifen Citrat) gegenüber 483 in der Placebo -Gruppe) und Kataraktchirurgie (101 Fälle in der Nolvadex -Gruppe (Tamoxifen Citrat) gegenüber 63 in der Placebo -Gruppe) (siehe WARNUNGS und Tabelle 3 in Klinische Pharmakologie ).
In der folgenden Tabelle werden die in NSABP P-1 beobachteten unerwünschten Ereignisse durch Behandlungsarm vorgestellt. Nur unerwünschte Ereignisse, die auf Nolvadex (Tamoxifen -Citrat) häufiger als Placebo häufiger sind, werden gezeigt.
| NSABP P-1-Versuch: Alle unerwünschten Ereignisse % der Frauen | ||
| Nolvadex N = 6681 | PLACEBO N = 6707 | |
| Selbst gemeldete Symptome | N = 64411 | N = 64691 |
| Hitzewallungen | 80 | 68 |
| Vaginalausflusss | 55 | 35 |
| Vaginalblutung | 23 | 22 |
| Laboranomalien | N = 65202 | N = 65352 |
| Blutplättchen nahmen ab | 0.7 | 0.3 |
| Nebenwirkungs | N = 64923 | N = 64843 |
| Andere Toxizitäten | ||
| Stimmung | 11.6 | 10.8 |
| Infektion/Sepsis | 6.0 | 5.1 |
| Verstopfung | 4.4 | 3.2 |
| Alopezie | 5.2 | 4.4 |
| Haut | 5.6 | 4.7 |
| Allergie | 2.5 | 2.1 |
| 1Zahl mit Fragebögen der Lebensqualität 2Anzahl mit Behandlungs-Follow-up-Formularen 3Anzahl mit unerwünschten Arzneimittelreaktionsformen |
In der NSABP P-1-Studie zogen sich 15,0% und 9,7% der Teilnehmer, die Nolvadex (Tamoxifen Citrat) und eine Placebo-Therapie erhielten, aus medizinischen Gründen aus der Studie zurück. Im Folgenden sind die medizinischen Gründe für den Rückzug aus Nolvadex (Tamoxifen Citrat) bzw. Placebo -Therapie: Hitzewallungen (3,1% gegenüber 1,5%) und Vaginalausfluss (0,5% gegenüber 0,1%).
In der NSABP P-1-Studie wurden 8,7% und 9,6% der Teilnehmer, die Nolvadex (Tamoxifen Citrat) und eine Placebo-Therapie erhielten, aus nicht medizinischen Gründen zurückgezogen.
Auf dem NSABP P-1-Versuch traten bei 68% der Frauen auf Placebo und bei 80% der Frauen auf Nolvadex (Tamoxifen Citrat) eine Hitze. Bei 28% der Frauen auf Placebo und 45% der Frauen auf Nolvadex (Tamoxifen -Citrat) traten schwere Hitzewallungen auf. Die vaginale Entladung trat bei 35% und 55% der Frauen auf Placebo- und Nolvadex (Tamoxifen Citrat) auf; und war in 4,5% bzw. 12,3% schwerwiegend. Es gab keinen Unterschied in der Inzidenz von Vaginalblutungen zwischen Behandlungsarmen.
Pädiatrische Patienten - McCune -Albright -Syndrom
Das mittlere Uterusvolumen nahm nach 6 Monaten Behandlung zu und verdoppelte sich am Ende der einjährigen Studie. Eine kausale Beziehung wurde nicht hergestellt; Bei Erwachsenen, die mit Nolvadex behandelt wurden WARNUNG BOXED ) Die fortgesetzte Überwachung von McCune-Albright-Patienten, die mit Nolvadex (Tamoxifen Citrat) für Langzeiteffekte behandelt wurden, wird empfohlen. Die Sicherheit und Wirksamkeit von Nolvadex (Tamoxifen Citrat) für Mädchen im Alter von zwei bis 10 Jahren mit dem McCune-Albright-Syndrom und der frühreifen Pubertät wurden nicht über ein Jahr der Behandlung hinaus untersucht. Die langfristigen Auswirkungen der Nolvadex-Therapie (Tamoxifen-Citrat) bei Mädchen wurden nicht festgestellt.
Nachmarkterfahrung
Weniger häufig berichtete unerwünschte Reaktionen sind Vaginalblutungen Vaginalausfluss Menstruationsunregelmäßigkeiten Hautausschlag und Kopfschmerzen. Normalerweise waren diese nicht ausreichend Schweregrad, um eine Dosierungsreduzierung oder Abnahme der Behandlung zu erfordern. Sehr seltene Berichte über das Erythema multiforme Stevens-Johnson-Syndrom Bullous Pemphigoid interstitielle Pneumonitis und seltene Berichte über Überempfindlichkeitsreaktionen, einschließlich Angioödeme, wurden mit Nolvadex (Tamoxifen-Citrat) -Therapie berichtet. In einigen dieser Fälle betrug der Zeitpunkt des Beginns mehr als ein Jahr. In einigen Fällen mit Pankreatitis kann selten eine Erhöhung des Serum -Triglyceridspiegels mit der Verwendung von Nolvadex (Tamoxifen Citrat) verbunden sein (siehe Vorsichtsmaßnahmen- Arzneimittel-/Labortestwechselwirkungen Abschnitt).
Wechselwirkungen mit Arzneimitteln for Nolvadex
Wenn Nolvadex (Tamoxifen-Citrat) in Kombination mit Antikoagulanzien vom Cumarin-Typ verwendet wird, kann ein signifikanter Anstieg der Antikoagulans-Effekt auftreten. Wenn eine solche gleichzeitige Verabreichung eine sorgfältige Überwachung der Prothrombinzeit des Patienten vorliegt.
In den NSABP P-1-Versuchsfrauen, die aus irgendeinem Grund Antikoagulanzien vom Typ Cumarin benötigten Kontraindikationen ).
Es besteht ein erhöhtes Risiko für thromboembolische Ereignisse, die auftreten, wenn zytotoxische Mittel in Kombination mit Nolvadex (Tamoxifen Citrat) verwendet werden.
Tamoxifen reduzierte die Letrozol -Plasmakonzentrationen um 37%. Die Wirkung von Tamoxifen auf den Metabolismus und die Ausscheidung anderer antineoplastischer Arzneimittel wie Cyclophosphamid und andere Arzneimittel, die Mischfunktionoxidasen zur Aktivierung erfordern, ist nicht bekannt. Es wurde gezeigt, dass die Tamoxifen- und N-Desmethyl-Tamoxifen-Plasmakonzentrationen reduziert sind, wenn sie mit Rifampin oder Aminoglutethimid zusammengefasst ist. Die Induktion des CYP3A4-vermittelten Metabolismus wird als der Mechanismus angesehen, durch den diese Reduktionen auftreten; Andere CYP3A4 -induzierende Wirkstoffe wurden nicht untersucht, um diesen Effekt zu bestätigen.
Ein Patient, der Nolvadex (Tamoxifen -Citrat) mit gleichzeitiger Phenobarbital erhielt, zeigte einen niedrigeren Serumspiegel des Serum -Serums von Tamoxifen als bei anderen Patienten (dh 26 ng/ml gegenüber dem Mittelwert von 122 ng/ml). Die klinische Bedeutung dieses Befundes ist jedoch nicht bekannt. Rifampin induzierte den Metabolismus von Tamoxifen und reduzierte die Plasmakonzentrationen von Tamoxifen bei 10 Patienten signifikant. Aminoglutethimid reduziert die Tamoxifen- und N-Desmethyl-Tamoxifen-Plasmakonzentrationen. Medroxyprogesteron reduziert die Plasmakonzentrationen von N-Desmethyl, jedoch nicht Tamoxifen.
Es wurde gezeigt, dass eine gleichzeitige Bromocriptin-Therapie Serumtamoxifen und N-Desmethyl-Tamoxifen erhöht.
Basierend auf klinischen und pharmakokinetischen Ergebnissen aus der Anastrozol -Adjuvantenstudie Nolvadex (Tamoxifen Citrat) sollte nicht mit Anastrozol verabreicht werden (siehe Klinische Pharmakologie - Wechselwirkungen mit Arzneimittelmedikamenten Abschnitt).
Wechselwirkungen zwischen Arzneimitteln und Labor-/Labortests
Während des Nachmarkters wurden T4-Erhöhungen für einige postmenopausale Patienten gemeldet, die durch Erhöhungen des Schilddrüsenbindungsglobulins erklärt werden können. Diese Erhebungen wurden nicht von klinischer Hyperthyreose begleitet.
Variationen des karyopyknotischen Index bei Vaginalabstrichen und verschiedenen Östrogeneffekten auf PAP -Abstriche wurden bei postmenopausalen Patienten mit Nolvadex (Tamoxifen -Citrat) selten beobachtet.
In der Nachmarkterfahrung mit Nolvadex (Tamoxifen Citrat) wurden selten Fälle von Hyperlipidämien berichtet. Eine regelmäßige Überwachung von Plasma-Triglyceriden und Cholesterin Nebenwirkungen von Reaktionen und Postdurchmesser Abschnitt).
Warnungen for Nolvadex
Effekte bei metastasierten Brustkrebspatienten
Wie bei anderen additiven hormonellen Therapie (Östrogene und Androgene) wurde bei einigen Brustkrebspatienten mit Knochenmetastasen innerhalb weniger Wochen nach der Behandlung mit Nolvadex (Tamoxifen Citrat) eine Hyperkalzämie (Östrogene und Androgene) über eine Hyperkalzämie berichtet. Wenn eine Hyperkalzämie auftritt, sollten geeignete Maßnahmen ergriffen werden und wenn schwere Nolvadex (Tamoxifen -Citrat) abgesetzt werden sollten.
Auswirkungen auf den Uterus-Endometriumkrebs und den Uterussarkom
Eine erhöhte Inzidenz von Malignitäten in Uterus wurde in Verbindung mit einer Behandlung mit Nolvadex (Tamoxifen Citrat) berichtet. Der zugrunde liegende Mechanismus ist unbekannt, kann aber mit der östrogenähnlichen Wirkung von Nolvadex (Tamoxifen Citrat) zusammenhängen. Die meisten Malignitäten der Uterus, die in Verbindung mit Nolvadex (Tamoxifen Citrat) beobachtet werden, werden als Adenokarzinom des Endometriums eingestuft. Es wurden jedoch auch seltene Uterussarkome wie maligne gemischte mullerische Tumoren (MMMT) berichtet. Das Uterussarkom ist im Allgemeinen mit einem höheren Figo -Stadium (III/IV) bei der Diagnose schlechtere Prognose und kürzerer Überleben verbunden. Es wurde berichtet, dass Uterussarkom bei Langzeitnutzern (≥ 2 Jahre) von Nolvadex (Tamoxifen Citrat) häufiger auftritt als bei Nichtbenutzern. Einige der Malignitäten der Uterus (Endometriumkarzinom oder Uterussarkom) waren tödlich.
In der NSABP-P-1-Studie unter den Teilnehmern, die randomisiert zu Nolvadex randomisiert (Tamoxifen Citrat), gab es einen statistisch signifikanten Anstieg der Inzidenz von Endometriumkrebs (33 Fälle von invasivem Endometriumkrebs im Vergleich zu 14 Fällen bei Teilnehmern unter den Teilnehmern, die auf Placebo randomisiert wurden (RR = 2,48 95% CI: 1,27-4.92). Citrat) waren Figo -I -Stadium I, einschließlich 20 IB und 1 IC -Endometrium -Adenokarzinome. Randomisierung (26 Fälle von invasivem Endometriumkrebs im Vergleich zu 6 Fällen unter den Teilnehmern, die auf Placebo randomisiert wurden (RR = 4,50 95% CI: 1,78-13,16). Bei Frauen ≤ 49 Jahre zum Zeitpunkt der Randomisierung gab es 7 Fälle von invasiven Endometriumkrebs im Vergleich zu 8 Fällen unter den Teilnehmern unter den Teilnehmern. Es gab 4 Fälle von Endometriumkrebs bei den Teilnehmern ≤ 49 randomisierte auf Nolvadex (Tamoxifen Citrat) im Vergleich zu 2 bei den Teilnehmern, die randomisiert zu Placebo (RR = 2,21 95% CI: 0,4-12,0) für Frauen ≥ 50 zum Zeitpunkt der Diagnose wurden 29 Fälle zwischen den Teilnehmern unter den Personen, die bei der NOLVADE (Tamoxifen) (Tamoxifen) (Tamoxifen) (Tamox) (Tamox) (Tamox) (Tamox) (Tamox) im Vergleich zu NOLVADE (TAMOXIDE) gegeben wurden. 95% CI: 1,3-4,9). (Tamoxifen -Citrat) Die Ereignisse traten ab Beginn der Behandlung zwischen 1 und 61 Monaten (Durchschnitt = 32 Monate) auf.
In einer aktualisierten Überprüfung der Langzeitdaten (die mediane Länge der Gesamtverfolgung beträgt 6,9 Jahre, einschließlich geblendeter Nachuntersuchung) an 8306 Frauen mit einer intakten Gebärmutter bei der Randomisierung in der NSABP-P-1-Risikominderungsstudie war die Inzidenz beider Adenokarzinome und seltener Uterussarkome erhöht in Frauen, die Nolvadex (Tamoxifen Citratat) einnehmen. Während der blindem Nachuntersuchung gab es 36 Fälle des Endometrium-Adenokarzinoms des Figo-Stadiums I (22 waren Figo Stadium Ia 13 Ib und 1 IC) bei Frauen, die Nolvadex (Tamoxifen-Citrat) erhielten, und 15 Fälle bei Frauen, die Placebo erhielten [14 waren Figo Stadium I (9 Ia und 5 Ib) und 1 Fall war Figo Stadium IV. Von den Patienten, die Nolvadex (Tamoxifen Citrat) erhielten, die Endometriumkrebs mit IA Stadium IA und 4 mit Krebserkrankungen im Stadium IB -Krebstherapie entwickelten. In der Placebo -Gruppe 1 mit einem Patienten mit Figo -Stadium 1B erhielt Krebs eine Strahlentherapie und der Patient mit Figo Stadium IVB -Krebs erhielt eine Chemotherapie und eine hormonelle Therapie. Während der gesamten Nachuntersuchungsendometrium-Adenokarzinom wurde bei 53 Frauen nach randomisierten Frauen nach Nolvadex (Tamoxifen Citrat) berichtet (30 Fälle von Figo Stadium Ia 20 waren Stadium Ib 1 waren Stadium IC und 2 waren Stadium IIIC) und 17 Frauen, die randomisiert auf Placebo randomisiert wurden (9 Fälle waren Figo-Stadium IA 6, war das Stadium II. Einige Patienten erhielten zusätzlich zur Operation eine postoperative Strahlentherapie. Uterussarkome wurden bei 4 Frauen berichtet, die randomisiert zu Nolvadex (Tamoxifen Citrat) (1 war Figo Ia 1 war 1 war Figo ib 1 war Figo IIa und 1 war Figo IIIC) und ein Patient, der nach Placebo randomisiert wurde (Figo 1a); Inzidenz pro 1000 Frauenjahre von 0,17 bzw. 0,04. Von den Patienten, die randomisiert zu Nolvadex (Tamoxifen Citrat) randomisiert wurden, waren die Figo Ia- und IB -Fälle ein MMMT bzw. Sarkom; Der Figo II war ein MMMT; und die Figo III war ein Sarkom; und der eine Patient, der nach Placebo randomisiert wurde, hatte eine MMMT. Bei Frauen, die Nolvadex (Tamoxifen -Citrat) in fünf anderen klinischen NSABP -Studien erhielten, wurde eine ähnliche erhöhte Inzidenz beim Endometriumadenokarzinom und bei Uterussarkom und Uterussarkom beobachtet.
Jeder Patienten, der empfangen wird oder der zuvor Nolvadex (Tamoxifen Citrat) erhalten hat, der abnormale vaginale Blutungen meldet, sollte sofort bewertet werden. Patienten erhalten oder die zuvor Nolvadex (Tamoxifen Citrat) erhalten haben, sollten jährliche gynäkologische Untersuchungen durchführen und ihre Ärzte umgehend informieren, wenn sie abnormale gynäkologische Symptome auftreten, z.
In der P-1-Studie veränderte die Endometriumprobenahme nicht die Erkennungsrate für Endometriumkrebs im Vergleich zu Frauen, die keine Endometriumprobenahme (0,6% mit einer Probenahme von 0,5% ohne Probenahme) für Frauen mit intaktem Uterus unterzogen wurden. Es gibt keine Daten, die darauf hindeuten, dass eine routinemäßige Endometriumprobenahme bei asymptomatischen Frauen, die Nolvadex (Tamoxifen Citrat) einnehmen, um die Inzidenz von Brustkrebs zu verringern, von Vorteil wäre.
Nicht maligne Effekte auf die Gebärmutter
Eine erhöhte Inzidenz von Endometriumänderungen, einschließlich Hyperplasie und Polypen, wurde in Verbindung mit der Behandlung mit Nolvadex (Tamoxifen Citrat) berichtet. Die Inzidenz und das Muster dieses Anstiegs legen nahe, dass der zugrunde liegende Mechanismus mit den östrogenen Eigenschaften von Nolvadex (Tamoxifen Citrat) zusammenhängt.
Es gab einige Berichte über Endometriose- und Uterusfibroide bei Frauen, die Nolvadex (Tamoxifen Citrat) erhielten. Der zugrunde liegende Mechanismus kann auf die teilweise östrogene Wirkung von Nolvadex (Tamoxifen Citrat) zurückzuführen sein. Ovarialzysten wurden auch bei einer geringen Anzahl von prämenopausalen Patienten mit fortgeschrittenem Brustkrebs beobachtet, die mit Nolvadex (Tamoxifen Citrat) behandelt wurden.
Nolvadex (Tamoxifen Citrat) has been reported to cause menstrual irregularity or amenorrhea.
Thromboembolische Wirkungen von Nolvadex (Tamoxifen Citrat)
Es gibt Hinweise auf eine erhöhte Inzidenz von thromboembolischen Ereignissen, einschließlich tiefer Venenthrombose und Lungenembolie während der Nolvadex -Therapie (Tamoxifen -Citrat). Wenn Nolvadex (Tamoxifen Citrat) mit einer Chemotherapie koadminiert ist, kann die Inzidenz thromboembolischer Wirkungen weiter zunehmen. Für die Behandlung von Brustkrebs sollten die Risiken und Vorteile von Nolvadex (Tamoxifen Citrat) bei Frauen mit thromboembolischen Ereignissen sorgfältig berücksichtigt werden. In einer kleinen Substudie (n = 81) der NSABP P-1-Studie schien es keinen Nutzen zu geben, Frauen auf Faktor V Leiden und Prothrombin-Mutationen G20210A als Mittel zur Identifizierung derjenigen, die möglicherweise nicht geeignete Kandidaten für die Nolvadex-Therapie sind, zu identifizieren.
Daten aus der NSABP-P-1-Studie zeigen, dass Teilnehmer, die Nolvadex (Tamoxifen Citrat) ohne eine Vorgeschichte von Lungenembolien (PE) erhielten, einen statistisch signifikanten Anstieg der Lungenembolien (18-Nolvadex (Tamoxifen Citrat) 6-Placebo-RR = 3,01 95% CI: 1.15-9.27) aufwiesen. Drei der Lungenembolien im Nolvadex (Tamoxifen Citrat) Arm waren tödlich. Siebenundachtzig Prozent der Fälle von Lungenembolie traten bei Frauen im Alter von mindestens 50 Jahren bei Randomisierung auf. Unter Frauen, die Nolvadex (Tamoxifen Citrat) erhielten, traten die Ereignisse ab Beginn der Behandlung zwischen 2 und 60 Monaten (Durchschnitt = 27 Monate) auf.
In derselben Population wurde in der Gruppe Nolvadex (Tamoxifen Citrat) (30-Nolvadex (Tamoxifen Citrat) 19-Placebo; Der gleiche Anstieg des relativen Risikos wurde bei Frauen ≤ 49 und bei Frauen ≥ 50 beobachtet, obwohl bei jüngeren Frauen weniger Ereignisse auftraten. Frauen mit thromboembolischen Ereignissen waren für ein zweites Ereignis (7 von 25 Frauen auf Placebo 5 von 48 Frauen auf Nolvadex (Tamoxifen Citrat) gefährdet und waren für Komplikationen des Ereignisses und seiner Behandlung (0/25 auf Placebo 4/48 auf Nolvadex (Tamoxifen Citrat)) ausgesetzt. Unter Frauen, die Nolvadex (Tamoxifen Citrat) erhielten, traten zwischen 2 und 57 Monaten (durchschnittlich = 19 Monate) zu Beginn der Behandlung zwischen 2 und 57 Monaten auf.
Bei Patienten, die auf Nolvadex (Tamoxifen Citrat) (24-Placebo; 34-Nolvadex (Tamoxifen Citrat) (Tamoxifen Citrat) (Tamoxifen Citrat); RR = 1,42; 95% CI 0,82-2,51) randomisiert wurden, gab es einen nicht statistisch signifikanten Anstieg des Schlaganfalls (24-Placebo; 34-Nolvadex (Tamoxifen Citrat). Sechs der 24 Schläge in der Placebogruppe wurden als hämorrhagische Herkunft angesehen, und 10 der 34 Striche in der Gruppe Nolvadex (Tamoxifen Citrat) wurden als hämorrhagisch eingestuft. Siebzehn der 34 Schläge in der Gruppe Nolvadex (Tamoxifen Citrat) wurden als okklusiv angesehen und 7 wurden als unbekannter Ätiologie angesehen. Es wurde berichtet, dass vierzehn der 24 Schläge auf dem Placebo -Arm okklusiv und 4 der unbekannten Ätiologie sind. Unter diesen Strichen waren 3 Striche in der Placebogruppe und 4 Striche in der Gruppe Nolvadex (Tamoxifen Citrat) tödlich. Achtundachtzig Prozent der Schlaganfälle traten zum Zeitpunkt der Randomisierung bei Frauen mindestens 50 Jahre alt. Unter Frauen, die Nolvadex (Tamoxifen Citrat) erhielten, traten die Ereignisse ab dem Behandlungstufer zwischen 1 und 63 Monaten (durchschnittlich = 30 Monate) auf.
Auswirkungen auf die Leber: Leberkrebs
In der schwedischen Studie unter Verwendung von Adjuvans Nolvadex (Tamoxifen Citrat) 40 mg/Tag für 2-5 Jahre 3 Fälle von Leberkrebs wurden in der Nolvadex (Tamoxifen Citrat) -Mehnte Gruppe vs. 1 Fall in der Beobachtungsgruppe (siehe siehe) berichtet (siehe Vorsichtsmaßnahmen- Karzinogenese ). In other clinical trials evaluating Nolvadex (Tamoxifen Citrat) no cases of liver cancer have been reported to date.
Ein Fall von Leberkrebs wurde in NSABP P-1 in einem Teilnehmer, der randomisiert auf Nolvadex (Tamoxifen Citrat) randomisiert wurde, berichtet.
Auswirkungen auf die Leber: Nicht-maligne Effekte
Nolvadex (Tamoxifen Citrat) has been associated with changes in liver enzyme levels Und on rare occasions a spectrum of more severe liver abnormalities including fatty liver cholestasis hepatitis Und hepatic necrosis. A few of these serious cases included fatalities. In most reported cases the relationship to Nolvadex (Tamoxifen Citrat) is uncertain. However some positive rechallenges Und dechallenges have been reported.
In der NSABP P-1-Studie wurden nur wenige Änderungen der Leberfunktion (SGOT SGPT Bilirubin alkalische Phosphatase) beobachtet (10 auf Placebo und 6 auf Nolvadex (Tamoxifen Citrat)). Serumlipide wurden nicht systematisch gesammelt.
Diclofenac Pot 50 mg Nebenwirkungen
Andere Krebsarten
Eine Reihe von zweiten Primärtumoren, die an anderen Stellen als dem Endometrium auftreten, wurde nach der Behandlung von Brustkrebs mit Nolvadex (Tamoxifen Citrat) in klinischen Studien berichtet. Daten aus den NSABP-B-14- und P-1-Studien zeigen keine Anstieg anderer (Nicht-Uterin-) Krebsarten bei Patienten, die Nolvadex (Tamoxifen Citrat) erhalten. Ob ein erhöhtes Risiko für andere Krebserkrankungen für andere (Nicht-Uterine) mit Nolvadex (Tamoxifen Citrat) verbunden ist, ist immer noch ungewiss und wird weiterhin bewertet.
Auswirkungen auf das Auge
Bei Patienten, die Nolvadex (Tamoxifen Citrat) erhielten, wurden Augenstörungen einschließlich Hornhautveränderungen, einschließlich Veränderungen der Farbsicht Wahrnehmung, Retinalvenenader und Retinopathie. Eine erhöhte Inzidenz von Katarakten und die Notwendigkeit einer Kataraktoperation wurde bei Patienten berichtet, die Nolvadex (Tamoxifen Citrat) erhalten.
In der NSABP-P-1-Studie wurde ein erhöhtes Risiko einer Grenznahrungsbedarf der Entwicklung von Katarakten bei diesen Frauen ohne Katarakten zu Studienbeginn (540-Nolvadex (Tamoxifen Citrat); 483-Placebo; RR = 1,13 95% CI: 1,00-1,28) beobachtet. Unter denselben Frauen, die nolvadex (Tamoxifen citrat) war, war mit einem erhöhten Risiko einer Kataraktoperation (101-Nolvadex (Tamoxifen Citrat); 63-Placebo; RR = 1,62 95% CI 1,18-2,22) verbunden (siehe Tabelle 3 in Tabelle 3 in Klinische Pharmakologie ). Among all women on the trial (with or without cataracts at baseline) Nolvadex (Tamoxifen Citrat) was associated with an increased risk of having cataract surgery (201-Nolvadex (Tamoxifen Citrat) ; 129-placebo; Rr=1.58 95% dort 1.26-1.97). Eye examinations were nicht required during the study. No other conclusions regarding non-cataract ophthalmic events can be made.
Schwangerschaft Kategorie d
Nolvadex (Tamoxifen Citrat) may cause fetal harm when administered to a pregnant woman. Frauen should be advised nicht to become pregnant while taking Nolvadex (Tamoxifen Citrat) or within 2 months of discontinuing Nolvadex (Tamoxifen Citrat) Und should use barrier or nonhormonal contraceptive measures if sexually active. Tamoxifen does nicht cause infertility even in the presence of menstrual irregularity. Effects on reproductive functions are expected from the antiestrogenic properties of the drug. In reproductive studies in rats at dose levels equal to or below the human dose nonteratogenic developmental skeletal changes were seen Und were found reversible. In addition in fertility studies in rats Und in teratology studies in rabbits using doses at or below those used in humans a lower incidence of embryo implantation Und a higher incidence of fetal death or retarded in utero growth were observed with slower learning behavior in some rat pups when compared to historical controls. Several pregnant marmosets were dosed with 10 mg/kg/day (about 2-fold the daily maximum recommended human dose on a mg/m² basis) during organogenesis or in the last half of pregnancy. No deformations were seen Und although the dose was high enough to terminate pregnancy in some animals those that did maintain pregnancy showed no evidence of teratogenic malformations.
In Nagetiermodellen der Entwicklung des fetalen Fortpflanzungstrakts führte Tamoxifen (bei Dosen 0,002 bis 2,4-fach die tägliche maximal empfohlene menschliche Dosis auf mg/m²-Basis) Veränderungen bei beiden Geschlechtern, die denen ähnlich sind, die durch Östradiol-Ethynylestradiol und Diethylstilbestrol verursacht wurden. Obwohl die klinische Relevanz dieser Veränderungen unbekannt ist, sind einige dieser Veränderungen, insbesondere die vaginale Adenose, denen ähnlich, die bei jungen Frauen beobachtet wurden, die Diethylstilbestrol in der Gebärmutter ausgesetzt waren und ein 1-zu-1000-Risiko für die Entwicklung eines klaren Adenokarzinoms der Vagina oder der Cervix haben. Bisher wurde nicht gezeigt, dass die Utero-Exposition gegenüber Tamoxifen bei jungen Frauen vaginaler Adenose oder Clear-Zell-Adenokarzinom der Vagina oder des Gebärmutterhalses verursacht. Allerdings wurde nur eine kleine Anzahl junger Frauen Tamoxifen in der Gebärmutter ausgesetzt, und es wurde eine geringere Anzahl lang genug befolgt (bis zum Alter von 15 bis 20 Jahren), um festzustellen, ob eine vaginale oder zervikale Neoplasie infolge dieser Exposition auftreten kann.
Es gibt keine angemessenen und gut kontrollierten Studien mit Tamoxifen bei schwangeren Frauen. Bei schwangeren Frauen gab es eine kleine Anzahl von Berichten über spontane Abtreibungen von Vaginalblutungen und fetalen Todesfällen. Wenn dieses Medikament während der Schwangerschaft angewendet wird oder der Patient während der Einnahme dieses Medikaments oder innerhalb von ungefähr zwei Monaten nach Abbruch der Therapie schwanger wird, sollte der Patient die potenziellen Risiken für den Fötus einschließlich des potenziellen langfristigen Risikos eines DES-ähnlichen Syndroms erkennen.
Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko - Schwangerschaft Kategorie d
Für sexuell aktive Frauen von potenziellen potenziellen potenziellen Nolvadex (Tamoxifen Citrat) sollte während der Menstruation eingeleitet werden. Bei Frauen mit Menstruationsunregelmäßigkeiten ist ein negativer B-HCG unmittelbar vor der Therapie-Therapie ausreichend (siehe VORSICHTSMASSNAHMEN- Informationen für Patienten - Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko Frauen ).
Vorsichtsmaßnahmen for Nolvadex
Allgemein
Gelegentlich wurden gelegentlich bei Patienten, die Nolvadex (Tamoxifen Citrat) gegen Brustkrebs einnahmen, gelegentlich bei Patienten mit Nolvadex (Tamoxifen-Citrat) wegen Brustkrebs eingenommen. Bei Patienten mit signifikanten Thrombozytopenie sind seltene hämorrhagische Episoden aufgetreten, aber es ist ungewiss, ob diese Episoden auf eine Nolvadex -Therapie (Tamoxifen -Citrat) zurückzuführen sind. Leukopenie wurde manchmal in Verbindung mit Anämie und/oder Thrombozytopenie beobachtet. Es gab seltene Berichte über Neutropenie und Panzytopenie bei Patienten, die Nolvadex (Tamoxifen Citrat) erhielten; Dies kann manchmal schwerwiegend sein.
In der NSABP-P-1-Studie erlebten 6 Frauen auf Nolvadex (Tamoxifen-Citrat) und 2 auf Placebo den Abfall 3-4 Grad 3-4 in Thrombozytenzahlen (≤ 50000/mm³).
Informationen für Patienten
Patienten sollten angewiesen werden, das zu lesen Medikamentenhandbuch geliefert wie gesetzlich vorgeschrieben, wenn Nolvadex abgegeben wird. Der vollständige Text der Medikamentenhandbuch wird am Ende dieses Dokuments nachgedruckt.
Verringerung des invasiven Brustkrebs und DCIS bei Frauen mit DCIs
Frauen with DCIS treated with lumpectomy Und radiation therapy who are considering Nolvadex (Tamoxifen Citrat) to reduce the incidence of a second breast cancer event should assess the risks Und benefits of therapy since treatment with Nolvadex (Tamoxifen Citrat) decreased the incidence of invasive breast cancer but has nicht been shown to affect survival (Sehen Table 1 in Klinische Pharmakologie ).
Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko
Frauen who are at high risk for breast cancer can consider taking Nolvadex (Tamoxifen Citrat) therapy to reduce the incidence of breast cancer. Whether the benefits of treatment are considered to outweigh the risks depends on a woman's personal health history Und on how she weighs the benefits Und risks. Nolvadex (Tamoxifen Citrat) therapy to reduce the incidence of breast cancer may therefore nicht be appropriate for all women at high risk for breast cancer. Frauen who are considering Nolvadex (Tamoxifen Citrat) therapy should consult their health care professional for an assessment of the potential benefits Und risks prior to starting therapy for reduction in breast cancer incidence (Sehen Table 3 in Klinische Pharmakologie ). Frauen should understUnd that Nolvadex (Tamoxifen Citrat) reduces the incidence of breast cancer but may nicht eliminate risk. Nolvadex (Tamoxifen Citrat) decreased the incidence of small estrogen receptor positive tumors but did nicht alter the incidence of estrogen receptor negative tumors or larger tumors. In women with breast cancer who are at high risk of developing a second breast cancer treatment with about 5 years of Nolvadex (Tamoxifen Citrat) reduced the annual incidence rate of a second breast cancer by approximately 50%.
Frauen who are pregnant or who plan to become pregnant should nicht take Nolvadex (Tamoxifen Citrat) to reduce her risk of breast cancer. Effective nonhormonal contraception must be used by all premenopausal women taking Nolvadex (Tamoxifen Citrat) Und for approximately two months after discontinuing therapy if they are sexually active. Tamoxifen does nicht cause infertility even in the presence of menstrual irregularity. Für sexuell aktive Frauen von potenziellen potenziellen potenziellen Nolvadex (Tamoxifen Citrat) sollte während der Menstruation eingeleitet werden. Bei Frauen mit Menstruationsunregelmäßigkeiten ist ein negativer B-HCG unmittelbar vor der Therapie-Therapie ausreichend (siehe WARNUNGS-Schwangerschaft Kategorie d ).
Zwei europäische Studien mit Tamoxifen zur Verringerung des Brustkrebsrisikos wurden durchgeführt und zeigten keinen Unterschied in der Anzahl der Brustkrebsfälle zwischen Tamoxifen und Placeboarmen. Diese Studien hatten Versuchsdesigns, die sich von der von NSABP P-1 unterschieden, die kleiner waren als NSABP P-1 und Frauen mit geringerem Risiko für Brustkrebs eingeschlossen als in P-1.
Überwachung während der Nolvadex -Therapie (Tamoxifen Citrat)
Frauen taking or having previously taken Nolvadex (Tamoxifen Citrat) should be instructed to seek prompt medical attention for new breast lumps vaginal bleeding gynecologic symptoms (menstrual irregularities changes in vaginal discharge or pelvic pain or pressure) symptoms of leg Schwellung or tenderness unexplained shortness of breath or changes in vision. Frauen should inform all care providers regardless of the reason for evaluation that they take Nolvadex (Tamoxifen Citrat) .
Frauen taking Nolvadex (Tamoxifen Citrat) to reduce the incidence of breast cancer should have a breast examination a mammogram Und a gynecologic examination prior to the initiation of therapy. These studies should be repeated at regular intervals while on therapy in keeping with good medical practice. Frauen taking Nolvadex (Tamoxifen Citrat) as adjuvant breast cancer therapy should follow the same monitoring procedures as for women taking Nolvadex (Tamoxifen Citrat) for the reduction in the incidence of breast cancer. Frauen taking Nolvadex (Tamoxifen Citrat) as treatment for metastatic breast cancer should review this monitoring plan with their care provider Und select the appropriate modalities Und schedule of evaluation.
Labortests
Es sollten periodische vollständige Blutzahlen einschließlich Thrombozytenzahlen und periodische Leberfunktionstests durchgeführt werden.
Während der ATAC -Studie wurde berichtet, dass mehr Patienten, die Anastrozol erhielten, ein erhöhtes Serumcholesterinspiegel im Vergleich zu Patienten, die Nolvadex erhielten (Tamoxifen -Citrat) (9% gegenüber 3,5%).
Karzinogenese
Eine herkömmliche Karzinogenese-Studie an Ratten mit Dosen von 5 20 und 35 mg/kg/Tag (etwa ein drei und siebenfach die tägliche maximal empfohlene menschliche Dosis an einer mg/m²basis), die von oraler Gavage für bis zu 2 Jahre verabreicht wurde), wurde eine signifikante Erhöhung des Hepatozellulations-Karzinoms für Dosen bei allen Dosen verabreicht. Die Inzidenz dieser Tumoren war bei den Ratten, die 20 oder 35 mg/kg/Tag (69%) verabreicht wurden, signifikant höher als bei 5 mg/kg/Tag (14%). In einer separaten Studie wurde den Ratten Tamoxifen mit 45 mg/kg/Tag verabreicht (etwa neunfach die tägliche maximal empfohlene menschliche Dosis mg/m²); Die hepatozelluläre Neoplasie wurde nach 3 bis 6 Monaten ausgestellt.
In zwei getrennten Mausstudien wurden Granulosa -Ovarial -Tumoren und interstitielle Zellzellentumoren beobachtet. Den Mäusen wurde die trans- und racemischen Formen von Tamoxifen 13 bis 15 Monate in Dosen von 5 20 und 50 mg/kg/Tag verabreicht (etwa die Hälfte zwei und fünffach die täglich empfohlene menschliche Dosis mg/m²).
Mutagenese
In einer herkömmlichen Batterie von wurde kein genotoxisches Potential gefunden vergeblich Und in vitro Tests mit pro- und eukaryotischen Testsystemen mit Arzneimittelmetabolisierungssystemen. Es wurden jedoch erhöhte Spiegel von DNA -Addukten beobachtet 32P nach dem markierten DNA aus Rattenleber und kultivierten menschlichen Lymphozyten. Es wurde auch festgestellt in vitro in menschlicher Lymphoblastoidzelllinie (MCL-5). Basierend auf diesen Befunden ist Tamoxifen in Nagetier- und menschlichen MCL-5-Zellen genotoxisch.
Beeinträchtigung der Fruchtbarkeit
Tamoxifen erzeugte eine Beeinträchtigung der Fruchtbarkeit und Konzeption bei weiblichen Ratten bei Dosen von 0,04 mg/kg/Tag (etwa 0,01-fach die tägliche maximal empfohlene menschliche Dosis auf mg/m²), wenn sie zwei Wochen vor der Paarung 7 der Schwangerschaft zwei Wochen lang dosiert wurden. Bei dieser Dosisfruchtbarkeit und Fortpflanzungsindizes wurden durch die Gesamtmortalität der Fötus deutlich verringert. Die fetale Mortalität war auch bei Dosen von 0,16 mg/kg/Tag (etwa 0,03-fach die tägliche maximal empfohlene menschliche Dosis mg/m²) erhöht, wenn weibliche Ratten von den Tagen 7-17 der Schwangerschaft dosiert wurden. Tamoxifen erzeugte eine vorzeitige Abgabe von Abtreibungen und den fetalen Tod in Kaninchen, die Dosen von einem oder mehr als 0,125 mg/kg/Tag verabreichten (ca. 0,05-fach das tägliche maximale empfohlene menschliche Dosis auf mg/m²). Es gab weder teratogene Veränderungen bei Ratten noch bei Kaninchen.
Schwangerschaft Kategorie d
Sehen WARNUNGS .
Pflegemütter
Es wurde berichtet, dass Tamoxifen die Laktation hemmen. Zwei placebokontrollierte Studien an über 150 Frauen haben gezeigt, dass Tamoxifen die frühe postpartale Milchproduktion signifikant hemmt. In beiden Studien wurde Tamoxifen innerhalb von 24 Stunden nach der Entbindung zwischen 5 und 18 Tage verabreicht. Die Wirkung von Tamoxifen auf die etablierte Milchproduktion ist nicht bekannt.
Es gibt keine Daten, die sich angehen, ob Tamoxifen in die Muttermilch ausgeschieden wird. Wenn es ausgeschieden wird, gibt es keine Daten zu den Auswirkungen von Tamoxifen in der Muttermilch auf das gestillte Säugling oder gestillte Tiere. Direkte Neugeborenenexposition von Tamoxifen gegenüber Mäusen und Ratten (nicht über die Muttermilch) produzierte jedoch 1 Fortpflanzungstraktläsionen bei weiblichen Nagetieren (ähnlich wie bei Menschen nach intrauterinem Exposition gegenüber Diethylstilbestrol) und 2) funktionelle Defekte der Fortpflanzungstrakt bei männlichen Rodents wie Testiscalular und Arrest von Spermatogenese.
Es ist nicht bekannt, ob Nolvadex (Tamoxifen -Citrat) in Muttermilch ausgeschieden wird. Aufgrund des Potenzials für schwerwiegende unerwünschte Reaktionen bei Säuglingen von Nolvadex (Tamoxifen citrat), die Nolvadex (Tamoxifen Citrat) einnehmen, sollten nicht stillen.
Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko with DCIS
Es ist nicht bekannt, ob Nolvadex (Tamoxifen -Citrat) in Muttermilch ausgeschieden wird. Aufgrund des Potenzials für schwerwiegende unerwünschte Reaktionen bei Säuglingen von Nolvadex (Tamoxifen citrat), die Nolvadex (Tamoxifen Citrat) einnehmen, sollten nicht stillen.
Pädiatrische Verwendung
Die Sicherheit und Wirksamkeit von Nolvadex (Tamoxifen Citrat) für Mädchen im Alter von zwei bis 10 Jahren mit dem McCune-Albright-Syndrom und der frühreifen Pubertät wurden nicht über ein Jahr der Behandlung hinaus untersucht. Die langfristigen Auswirkungen der Nolvadex-Therapie (Tamoxifen-Citrat) für Mädchen wurden nicht festgestellt. Bei Erwachsenen, die mit Nolvadex (Tamoxifen Citrat) behandelt wurden WARNUNG BOXED Und Klinische Pharmakologie- Klinische Studien -McCune-Albright-Syndrom Unterabschnitt).
Geriatrische Verwendung
In der NSABP P-1-Studie betrug der Prozentsatz der Frauen mindestens 65 Jahre 16%. Frauen im Alter von mindestens 70 Jahren machten 6% der Teilnehmer aus. Bei den Teilnehmern in jedem der Untergruppen wurde eine Verringerung der Inzidenz von Brustkrebs beobachtet: Insgesamt 28 und 10 invasive Brustkrebs wurden bei den Teilnehmern ab 65 und älter in den Gruppen von Placebo- und Nolvadex (Tamoxifen Citrat) beobachtet. In allen anderen Ergebnissen spiegeln die Ergebnisse in dieser Untergruppe die Ergebnisse der Untergruppe von Frauen mindestens 50 Jahre wider. Es wurden keine allgemeinen Unterschiede in der Verträglichkeit zwischen älteren und jüngeren Patienten beobachtet (siehe Klinische Pharmakologie - Klinische Studien - Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko Frauen Abschnitt).
In der NSABP B-24-Studie betrug der Prozentsatz der Frauen mindestens 65 Jahre 23%. Frauen im Alter von mindestens 70 Jahren machten 10% der Teilnehmer aus. Bei den Teilnehmern ab 65 und älter wurden insgesamt 14 und 12 invasive Brustkrebserkrankungen in den Gruppen von Placebo- und Nolvadex (Tamoxifen Citrat) beobachtet. Diese Untergruppe ist zu klein, um alle Schlussfolgerungen zur Wirksamkeit zu erzielen. In allen anderen Endpunkten waren die Ergebnisse in dieser Untergruppe mit denen jüngerer Frauen vergleichbar, die an dieser Studie teilgenommen haben. Es wurden keine allgemeinen Unterschiede in der Verträglichkeit zwischen älteren und jüngeren Patienten beobachtet.
Überdosierungsinformationen für Nolvadex
Anzeichen, die bei den höchsten Dosen nach Studien beobachtet wurden, um zu bestimmen Ld50 Bei Tieren waren Atemschwierigkeiten und Krämpfe.
Akute Überdosierung beim Menschen wurde nicht gemeldet. In einer Studie mit fortgeschrittenen metastasierten Krebspatienten, die spezifisch die maximal tolerierte Dosis von Nolvadex (Tamoxifen Citrat) bei der Beurteilung der Verwendung von sehr hohen Dosen zur Umkehrung der akuten Neurotoxizität von Multidrug -Resistenz durch Tremorhyperreflexie, die durch Tremorhyperreflexie unstabiler Gang und Schwindel manifestiert wurden, bestimmte. Diese Symptome traten innerhalb von 3-5 Tagen nach Beginn von Nolvadex (Tamoxifen Citrat) auf und wurden innerhalb von 2-5 Tagen nach der Beendigung der Therapie geräumt. Es wurde keine dauerhafte neurologische Toxizität festgestellt. Ein Patient erlebte mehrere Tage, nachdem Nolvadex (Tamoxifen -Citrat) abgesetzt worden war und die neurotoxischen Symptome aufgelöst hatten. Die kausale Beziehung der Anfälle zu Nolvadex (Tamoxifen Citrat) -Therapie ist unbekannt. Die bei diesen Patienten angegebenen Dosen waren alle mehr als 400 mg/m² Beladendosis, gefolgt von Erhaltungsdosen von 150 mg/m² Nolvadex (Tamoxifen -Citrat), die zweimal täglich verabreicht wurden.
In derselben Studie wurde eine Verlängerung des QT -Intervalls am Elektrokardiogramm festgestellt, wenn Patienten eine Dosis von mehr als 250 mg/m² Lastdosis verabreichten, gefolgt von Erhaltungsdosen von 80 mg/m² Nolvadex (Tamoxifen -Citrat), die zweimal am Tag angegeben wurden. Für eine Frau mit einer Körperoberfläche von 1,5 m² waren die minimalen Belastungsdosis und Erhaltungsdosen, die bei den neurologischen Symptomen und den QT -Veränderungen in Bezug auf die maximal empfohlene Dosis mindestens 6 -fache auftraten.
Es ist keine spezifische Behandlung für Überdosierung bekannt; Die Behandlung muss symptomatisch sein.
Kontraindikationen für Nolvadex
Nolvadex (Tamoxifen Citrat) is contraindicated in patients with known hypersensitivity to the drug or any of its ingredients.
Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko Und Frauen with DCIS
Nolvadex (Tamoxifen Citrat) is contraindicated in women who require concomitant coumarin-type anticoagulant therapy or in women with a history of deep vein thrombosis or pulmonary embolus.
Klinische Pharmakologie for Nolvadex
Nolvadex (Tamoxifen Citrat) is a nonsteroidal agent that has demonstrated potent antiestrogenic properties in animal test systems. The antiestrogenic effects may be related to its ability to compete with estrogen for binding sites in target tissues such as breast. Tamoxifen inhibits the induction of rat mammary carcinoma induced by dimethylbenzanthracene (DMBA) Und causes the regression of already established DMBA-induced tumors. In this rat model tamoxifen appears to exert its antitumor effects by binding the estrogen receptors.
In Cytosolen, die aus menschlichen Brust -Adenokarzinomen stammen, konkurriert Tamoxifen mit Östradiol gegen Östrogenrezeptorprotein.
Absorption und Verteilung
Nach einer einzelnen oralen Dosis von 20 mg Tamoxifen trat eine durchschnittliche Spitzenplasmakonzentration von 40 ng/ml (Bereich 35 bis 45 ng/ml) ungefähr 5 Stunden nach der Dosierung auf. Der Rückgang der Plasmakonzentrationen von Tamoxifen ist zweiphasig mit einer Halbwertszeit von etwa 5 bis 7 Tagen. Die durchschnittliche Spitzenplasmakonzentration von N-Desmethyl-Tamoxifen beträgt 15 ng/ml (Bereich 10 bis 20 ng/ml). Die chronische Verabreichung von 10 mg Tamoxifen, die zweimal täglich 3 Monate bis Patienten verabreicht werden, führt zu den durchschnittlichen Plasmakonzentrationen von 120 ng/ml (Bereich 67-183 ng/ml) für Tamoxifen und 336 ng/ml (Bereich 148-654 ng/ml) für N-Desmethyl Tamoxifen. Die durchschnittlichen Plasmakonzentrationen von Tamoxifen und N-Desmethyl Tamoxifen nach Verabreichung von 20 mg Tamoxifen betragen 3 Monate lang 122 ng/ml (Bereich 71-183 ng/ml) und 353 ng/ml (Bereich 152-706 ng/ml). Nach Beginn der Therapiekonzentrationen für Tamoxifen werden in etwa 4 Wochen die Konzentrationen für N-Desmethyl-Tamoxifen in etwa 8 Wochen erreicht, was auf eine Halbwertszeit von ungefähr 14 Tagen für diesen Metaboliten erreicht wird. In a steady-state crossover study of 10 mg NOLVADEX (tamoxifen citrate) tablets given twice a day vs. a 20 mg NOLVADEX (tamoxifen citrate) tablet given once daily the 20 mg NOLVADEX (tamoxifen citrate) tablet was bioequivalent to the 10 mg NOLVADEX (tamoxifen citrate) tablets.
Stoffwechsel
Tamoxifen wird nach oraler Verabreichung ausführlich metabolisiert. N-Desmethyl-Tamoxifen ist der Hauptmetaboliten, der im Plasma der Patienten vorkommt. Die biologische Aktivität von N-Desmethyl-Tamoxifen scheint der von Tamoxifen ähnlich zu sein. 4-Hydroxytamoxifen und eine Seitenkette primäres Alkoholderivat von Tamoxifen wurden als kleinere Metaboliten in Plasma identifiziert. Tamoxifen ist ein Substrat von Cytochrom P-450 3A 2C9 und 2D6 und ein Inhibitor von P-Glykoprotein.
Ausscheidung
Studien an Frauen, die 20 mg von erhalten 14C tamoxifen haben gezeigt, dass ungefähr 65% der verabreichten Dosis über einen Zeitraum von 2 Wochen mit der Ausscheidung der Fäkalien aus dem Körper als Hauptaufwand ausgeschieden wurden. Das Medikament wird hauptsächlich als polare Konjugate mit unveränderten Arzneimitteln und unkonjugierten Metaboliten ausgeschieden, die weniger als 30% der gesamten Fäkalien -Radioaktivität ausmachen.
Besondere Populationen
Die Auswirkungen des Altersgeschlechts und der Rasse auf die Pharmakokinetik von Tamoxifen wurden nicht bestimmt. Die Auswirkungen einer verringerten Leberfunktion auf den Stoffwechsel und die Pharmakokinetik von Tamoxifen wurden nicht bestimmt.
Pädiatrische Patienten
Die Pharmakokinetik von Tamoxifen und N-Desmethyl-Tamoxifen wurde unter Verwendung einer Populations pharmakokinetischen Analyse mit Spärproben pro Patient charakterisiert, die von 27 weiblichen pädiatrischen Patienten im Alter von 2 bis 10 Jahren erhalten wurden, um die Sicherheitseffizienz und die Pharmakokinetik von Nolvadx (Tamoxifen-Citrat) zu bewerten. Reiche Daten aus zwei Tamoxifen -Citrat -pharmakokinetischen Studien, in denen 59 postmenopausale Frauen mit Brustkrebs die Studien abgeschlossen wurden, wurden in die Analyse einbezogen, um das strukturelle pharmakokinetische Modell für Tamoxifen zu bestimmen. Ein Ein-Kompartiment-Modell bot die beste Anpassung an die Daten.
Bei pädiatrischen Patienten betrug eine durchschnittliche Plasmakonzentration des stationären Peak -Plasmas (CSS max) und AUC 187 ng/ml bzw. 4110 ng Stunde/ml und CSS max trat ungefähr 8 Stunden nach der Dosierung auf. Die Clearance (CL/F) als Körpergewicht bei weiblichen pädiatrischen Patienten war ungefähr 2,3-fach höher als bei weiblichen Brustkrebspatienten. In der jüngsten Kohorte weiblicher pädiatrischer Patienten (2-6-Jährige) war Cl/F 2,6-fach höher; In der ältesten Kohorte (7-10,9-Jährige) war CL/F ungefähr das 1,9-fache höher. Die Exposition gegenüber N-Desmethyl-Tamoxifen war zwischen den pädiatrischen und erwachsenen Patienten vergleichbar. Die Sicherheit und Wirksamkeit von Nolvadex (Tamoxifen Citrat) für Mädchen im Alter von zwei bis 10 Jahren mit dem McCune-Albright-Syndrom und der frühreifen Pubertät wurden nicht über ein Jahr der Behandlung hinaus untersucht. Die langfristigen Auswirkungen der Nolvadex-Therapie (Tamoxifen-Citrat) bei Mädchen wurden nicht festgestellt. Bei Erwachsenen, die mit Nolvadex (Tamoxifen Citrat) behandelt wurden WARNUNG BOXED ).
Wechselwirkungen mit Drogenmedikamenten
In vitro Studien zeigten, dass Erythromycin-Cyclosporin-Nifedipin und Diltiazem die Bildung von N-Desmethyl-Tamoxifen mit offensichtlichen Konzern konkurrierend hemmten K1 von 20 1 45 bzw. 30 µm. Die klinische Bedeutung dieser in vitro Studien sind unbekannt.
Tamoxifen reduzierte die Plasmakonzentration von Letrozol um 37%, wenn diese Medikamente gemeinsam verabreicht wurden. Rifampin A Cytochrom P-450 3A4 reduzierte Tamoxifen AUC und Cmax um 86% bzw. 55%. Aminoglutethimid reduziert die Tamoxifen- und N-Desmethyl-Tamoxifen-Plasmakonzentrationen. Medroxyprogesteron reduziert die Plasmakonzentrationen von N-Desmethyl, jedoch nicht Tamoxifen.
In der Anastrozol-Adjuvans-Studie wurde die gleichzeitige Verabreichung von Anastrozol und Nolvadex (Tamoxifen Citrat) bei Brustkrebspatienten die Anastrozol-Plasmakonzentration um 27% im Vergleich zu denen reduziert, die mit Anastrozol allein erreicht wurden. Die gleichzeitige Verabreichung hatte jedoch keinen Einfluss auf die Pharmakokinetik von Tamoxifen oder N-Desmethyltamoxifen (siehe VORSICHTSMASSNAHMEN - Wechselwirkungen mit Arzneimitteln ). Nolvadex (Tamoxifen Citrat) should nicht be co-administered with anastrozole.
Klinische Studien
Metastasierter Brustkrebs
Prämenopausale Frauen (Nolvadex (Tamoxifen Citrat) vs. Ablation)
Drei prospektive randomisierte Studien (Ingle Pritchard Buchanan) verglichen Nolvadex (Tamoxifen Citrat) mit der Ovarialablation (Oophorektomie oder der Bestrahlung von Ovarien) bei Frauen vor der Menopause mit fortgeschrittenem Brustkrebs. Obwohl die objektive Ansprechrate für Behandlungsversagen und -überleben mit beiden Behandlungen ähnlich waren, verhinderte der begrenzte Patientenabzug eine Demonstration der Äquivalenz. In einer Übersichtsanalyse der Überlebensdaten aus den 3 Studien betrug das Hazard-Verhältnis für den Tod (Nolvadex (Tamoxifen Citrat) /Ovarialablation) 1,00 mit zweiseitigen 95% -Konfidenzintervallen von 0,73 bis 1,37. Erhöhte Serum- und Plasma -Östrogene wurden bei Frauen vor der Menopause beobachtet, die Nolvadex (Tamoxifen Citrat) erhalten, aber die Daten aus den randomisierten Studien deuten nicht auf eine nachteilige Wirkung dieser Erhöhung hin. Eine begrenzte Anzahl von Patienten mit dem Vormenopausal mit dem Fortschreiten von Krankheiten während der Nolvadex -Therapie (Tamoxifen -Citrat) reagierte auf die nachfolgende Ovarialablation.
Männlicher Brustkrebs
Veröffentlichte Ergebnisse von 122 Patienten (119 Evaluable) und Fallberichte bei 16 mit Nolvadex (Tamoxifen Citrat) behandelten Patienten (13 evaluierbar) haben gezeigt, dass Nolvadex (Tamoxifen Citrat) für die Palliativbehandlung von männlichem Brustkrebs wirksam ist. Sechsundsechzig dieser 132 bewertbaren Patienten reagierten auf Nolvadex (Tamoxifen Citrat), was eine objektive Ansprechrate von 50% ausmacht.
Adjuvanter Brustkrebs
Überblick
Die Collaborative Group (EBCTCG) der frühen Brustkrebs durchführte 1985 1990 weltweite Übersichten der systemischen Adjuvans-Therapie. 1998 wurden 10-jährige Daten für die 10-Jahres-Ergebnisse für 36689 Frauen in 55 randomisierten Studien mit Adjuvant-Nolvadex (Tamoxifen Citrat) berichtet. 25 Prozent der Patienten erhielten 1 Jahr oder weniger Studienbehandlung 52% 2 Jahre und 23% rund 5 Jahre. Achtundvierzig Prozent der Tumoren waren Östrogenrezeptor (ER) positiv (> 10 FMOL/mg) 21% waren arm (schlecht (schlecht ( <10 fmol/l) Und 31% were ER unknown. Among 29441 patients with ER positive or unknown breast cancer 58% were entered into trials comparing Nolvadex (Tamoxifen Citrat) to no adjuvant therapy Und 42% were entered into trials comparing Nolvadex (Tamoxifen Citrat) in combination with Chemotherapie vs. the same Chemotherapie alone. Among these patients 54% had node positive disease Und 46% had node negative disease.
Unter Frauen mit ER -positiven oder unbekannten Brustkrebs und positiv <0.00001). The recurrence-free rate at 10 years was 59.7% for Nolvadex (Tamoxifen Citrat) vs. 44.5% for control (logrank 2p < 0.00001). Among women with ER positive or unknown breast cancer Und negative nodes who received about 5 years of treatment overall survival at 10 years was 78.9% for Nolvadex (Tamoxifen Citrat) vs. 73.3% for control (logrank 2p < 0.00001). The recurrence-free rate at 10 years was 79.2% for Nolvadex (Tamoxifen Citrat) versus 64.3% for control (logrank 2p < 0.00001).
Die Wirkung der geplanten Dauer von Tamoxifen kann wie folgt beschrieben werden. Bei Frauen mit ER -positiven oder unbekannten Brustkrebs, die 1 Jahr oder weniger 2 Jahre oder etwa 5 Jahre Nolvadex (Tamoxifen Citrat) erhalten <0.003). The corresponding reductions in breast cancer recurrence were 21% 29% Und 47% (trend significant at 2p < 0.00001).
Der Nutzen ist für Frauen mit schlechtem Brustkrebs weniger klar, bei denen die proportionale Verringerung des Wiederauftretens 10% (2p = 0,007) für alle zusammengenommenen Dauern oder 9% (2p = 0,02) betrug, wenn kontralaterale Brustkrebs ausgeschlossen werden. Die entsprechende Verringerung der Mortalität betrug 6% (NS). Die Auswirkungen von etwa 5 Jahren Nolvadex (Tamoxifen -Citrat) auf Rezidiv und Mortalität waren unabhängig von Alter und gleichzeitiger Chemotherapie ähnlich. Es gab keinen Hinweis darauf, dass Dosen von mehr als 20 mg pro Tag effektiver waren.
Anastrozole Adjuvant ATAC Trial - Study of Anastrozole compared to Nolvadex (Tamoxifen Citrat) for Adjuvant Treatment of Early Breast Cancer - Eine Anastrozol -Adjuvante -Studie wurde in 9366 Frauen nach der Menopause mit operierbarem Brustkrebs durchgeführt, die randomisiert wurden, um eine adjuvante Behandlung mit Anastrozol 1 mg täglich Nolvadex (Tamoxifen -Citrat) täglich oder eine Kombination dieser beiden Behandlungen für fünf Jahre oder bis zum Wiederholung der Krankheit zu erhalten. Bei einer medianen Nachbeobachtung von 33 Monaten zeigte die Kombination von Anastrozol und Nolvadex (Tamoxifen Citrat) im Vergleich zu Nolvadex (Tamoxifen-Citrat) allein bei allen Patienten einen Wirksamkeitsvorteil im Vergleich zu Nolvadex (Tamoxifen-Citrat). Dieser Behandlungsarm wurde aus der Studie abgebrochen. Bitte beziehen Sie sich auf Klinische Pharmakologie-Besondere Populationen-Wechselwirkungen mit Drogenmedikamenten VORSICHTSMASSNAHMEN-Labortests VORSICHTSMASSNAHMEN-Wechselwirkungen mit Arzneimitteln Und Nebenwirkungen Abschnitte für Sicherheitsinformationen aus diesem Versuch. Weitere Informationen zu dieser Testversion finden Sie in den vollständigen Verschreibungsinformationen für Arimidex® (Anastrozol) 1 mg Tablets.
Patienten in den beiden Monotherapiearmen der ATAC -Studie wurden für einen Durchschnitt von 60 Monaten (5 Jahre) behandelt und nach einem Median von 68 Monaten folgten. Das krankheitsfreie Überleben in der Intent-to-Treat-Population war statistisch signifikant verbessert [Hazard-Verhältnis (HR) = 0,87 95% CI: 0,78 0,97 p = 0,0127] im Anastrazolarm im Vergleich zum Nolvadex-Arm (Tamoxifen) Arm.
Knoten positiv - einzelne Studien
Zwei Studien (Hubay und NSABP B-09) zeigten ein verbessertes krankheitsfreies Überleben nach radikaler oder modifizierter radikaler Mastektomie bei Frauen oder Frauen nach der Menopause, die 50 Jahre oder älter mit chirurgisch heilbarem Brustkrebs mit positiven axillären Knoten bei adjuvanter Cytotoxic-Chemotherapie (Tamoxifen-Citrat) zugefügt wurden. In der Hubay -Studie wurde Nolvadex (Tamoxifen Citrat) zugesetzt
In der Hubay -Studie waren Patienten mit einem positiven (mehr als 3 FMOL) Östrogenrezeptor mit größerer Wahrscheinlichkeit davon profitieren. In der NSABP-B-09-Studie an Frauen im Alter von 50 bis 59 Jahren profitierten nur Frauen mit Östrogen- und Progesteronrezeptorspiegeln 10 FMOL oder größer eindeutig, während es bei Frauen mit Östrogen- und Progesteronrezeptorspiegeln weniger als 10 FMOL einen nicht statistisch signifikanten Trend zur nachteiligen Wirkung bei Frauen gab. Bei Frauen im Alter von 60 bis 70 Jahren gab es einen Trend zu einer vorteilhaften Wirkung von Nolvadex (Tamoxifen Citrat) ohne klare Beziehung zum Östrogen- oder Progesteronrezeptorstatus.
Drei prospektive Studien (ECOG-1178 Toronto NATO) unter Verwendung von Nolvadex (Tamoxifen-Citrat) als einzelner Mittel zeigten ein verbessertes krankheitsfreies Überleben nach Gesamtmastektomie und Achselhöhlendissektion für Frauen nach der Menopausal mit positiven Achsenknoten im Vergleich zu Placebo/NO-Behandlungskontrollen. Die NATO -Studie zeigte auch einen allgemeinen Überlebensvorteil.
Knoten negativ - einzelne Studien
NSABP B-14 Eine prospektive doppelblinde randomisierte Studie verglich Nolvadex (Tamoxifen Citrat) mit Placebo bei Frauen mit axillärem Knotennoten-negativem Östrogenrezeptor-positiv Eine zusätzliche randomisierte Studie (NATO) zeigte ein verbessertes krankheitsfreies Überleben für Nolvadex (Tamoxifencitrat) im Vergleich zu einer adjuvanten Therapie nach Gesamtmastektomie und axillärer Dissektion bei postmenopausalen Frauen mit axillären Knotennegativen Brustkrebs. In dieser Studie schienen die Vorteile von Nolvadex (Tamoxifen Citrat) unabhängig vom Östrogenrezeptorstatus zu sein. Therapiedauer In der Übersicht über die EBCTCG von 1995 war die Verringerung von Rezidiven und Mortalität in den Studien größer, in denen Tamoxifen etwa 5 Jahre lang verwendet wurden als bei denen, die Tamoxifen für eine kürzere Therapiezeit verwendeten. In der NSABP B-14-Studie, in der die Patienten 5 Jahre lang auf Nolvadex (Tamoxifen Citrat) 20 mg/Tag randomisiert wurden und am Ende dieses 5-Jahres-Zeitraums krankheitsfrei waren, wurden für weitere 5 Jahre Nolvadex (Tamoxifen-Citrat) oder Placebo. Mit 4 Jahren Nachuntersuchung nach dieser Rerandomisierung waren 92% der Frauen, die 5 Jahre Nolvadex (Tamoxifen Citrat) erhielten, lebendig und krankheitsfrei, verglichen mit 86% der Frauen, die 10 Jahre Nolvadex (Tamoxifen-Citrat) erhalten hatten (p = 0,003). Die Gesamtüberlebenden betrugen 96% bzw. 94% (p = 0,08). Die Ergebnisse der B-14-Studie legen nahe, dass die Fortsetzung der Therapie über 5 Jahre hinaus keinen zusätzlichen Nutzen bietet. Eine schottische Studie mit 5 Jahren Tamoxifen gegen unbestimmte Behandlung ergab ein krankheitsfreies Überleben von 70% in der Fünfjahresgruppe und 61% in der unbestimmten Gruppe mit 6,2 Jahren medianer Follow-up (HR = 1,27 95% CI 0,87-1,85). In einer großen randomisierten Studie, die von der schwedischen Brustkrebs-Genossenschaftsgruppe adjuvanter Nolvadex (Tamoxifen Citrat) 40 mg/Tag für 2 oder 5 Jahre durchgeführt wurde, wurde bei der 5-Jahres-Tamoxifen-Gruppe bei der 2-Jahres-Behandlungsgruppe 40 mg/Tag für 2 oder 5 Jahre nach 10 Jahren auf 80% auf 80% geschätzt. Das krankheitsfreie Überleben nach 10 Jahren betrug 73% in der 5-Jahres-Gruppe und 67% in der 2-Jahres-Gruppe (P = 0,009). Im Vergleich zu 2 Jahren der Tamoxifen -Behandlung führte 5 Jahre Behandlung zu einer geringfügigen Verringerung der Inzidenz von kontralateralem Brustkrebs nach 10 Jahren, aber dieser Unterschied war statistisch nicht signifikant. Kontralateraler Brustkrebs Die Inzidenz von kontralateralem Brustkrebs wird bei Brustkrebspatienten (vormenopausal und postmenopausal) im Vergleich zu Placebo Nolvadex (Tamoxifen Citrat) verringert. Daten zu kontralateralem Brustkrebs sind bei 32422 von 36689 Patienten bei der Übersichtsanalyse der frühen Brustkrebs -Studiengruppe (EBCTCG) von 1995 verfügbar. In klinischen Studien mit Nolvadex (Tamoxifen Citrat) von 1 Jahr oder weniger 2 Jahren und etwa 5 Jahren Dauer Die proportionalen Verringerung der Inzidenzrate von kontralateralem Brustkrebs bei Frauen, die Nolvadex erhielten <0.00001) with a significant trend favoring longer tamoxifen duration (2p = 0.008). The proportional reductions in the incidence of contralateral breast cancer were independent of age Und ER status of the primary tumor. Treatment with about 5 years of Nolvadex (Tamoxifen Citrat) reduced the annual incidence rate of contralateral breast cancer from 7.6 per 1000 patients in the control group compared with 3.9 per 1000 patients in the tamoxifen group. In einer großen randomisierten Studie in Schweden (der Stockholm-Studie) von Adjuvans Nolvadex (Tamoxifen Citrat) 40 mg/Tag für 2-5 Jahre betrug die Inzidenz von zweiten primären Brusttumoren um 40% (P. <0.008) on tamoxifen compared to control. In the NSABP B-14 trial in which patients were rUndomized to Nolvadex (Tamoxifen Citrat) 20 mg/day for 5 years vs. placebo the incidence of second primary breast cancers was also significantly reduced (p < 0.01). In NSABP B-14 the annual rate of contralateral breast cancer was 8.0 per 1000 patients in the placebo group compared with 5.0 per 1000 patients in the tamoxifen group at 10 years after first rUndomization. NSABP B-24 Eine randomisierte doppelblinde Studie umfasste Frauen mit duktalem Karzinom in situ (DCIS). Diese Studie verglich die Zugabe von Nolvadex (Tamoxifen -Citrat) oder Placebo zur Behandlung mit Lumpektomie und Strahlentherapie bei Frauen mit DCIS. Das Hauptziel bestand darin, festzustellen, ob 5 Jahre Nolvadex (Tamoxifen Citrat) -Therapie (20 mg/Tag) die Inzidenz von invasivem Brustkrebs in der ipsilateralen (derselben) oder kontralateralen (entgegengesetzten) Brust verringern würde. In dieser Studie wurden 1804 Frauen für 5 Jahre entweder Nolvadex (Tamoxifen -Citrat) oder Placebo erhielten: 902 Frauen wurden nach Randomisiert in Nolvadex (Tamoxifen Citrat) 10 mg Tabletten zweimal täglich und 902 Frauen wurden nach Placebo randomisiert. Zum 31. Dezember 1998 standen Follow-up-Daten für 1798 Frauen zur Verfügung und die durchschnittliche Nachuntersuchungsdauer betrug 74 Monate. Die Nolvadex (Tamoxifen Citrat) und Placebo -Gruppen waren für demografische und prognostische Basisfaktoren gut ausbalanciert. Über 80% der Tumoren waren weniger als oder gleich 1 cm in ihrer maximalen Dimension waren nicht tastbar und wurden durch Mammographie allein nachgewiesen. Über 60% der Studienpopulation waren postmenopausal. Bei 16% der Patienten wurde nach der Operation der Rand des resezierten Probens als positiv angegeben. Ungefähr die Hälfte der Tumoren enthielt eine Comedo -Nekrose. Für den primären Endpunkt wurde die Inzidenz von invasivem Brustkrebs bei Frauen, die Nolvadex (Tamoxifen Citrat) zugeordnet waren, um 43% reduziert (44 Fälle - Nolvadex (Tamoxifen Citrat) 74 Fälle - Placebo; p = 0,004; Über den ER -Status der invasiven Krebserkrankungen sind keine Daten verfügbar. Die Stadiumverteilung der invasiven Krebserkrankungen bei der Diagnose war ähnlich wie bei der SEER -Datenbank. Die Ergebnisse sind in Tabelle 1 gezeigt. Für jeden Endpunkt werden die folgenden Ergebnisse dargestellt: die Anzahl der Ereignisse und die Rate pro 1000 Frauen pro Jahr für die Gruppen von Placebo und Nolvadex (Tamoxifen Citrat); und das relative Risiko (RR) und sein assoziiertes 95% -Konfidenzintervall (CI) zwischen Nolvadex (Tamoxifen Citrat) und Placebo. Relative Risiken von weniger als 1,0 weisen auf einen Nutzen einer Nolvadex -Therapie (Tamoxifen -Citrat) hin. Die Grenzen der Konfidenzintervalle können verwendet werden, um die statistische Signifikanz der Vorteile der Nolvadex -Therapie (Tamoxifen -Citrat) zu bewerten. Wenn die Obergrenze des CI weniger als 1,0 beträgt, besteht ein statistisch signifikanter Nutzen. Tabelle 1. Hauptergebnisse des NSABP B-24-Versuchs Das Überleben war in den Placebo- und Nolvadex -Gruppen (Tamoxifen -Citrat) ähnlich. Nach 5 Jahren nach dem Überleben der Studieneinreise betrug das Überleben von 97% für beide Gruppen. Verringerung der Inzidenz von Brustkrebs bei Frauen mit hohem Risiko: Die Studie zur Prävention von Brustkrebs (BCPT NSABP P-1) war eine doppelblinde randomisierte, placebokontrollierte Studie mit einem Hauptziel Indikationen und Nutzung ). Secondary objectives included an evaluation of the incidence of ischemic heart disease; the effects on the incidence of bone fractures; Und other events that might be associated with the use of Nolvadex (Tamoxifen Citrat) including: endometrial cancer pulmonary embolus deep vein thrombosis stroke Und cataract formation Und surgery (Sehen WARNUNGS ). Das GAIL -Modell wurde verwendet, um das vorhergesagte Brustkrebsrisiko für Frauen im Alter von weniger als 60 Jahren zu berechnen und kein lobuläres Karzinom in situ (LCIS) zu berechnen. Die folgenden Risikofaktoren wurden verwendet: Alter; Anzahl der weiblichen Verwandten ersten Grades mit Brustkrebs; frühere Brustbiopsien; Vorhandensein oder Fehlen einer atypischen Hyperplasie; Nulliparität; Alter bei der ersten lebenden Geburt; und Alter bei Menarche. Für den Eintritt in die Studie war ein 5-Jahres-Risiko für Brustkrebs von ≥ 1,67% erforderlich. In dieser Studie wurden 13388 Frauen im Alter von mindestens 35 Jahren fünf Jahre lang entweder Nolvadex (Tamoxifen Citrat) oder Placebo erhielten. Die mediane Behandlungsdauer betrug 3,5 Jahre. Zum 31. Januar 1998 sind Follow-up-Daten für 13114 Frauen verfügbar. 27 Prozent der Frauen, die auf Placebo (1782) randomisiert wurden (1782) und 24% der Frauen, die zu Nolvadex (Tamoxifen Citrat) (1596) randomisiert wurden, absolvierten 5 Jahre Therapie. Die demografischen Merkmale von Frauen in der Versuch mit Follow-up-Daten sind in Tabelle 2 aufgeführt. Tabelle 2. Demografische Merkmale von Frauen im NSABP P-1-Versuch Die Ergebnisse sind in Tabelle 3 gezeigt. Nach einer mittleren Follow-up von 4,2 Jahren wurde die Inzidenz von invasivem Brustkrebs bei Frauen, die Nolvadex (Tamoxifen Citrat) zugeordnet waren <0.00001; relative risk (Rr)=0.56 95% dort: 0,43-0,72). A reduction in the incidence of breast cancer was seen in each prospectively specified age group ( ≤ 49 50-59 ≥ 60) in women with or without LCIS Und in each of the absolute risk levels specified in Table 3. A non-significant decrease in the incidence of ductal carcinoma in situ (DCIS) was seen (23-Nolvadex (Tamoxifen Citrat) 35-placebo; Rr=0.66; 95% dort: 0,39-1.11). Es gab keinen statistisch signifikanten Unterschied in der Anzahl der myokardialen Infarkte schwere Angina oder akute ischämische kardiale Ereignisse zwischen den beiden Gruppen (61-Nolvadex (Tamoxifen Citrat) 59-Placebo; RR = 1,04 95% CI: 0,73-1,49). Es war kein Gesamtunterschied in der Sterblichkeit (53 Todesfälle in Nolvadex (Tamoxifen Citrat) -Gruppe gegenüber 65 Todesfällen in der Placebo -Gruppe). Es wurde kein Unterschied in der Brustkrebs-Mortalität beobachtet (4 Todesfälle in der Nolvadex-Gruppe (Tamoxifen Citrat) gegenüber 5 Todesfällen in der Placebo-Gruppe). Obwohl die Anzahl der Hüftfrakturen (9 auf Nolvadex (Tamoxifen Citrat) in Placebo (9 auf Placebo) in den Nolvadex (Tamoxifen-Citrat) nicht signifikant war, war die Anzahl der in den beiden Behandlungsgruppen (69 auf Nolvadex) ähnlich (69 auf Nolvadex (Tamoxifen Citrat). Eine Subgruppenanalyse der P-1-Studie legt einen Unterschied in der Knochenmineraldichte (BMD) im Zusammenhang mit dem Menopausestatus bei Patienten, die Nolvadex (Tamoxifen Citrat) erhalten, nahe. Bei Frauen nach der Menopause gab es keinen Hinweis auf den Knochenverlust der Lendenwirbelsäule und der Hüfte. Umgekehrt war Nolvadex (Tamoxifen Citrat) mit einem signifikanten Knochenverlust der Lendenwirbelsäule und der Hüfte bei Frauen vor der Menopause verbunden. Die Risiken einer Nolvadex (Tamoxifen -Citrat) -Therapie umfassen Endometriumkrebs -DVT -PE -Schlaganfall -Kataraktbildung und Kataraktoperation (siehe Tabelle 3). In der NSABP-P-1-Studie wurden in der Gruppe Nolvadex (Tamoxifen Citrat) in der Placebogruppe (RR = 2,48 95% CI: 1,27-4,92) 33 Fälle von Endometriumkrebs beobachtet. Bei 30 Frauen, die Nolvadex (Tamoxifen Citrat) erhielten, wurde eine tiefe Venenthrombose (Tamoxifen Citrat) gegen 19 bei Frauen erhalten, die Placebo erhielten (RR = 1,59 95% CI: 0,86-2,98). Achtzehn Fälle von Lungenembolie wurden in der Gruppe Nolvadex (Tamoxifen Citrat) gegenüber 6 in der Placebo-Gruppe beobachtet (RR = 3,01 95% CI: 1,15-9,27). Es gab 34 Striche am Nolvadex-Arm (Tamoxifen Citrat) und 24 am Placebo-Arm (RR = 1,42; 95% CI: 0,82-2,51). Die Kataraktbildung bei Frauen ohne Katarakten zu Studienbeginn wurde bei 540 Frauen beobachtet, die Nolvadex (Tamoxifen Citrat) gegen 483 Frauen einnahmen, die Placebo erhalten (RR = 1,13 95% CI: 1,00-1,28). Kataraktchirurgie (mit oder ohne Katarakte zu Studienbeginn) wurde bei 201 Frauen durchgeführt, die Nolvadex (Tamoxifen Citrat) gegen 129 Frauen einnahmen, die Placebo erhalten (RR = 1,51 95% CI: 1,21-1,89) (siehe WARNUNGS ). Tabelle 3 fasst die wichtigsten Ergebnisse des NSABP P-1-Versuchs zusammen. Für jeden Endpunkt werden die folgenden Ergebnisse vorgestellt: die Anzahl der Ereignisse und die Rate pro 1000 Frauen pro Jahr für die Placebo- und Nolvadex -Gruppen (Tamoxifen Citrat); und das relative Risiko (RR) und sein assoziiertes 95% -Konfidenzintervall (CI) zwischen Nolvadex (Tamoxifen Citrat) und Placebo. Relative Risiken von weniger als 1,0 weisen auf einen Nutzen einer Nolvadex -Therapie (Tamoxifen -Citrat) hin. Die Grenzen der Konfidenzintervalle können verwendet werden, um die statistische Signifikanz der Vorteile oder Risiken der Nolvadex -Therapie (Tamoxifen -Citrat) zu bewerten. Wenn die Obergrenze des CI weniger als 1,0 beträgt, besteht ein statistisch signifikanter Nutzen. Für die meisten Teilnehmer wären für die Berechtigung mehrere Risikofaktoren erforderlich gewesen. Diese Tabelle berücksichtigt Risikofaktoren einzeln, unabhängig von anderen nebeneinander bestehenden Risikofaktoren für Frauen, die Brustkrebs entwickelten. Das 5-Jahres-Risiko für das absolute Brustkrebs erklärt mehrere Risikofaktoren bei einer Person und sollte die beste Schätzung des individuellen Nutzens liefern (siehe Indikationen und Nutzung ). Tabelle 3. Die wichtigsten Ergebnisse des NSABP P-1-Versuchs Tabelle 4 beschreibt die Eigenschaften der Brustkrebserkrankungen in der NSABP-P-1-Studie und umfasst den Status des Tumorgröße ER-Status. Nolvadex (Tamoxifen -Citrat) verringerte die Inzidenz von kleinen Östrogenrezeptor -positiven Tumoren, veränderte jedoch nicht die Inzidenz von negativen Östrogenrezeptor -Tumoren oder größeren Tumoren. Tabelle 4. Merkmale von Brustkrebs in der NSABP P-1-Studie Zwischenergebnisse aus 2 Studien zusätzlich zu der NSABP P-1-Studie, in der die Auswirkungen von Tamoxifen bei der Reduzierung von Brustkrebsinzidenz untersucht wurden, wurden berichtet. Der erste war der italienische Tamoxifen -Verhinderungsprozess. In dieser Studie wurden Frauen im Alter zwischen 35 und 70 Jahren mit einer Gesamthysterektomie 5 Jahre lang 20 mg Tamoxifen oder ein passendes Placebo erhielten. Die primären Endpunkte waren das Auftreten und den Tod durch invasiven Brustkrebs. Frauen ohne spezifische Risikofaktoren für Brustkrebs sollten eingegangen werden. Zwischen 1992 und 1997 wurden 5408 Frauen randomisiert. Hormonersatztherapie (HRT) wurde bei 14% der Teilnehmer angewendet. Die Studie schloss 1997 aufgrund der großen Anzahl von Abschlüssen im ersten Jahr der Behandlung (26%). Nach 46 Monaten Nachuntersuchung gab es 22 Brustkrebserkrankungen bei Frauen auf Placebo und 19 bei Frauen auf Tamoxifen. Obwohl keine Abnahme der Inzidenz von Brustkrebs beobachtet wurde, gab es einen Trend zur Verringerung des Brustkrebs bei Frauen, die eine Protokolltherapie mindestens 1 Jahr lang erhielten (19-Placebo 11-Tamoxifen). Die geringe Anzahl von Teilnehmern zusammen mit dem geringen Risiko in dieser ansonsten gesunden Gruppe schloss eine angemessene Bewertung der Wirkung von Tamoxifen bei der Verringerung der Inzidenz von Brustkrebs aus. Die zweite Studie Die Royal Marsden Trial (RMT) wurde als Zwischenanalyse gemeldet. Die RMT wurde 1986 als Machbarkeitsstudie begonnen, ob größere Studien montiert werden konnten. Die Studie wurde anschließend auf eine Pilotstudie ausgedehnt, um zusätzliche Teilnehmer zu erhalten, um die Sicherheit von Tamoxifen weiter zu bewerten. Zwischen 1986 und 1996 wurden vierundzwanzighundertundsiebzig Frauen eingetragen; Sie wurden auf der Grundlage einer Familiengeschichte von Brustkrebs ausgewählt. HRT wurde in 40% der Teilnehmer verwendet. In dieser Studie wurden bei Frauen auf Tamoxifen bzw. Placebo mit einem 70-monatigen mittleren Durchschnitt von 34 und 36 Brustkrebs (8 nichtinvasive 4 an jedem Arm) beobachtet. Die Patienten in dieser Studie waren jünger als die in der NSABP P-1-Studie und es wurde möglicherweise eher ER (-) -Tumoren entwickelt, die durch Tamoxifen-Therapie unwahrscheinlich sind. Obwohl Frauen auf der Grundlage der Familiengeschichte ausgewählt wurden und angenommen wurden, dass ein hohes Risiko für Brustkrebs auftrat, traten nur wenige Ereignisse auf, die die statistische Macht der Studie verringern. Diese Faktoren sind potenzielle Gründe, warum die RMT möglicherweise keine angemessene Bewertung der Wirksamkeit von Tamoxifen bei der Verringerung der Inzidenz von Brustkrebs ermöglicht. In diesen Studien wurden am Tamoxifen -Arm im Vergleich zum Placebo -Arm eine erhöhte Anzahl von Fällen von Thrombose mit tiefer Venenthrombose und Endometriumkrebs beobachtet. Die Häufigkeit der Ereignisse stimmte mit den in der NSABP P-1-Studie beobachteten Sicherheitsdaten überein. Eine einzelne unkontrollierte multizentrische Studie mit Nolvadex (Tamoxifen Citrat) 20 mg Einmal täglich wurde in einer heterogenen Gruppe von Mädchen mit McCune-Albright-Syndrom und frühreifem Pubertät durch physikalische Anzeichen von pubertaler Entwicklungsepisoden von vaginalem Bleieren und/oder fortgeschrittenem Knochenalter (Knochenzeitalter mindestens 12 Monate älter) veranlasst. 28 weibliche pädiatrische Patienten im Alter von 2 bis 10 Jahren wurden bis zu 12 Monate lang behandelt. Die Auswirkung der Behandlung auf die Häufigkeit des Fortschritts des vaginalen Blutungsalters und der linearen Wachstumsrate wurde im Vergleich zur Prestudie -Grundlinie bewertet. Die Behandlung mit Nolvadex (Tamoxifen Citrat) wurde mit einer 50% igen Verringerung der Häufigkeit von vaginalen Blutungen durch Patienten- oder Familienbericht verbunden (mittlere annualisierte Häufigkeit von 3,56 Episoden zu Studienbeginn und 1,73 Episoden vorbehandelt). Unter den Patienten, die während des Zeitraums vor dem Studium vaginale Blutungen berichteten, berichteten 62% (13 von 21 Patienten) über einen Zeitraum von 6 Monaten und 33% (7 von 21 Patienten) keine Blutungen für die Dauer der Studie. Nicht alle Patienten verbesserten sich bei der Behandlung, und einige Patienten meldeten in den 6 Monaten vor der Einschreibung keine Vaginalblutungen in Vaginalblutungen. Die Nolvadex -Therapie (Tamoxifen -Citrat) war mit einer Verringerung der mittleren Steigerung des Knochenalters verbunden. Die individuellen Reaktionen in Bezug auf den Fortschritt des Knochenalters waren hoch heterogen. Die lineare Wachstumsrate wurde im Verlauf der Behandlung von Nolvadex (Tamoxifen Citrat) bei einer Mehrheit der Patienten (mittlere Veränderung von 1,68 cm/Jahr im Vergleich zur Grundlinie; Veränderung von 7,47 cm/Jahr zu Studienbeginn auf 5,79 cm/Jahr in der Studie reduziert. Diese Veränderung wurde in allen Stadien der Knochenreife nicht gleichmäßig gesehen; Alle aufgezeichneten Reaktionsfehler traten bei Patienten mit einem Knochenalter von weniger als 7 Jahren beim Screening auf. Das mittlere Uterusvolumen nahm nach 6 Monaten Behandlung zu und verdoppelte sich am Ende der einjährigen Studie. Eine kausale Beziehung wurde nicht hergestellt; Bei Erwachsenen, die mit Nolvadex behandelt wurden WARNUNG BOXED ) Die fortgesetzte Überwachung von McCune-Albright-Patienten, die mit Nolvadex (Tamoxifen Citrat) für langfristige Uteruseffekte behandelt wurden, wird empfohlen. Die Sicherheit und Wirksamkeit von Nolvadex (Tamoxifen Citrat) für Mädchen im Alter von zwei bis 10 Jahren mit dem McCune-Albright-Syndrom und der frühreifen Pubertät wurden nicht über ein Jahr der Behandlung hinaus untersucht. Die langfristigen Auswirkungen der Nolvadex-Therapie (Tamoxifen-Citrat) bei Mädchen wurden nicht festgestellt. Duktalkarzinom in situ
Art der Veranstaltung Lumpektomie -Strahlentherapie und Placebo Lumpektomie -Strahlentherapie und Nolvadex Rr 95% dort Limits Anzahl der Ereignisse Rate pro 1000 Frauen pro Jahr Anzahl der Ereignisse Rate pro 1000 Frauen pro Jahr Invasiven Brustkrebs (primärer Endpunkt) 74 16.73 44 9.60 0.57 0,39 bis 0,84 -Ipsilateral 47 10.61 27 5.90 0.56 0,33 bis 0,91 -Contralateral 25 5.64 17 3.71 0.66 0,33 bis 1,27 -Side undertermined 2 - - 0 - - - - Sekundäre Endpunkte DCIS 56 12.66 41 8.95 0.71 0,46 bis 1,08 -Ipsilateral 46 10.40 38 8.29 0.88 0,51 bis 1,25 -Contralateral 10 2.26 3 0.65 0.29 0,05 bis 1,13 Alle Brustkrebsereignisse 129 29.16 84 18.34 0.63 0,47 bis 0,83 -All ipsilateral events 96 21.70 65 14.19 0.65 0,47 bis 0,91 -All contralateral events 37 8.36 20 4.37 0.52 0,29 bis 0,92 Todesfälle 32 28 Uterus -Malignitäten1 4 9 Endometriumadenokarzinom1 4 0.57 8 1.15 Uterussarkom1 0 0.0 1 0.14 Zweite primäre Malignitäten (außer Endometrium und Brust) 30 29 Schlaganfall 2 7 Thromboembolische Ereignisse (DVT PE) 5 15 1Aktualisierte Follow-up-Daten (Median 8,1 Jahre) Merkmal Placebo Tamoxifen # % # % Alter (Jahr) 35-39 184 3 158 2 40-49 2394 36 2411 37 50-59 2011 31 2019 31 60-69 1588 24 1563 24 ≥ 70 393 6 393 6 Alter bei der ersten Lebendgeburt (Jahr) Nullipar 1202 18 1205 18 12-19 915 14 946 15 20-24 2448 37 2449 37 25-29 1399 21 1367 21 ≥ 30 606 9 577 9 Wettrennen Weiß 6333 96 6323 96 Schwarz 109 2 103 2 Andere 128 2 118 2 Alter bei Menarche ≥ 14 1243 19 1170 18 12-13 3610 55 3610 55 ≤ 11 1717 26 1764 27 0 1584 24 1525 23 1 3714 57 3744 57 2+ 1272 19 1275 20 Vorherige Hysterektomie No 4173 63.5 4018 62.4 Yes 2397 36.5 2464 37.7 0 2935 45 2923 45 1 1833 28 1850 28 ≥ 2 1802 27 1771 27 Geschichte der atypischen Hyperplasie in der Brust No 5958 91 5969 91 Yes 612 9 575 9 Geschichte der LCIS beim Eintritt No 6165 94 6135 94 Yes 405 6 409 6 5-Jahres-prognostiziertes Brustkrebsrisiko (%) ≤ 2.00 1646 25 1626 25 2.01-3.00 2028 31 2057 31 3.01-5.00 1787 27 1707 26 ≥ 5.01 1109 17 1162 18 Gesamt 6570 100.0 6544 100.0 Rate/1000 Frauen/Jahr 95% dort Art der Veranstaltung PLACEBO Nolvadex PLACEBO Nolvadex Rr Grenzen Invasiven Brustkrebs 156 86 6.49 3.58 0.56 0,43-0,72 Age ≤ 49 59 38 6.34 4.11 0.65 0,43-0,98 Age 50-59 46 25 6.31 3.53 0.56 0,35-0,91 Age ≥ 60 51 23 7.17 3.22 0.45 0,27-0,74 Risikofaktoren für die Brustkrebsgeschichte LCIS No 140 78 6.23 3.51 0.56 0,43-0,74 Yes 16 8 12.73 6.33 0.50 0,21-1.17 Geschichte Atypische Hyperplasie No 138 84 6.37 3.89 0.61 0,47-0,80 Yes 18 2 8.69 1.05 0.12 0,03-0,52 Verwandte ersten Grades 0 32 17 5.97 3.26 0.55 0,30-0,98 1 80 45 5.81 3.31 0.57 0,40-0,82 2 35 18 8.92 4.67 0.52 0,30-0,92 ≥ 3 9 6 13.33 7.58 0.57 0,20-1,59 5-Jahres-prognostiziertes Brustkrebsrisiko (wie das GAIL-Modell berechnet) ≤ 2.00% 31 13 5.36 2.26 0.42 0,22-0,81 2.01-3.00% 39 28 5.25 3.83 0.73 0,45-1,18 3.01-5.00% 36 26 5.37 4.06 0.76 0,46-1,26 ≥ 5.00% 50 19 13.15 4.71 0.36 0,21-0,61 DCIS 35 23 1.47 0.97 0.66 0,39-1.11 Frakturen (Protokoll-festgelegte Stellen) 921 761 3.87 3.20 0.61 0,83-1,12 Hip 20 9 0.84 0.38 0.45 0,18-1.04 Wrist2 74 69 3.11 2.91 0.93 0,67-1,29 Gesamt Ischemic Ereignisse 59 61 2.47 2.57 1.04 0,71-1,51 Myocardial Infarction 27 27 1.13 1.13 1.00 0,57-1,78 Fatal 8 7 0.33 0.29 0.88 0,27-2,77 Nonfatal 19 20 0.79 0.84 1.06 0,54-2.09 Angina3 12 12 0.50 0.50 1.00 0,41-2,44 Acute Ischemic Syndrome4 20 22 0.84 0.92 1.11 0,58-2.13 Uterus -Malignitäten (among women with an intact uterus)10 17 57 Endometriumadenokarzinom10 17 53 0.71 2.20 Uterussarkom10 0 4 0.0 0.17 Schlaganfall5 24 34 1.00 1.43 1.42 0,82-2,51 Vorübergehender ischämischer Angriff 21 18 0.88 0.75 0.86 0,43-1,70 Lungenembolien6 6 18 0.25 0.75 3.01 1.15-9.27 Tiefe Venenthrombose7 19 30 0.79 1.26 1.59 0,86-2,98 Katarakte Developing on Study8 483 540 22.51 25.41 1.13 1.00-1.28 Eine Kataraktoperation unterzogen8 63 101 2.83 4.57 1.62 1.18-2.22 Eine Kataraktoperation unterzogen9 129 201 5.44 8.56 1.58 1.26-1.97 1two Frauen hatten Hüft- und Handgelenkbrüche
2 umfasst Colles und andere niedrigere Radiusfrakturen
3Die Angioplastik oder CABG erfordern
4Neue Q-Welle auf EKG; Keine Angina oder Erhöhung von Serumenzymen; oder Angina, die Krankenhausaufenthalte ohne Operation benötigt
5Sieben Fälle waren tödlich; Drei in der Placebo -Gruppe und vier in der Nolvadex -Gruppe (Tamoxifen Citrat)
6Drei Fälle in der Gruppe Nolvadex (Tamoxifen Citrat) waren tödlich
7Alle bis auf drei Fälle in jeder Gruppe benötigten einen Krankenhausaufenthalt
8Basierend auf Frauen ohne Katarakte zu Studienbeginn (6230-Placebo 6199-Nolvadex (Tamoxifen Citrat))
9Alle Frauen (6707 Placebo 6681-Nolvadex (Tamoxifen Citrat))
10Aktualisierte Langzeit-Follow-up-Daten (Median 6,9 Jahre) aus der NSABP-P-1-Studie nach dem Grenzwert für die anderen Informationen in dieser Tabelle. Staging -Parameter Placebo
N = 156Tamoxifen
N = 86Gesamt
N = 242 Tumorgröße: T1 117 60 177 T2 28 20 48 T3 7 3 10 T4 1 2 3 Unbekannt 3 1 4 Knotenstatus: Negativ 103 56 159 1-3 positive Knoten 29 14 43 ≥ 4 positive Knoten 10 12 22 Unbekannt 14 4 18 Bühne: I 88 47 135 II: Knoten negativ 15 9 24 II: Knoten positiv 33 22 55 III 6 4 10 Iv 21 1 3 Unbekannt 12 3 15 Östrogenrezeptor: Positiv 115 38 153 Negativ 27 36 63 Unbekannt 14 12 26 1Ein Teilnehmer hatte einen verdächtigen Knochenscan, hatte jedoch keine Metastasen dokumentiert. Anschließend starb sie an metastasierendem Brustkrebs. McCune-Albright-Syndrom
Patienteninformationen für Nolvadex
Medikamentenhandbuch
Nolvadex (Tamoxifen Citrat) ®
(Nole-Vah-Dex) Tablets
Generischer Name: Tamoxifen
(Ta-mox-i-fen)
Geschrieben für Frauen, die Nolvadex (Tamoxifen Citrat) verwenden, um ihre hohe Wahrscheinlichkeit zu senken, Brustkrebs zu erwerben, oder das Duktalkarzinom in situ (DCIS) haben (DCIS).
In diesem Medikamentenführer werden nur die Verwendung von Nolvadex (Tamoxifen Citrat) verwendet, um die Wahrscheinlichkeit zu senken, dass Frauen mit hohem Risiko mit hohem Risiko und bei Frauen behandelt werden, die für DCIs behandelt werden.
Menschen, die Nolvadex einnehmen (Tamoxifen Citrat) zu behandeln Brustkrebs haben unterschiedliche Vorteile und unterschiedliche Entscheidungen, die Frauen oder Frauen mit duktalem Karzinom in situ (DCIS) einnehmen, die Nolvadex (Tamoxifen Citrat) einnehmen, um die Wahrscheinlichkeit eines Brustkrebses zu verringern. Wenn Sie bereits Brustkrebs haben, sprechen Sie mit Ihrem Arzt darüber, wie die Vorteile der Behandlung von Brustkrebs mit Nolvadex (Tamoxifen Citrat) mit den in diesem Dokument beschriebenen Risiken verglichen werden.
Warum sollte ich diesen Medikamentenleitfaden lesen?
Diese Anleitung enthält Informationen, mit denen Sie entscheiden können, ob Sie Nolvadex (Tamoxifen Citrat) verwenden sollen, um Ihre Chance auf Brustkrebs zu senken.
Sie und Ihr Arzt sollten darüber sprechen, ob der mögliche Nutzen von Nolvadex (Tamoxifen Citrat) bei der Senkung Ihrer hohen Chance auf Brustkrebs größer ist als die möglichen Risiken. Ihr Arzt verfügt über ein spezielles Computerprogramm oder einen Handrechner, um festzustellen, ob Sie sich in der Gruppe mit hohem Risiko befinden. Wenn Sie DCIS haben und mit einer Operation und Strahlentherapie behandelt wurden, kann Ihr Arzt Nolvadex (Tamoxifen Citrat) verschreiben, um Ihre Chance auf invasiven (Ausbreiten) Brustkrebs zu verringern.
Lesen Sie diese Anleitung sorgfältig durch, bevor Sie Nolvadex (Tamoxifen Citrat) beginnen. Es ist wichtig, die Informationen zu lesen, die Sie jedes Mal erhalten, wenn Sie mehr Medizin erhalten. Es kann etwas Neues geben. Dieser Leitfaden erzählt Ihnen nicht alles über Nolvadex (Tamoxifen Citrat) und tut dies nicht Nehmen Sie mit Ihrem Arzt an die Stelle.
Nur Sie und Ihr Arzt können feststellen, ob Nolvadex (Tamoxifen -Citrat) für Sie geeignet ist.
Was sind die wichtigsten Informationen, die ich über die Verwendung von Nolvadex (Tamoxifen Citrat) wissen sollte, um die Wahrscheinlichkeit von Brustkrebs zu verringern?
Nolvadex (Tamoxifen Citrat) is a prescription medicine that is like estrogen (female hormone) in some ways Und different in other ways. In the breast Nolvadex (Tamoxifen Citrat) can block estrogen's effects. Because it does this Nolvadex (Tamoxifen Citrat) may block the growth of breast cancers that need estrogen to grow (cancers that are estrogen- or progesterone -receptor positive).
Nolvadex (Tamoxifen Citrat) can lower the chance of getting breast cancer in women with a higher than normal chance of getting breast cancer in the next five years (Frauen mit hohem Risiko) Und Frauen mit DCIS.
Weil Frauen mit hohem Risiko keinen Krebs haben, aber es ist wichtig, sorgfältig darüber nachzudenken, ob der mögliche Nutzen von Nolvadex (Tamoxifen Citrat) bei der Senkung der Wahrscheinlichkeit von Brustkrebs größer ist als die möglichen Risiken.
Dieser Medikamentenführer überprüft die Risiken und Vorteile der Verwendung von Nolvadex (Tamoxifen Citrat), um die Wahrscheinlichkeit zu verringern, dass Frauen und Frauen mit hohem Risiko und Frauen mit DCIs Brustkrebs erwerben. Dieser Leitfaden tut nicht Besprechen Sie die besonderen Vorteile und Entscheidungen für Menschen, die bereits Brustkrebs haben.
Warum verwenden Frauen und Männer Nolvadex (Tamoxifen Citrat)?
Nolvadex (Tamoxifen Citrat) has more than one use. Nolvadex (Tamoxifen Citrat) is used:
die Chance zu senken bei Frauen mit einem höheren als normalen Chance, in den nächsten 5 Jahren Brustkrebs zu bekommen (Frauen mit hohem Risiko).
die Chance zu senken Invasive (Verbreitung) Brustkrebs bei Frauen mit Operationen und Bestrahlung für duktales Karzinom in situ (DCIS) zu bekommen. DCIS bedeutet, dass sich der Krebs nur innerhalb der Milchkanäle befindet.
zu behandeln Brustkrebs bei Frauen nach der frühen Behandlung. Eine frühzeitige Behandlung kann eine Operationsstrahlung und eine Strahlung umfassen und Chemotherapie . Nolvadex (Tamoxifen -Citrat) kann verhindern, dass sich der Krebs auf andere Körperteile ausbreitet. Es kann auch die Chance der Frau verringern, einen neuen Brustkrebs zu erleiden. bei Frauen und Männern
zu behandeln Brustkrebs, der sich auf andere Körperteile ausbreitet (metastasierter Brustkrebs).
Dieser Leitfaden spricht nur über die Verwendung von Nolvadex (Tamoxifen Citrat), um die Wahrscheinlichkeit eines Brustkrebses zu senken (
Was sind die Vorteile von Nolvadex (Tamoxifen Citrat), um die Wahrscheinlichkeit zu senken, dass Frauen mit hohem Risiko und Frauen, die wegen DCIS behandelt wurden, Brustkrebs erkranken?
Eine große US -Studie sah sich an Frauen mit hohem Risiko Und compared the ones wer nahm Nolvadex (Tamoxifen Citrat) for 5 years with others who took a pill without Nolvadex (Tamoxifen Citrat) (placebo). High-risk women were defined as women who have a 1.7% or greater chance of getting breast cancer in the next 5 years based on a special computer program. In this study:
- Von 1000 Hochrisikomanfrauen wer nahm ein Placebo Jedes Jahr bekam ungefähr 7 Brustkrebs.
- Von 1000 Hochrisikomanfrauen wer nahm Nolvadex (Tamoxifen Citrat) Jedes Jahr bekam ungefähr 4 Brustkrebs.
Die Studie zeigte, dass Frauen, die Nolvadex (Tamoxifen Citrat) einnahmen, im Durchschnitt mit hohem Risiko ihre Chancen, Brustkrebs um 44% von 7 zu 1000 auf 4 in 1000 zu gewinnen.
Eine andere US -Studie sah sich an Frauen mit DCIS Und compared those wer nahm Nolvadex (Tamoxifen Citrat) for 5 years with others wer nahm ein Placebo. In this study:
- Von 1000 Frauen mit DCIS wer nahm Placebo Jedes Jahr bekam ungefähr 17 Brustkrebs.
- Von 1000 Frauen mit DCIS wer nahm Nolvadex (Tamoxifen Citrat) Jedes Jahr bekam ungefähr 10 Brustkrebs.
Die Studie zeigte, dass durchschnittlich Frauen mit DCIs, die Nolvadex (Tamoxifen Citrat) einnahmen, ihre Chancen auf Invasive (Verbreitung) Brustkrebs um 43% von 17 in 1000 auf 10 in 1000 senkten.
Diese Studien bedeuten nicht, dass die Einnahme von Nolvadex (Tamoxifen Citrat) Ihre persönliche Chance auf Brustkrebs senken wird. Wir wissen nicht, wie die Vorteile für eine Frau sein werden, die Nolvadex (Tamoxifen Citrat) nimmt, um ihre Chance auf Brustkrebs zu verringern.
Was sind die Risiken von Nolvadex (Tamoxifen Citrat)?
In den unteren Studien, die die Vorteile von Nolvadex (Tamoxifen Citrat) haben? Die Hochrisikofrauen, die Nolvadex (Tamoxifen Citrat) einnahmen, bekamen bestimmte Nebenwirkungen mit einer höheren Geschwindigkeit als diejenigen, die ein Placebo einnahmen.
Einige dieser Nebenwirkungen können zum Tod führen.
In einer Studie an Frauen, die noch ihren Gebärmutter hatten
- Von 1000 Frauen, die jedes Jahr ein Placebo erringen, erhielt 1 Endometriumkrebs (Krebs der Gebärmutterkrebs) und keiner Uterus -Sarkom (Krebs des Gebärmutters).
- Von 1000 Frauen, die jedes Jahr Nolvadex (Tamoxifen Citrat) einnahmen, bekamen 2 Krebskrebs und weniger als 1 Uterus -Sarkom.
Diese Ergebnisse zeigen, dass durchschnittlich Frauen bei hohem Risiko mit hohem Risiko wer hatte immer noch ihren Uterus Nolvadex (Tamoxifen Citrat) doubled the chance of getting endometrial cancer from 1 in 1000 to 2 in 1000 Und it increased the chance of getting uterine sarcoma. Dies bedeutet nicht, dass die Einnahme von Nolvadex (Tamoxifen Citrat) Ihre persönliche Chance verdoppelt, Endometriumkrebs zu erwerben oder Ihre Chance zu erhöhen, Uterussarkom zu bekommen. Wir wissen nicht, was dieses Risiko für eine Frau sein wird. Das Risiko ist für Frauen, die ihre Gebärmutter nicht mehr haben, anders.
Für alle Frauen in dieser Studie erhöhte die Einnahme von Nolvadex (Tamoxifen Citrat) das Risiko, einen Blutgerinnsel in der Lunge oder Venen zu haben oder einen Schlaganfall zu haben. In einigen Fällen starben Frauen an diesen Auswirkungen.
Nolvadex (Tamoxifen Citrat) increased the risk of getting cataracts (clouding of the lens of the eye) or needing cataract surgery. (Siehe, was sind die möglichen Nebenwirkungen von Nolvadex (Tamoxifen Citrat)? Weitere Informationen zu Nebenwirkungen.)
Was wissen wir nicht über die Einnahme von Nolvadex (Tamoxifen Citrat), um die Wahrscheinlichkeit eines Brustkrebses zu verringern?
Wir wissen es nicht
- Wenn Nolvadex (Tamoxifen Citrat) die Wahrscheinlichkeit senkt, dass bei Frauen mit abnormalen Brustkrebsgenen Brustkrebs erkrankt (BRCA1 und BRCA2)
- Wenn die Einnahme von Nolvadex (Tamoxifen Citrat) seit 5 Jahren die Anzahl der Brustkrebs reduziert, die eine Frau in ihrem Leben erhält, oder wenn es nur einige Brustkrebs verzögert
- Wenn Nolvadex (Tamoxifen Citrat) einer Frau hilft, länger zu leben
- Die Auswirkungen der Einnahme von Nolvadex (Tamoxifen Citrat) mit Hormonersatztherapie (HRT) Antibabypillen oder Androgenen (männliche Hormone)
- Die Vorteile der Einnahme von Nolvadex (Tamoxifen Citrat), wenn Sie weniger als 35 Jahre alt sind
Es werden Studien durchgeführt, um mehr über die langfristigen Vorteile und Risiken der Verwendung von Nolvadex (Tamoxifen Citrat) zu erfahren, um die Wahrscheinlichkeit eines Brustkrebses zu verringern.
Was sind die möglichen Nebenwirkungen von Nolvadex (Tamoxifen Citrat)?
Die häufigste Nebenwirkung von Nolvadex (Tamoxifen Citrat) ist Hitzewallungen . Dies ist kein Zeichen für ein ernstes Problem.
Die nächsthäufige Nebenwirkung ist der Vaginalausfluss. Wenn die Entladung blutig ist, könnte dies ein Zeichen für ein ernstes Problem sein. [Siehe Veränderungen in der Auskleidung (Endometrium) oder Körper Ihres Gebärmutters unten.]
Im Folgenden sind weniger häufige, aber schwerwiegende Nebenwirkungen von Nolvadex (Tamoxifen -Citrat) aufgeführt. Diese können jederzeit auftreten. Rufen Sie Ihren Arzt sofort an, wenn Sie Anzeichen von Nebenwirkungen haben, die unten aufgeführt sind:
- Veränderungen in der Auskleidung (Endometrium) oder Ihres Gebärmutters. Diese Veränderungen können bedeuten, dass schwerwiegende Probleme beginnen, einschließlich Krebs der Gebärmutter. Die Anzeichen von Änderungen in der Gebärmutter sind:
- Vaginalblutung oder blutiger Ausfluss, die eine rostige oder braune Farbe haben können. Sie sollten Ihren Arzt anrufen, auch wenn nur eine kleine Menge Blutungen auftritt.
- Änderung Ihrer monatlichen Blutungen wie der Menge oder des Zeitpunkts der Blutung oder einer erhöhten Gerinnung.
- Schmerz or pressure in your pelvis (below your belly button).
- Blutgerinnsel in Ihren Adern oder Lungen. Diese können schwerwiegende Probleme einschließlich des Todes verursachen. Sie können Gerinnsel bis zu 2-3 Monate nach dem Einnehmen von Nolvadex (Tamoxifen Citrat) erhalten. Die Anzeichen von Blutgerinnseln sind:
- Plötzliche Brustschmerzen Atemnot des Blutes auf Blut husten
- Schmerzfrnerität oder Schwellung in einem oder beiden Beinen
- Schlaganfall. Schlaganfall can cause serious medical problems including death. The signs of stroke are:
- Plötzliche Schwäche Kribbeln oder Taubheit in Ihrem Gesichtsarm oder Bein, besonders auf einer Seite Ihres Körpers
- Plötzliche Verwirrungsschwierigkeiten sprechen oder Verständnis
- plötzliche Probleme in einem oder beiden Augen zu sehen
- Plötzliche Probleme beim Schwindelverlust des Gleichgewichts oder der Koordination
- plötzliche schwere Kopfschmerzen ohne bekannte Ursache
- Katarakte or increased chance of needing cataract surgery. Das Zeichen dieser Probleme ist eine langsame Verschwörung Ihrer Sicht.
- Leberprobleme einschließlich Gelbsucht. Zu den Anzeichen von Leberproblemen zählen mangelnder Appetit und vergilbt Ihrer Haut oder der Weißen Ihrer Augen.
Dies sind nicht alle möglichen Nebenwirkungen von Nolvadex (Tamoxifen -Citrat). Eine vollständige Liste fragen Sie Ihren Arzt oder Apotheker.
Wer sollte Nolvadex (Tamoxifen Citrat) nicht einnehmen?
Nehmen Sie Nolvadex (Tamoxifen Citrat) aus irgendeinem Grund nicht, wenn Sie
- Sind schwanger oder planen, während der Einnahme von Nolvadex (Tamoxifen Citrat) oder während der 2 Monate nach der Einnahme von Nolvadex (Tamoxifen Citrat) schwanger zu werden. Nolvadex (Tamoxifen Citrat) kann Ihrem ungeborenen Baby schaden. Es dauert ungefähr 2 Monate, um Nolvadex (Tamoxifen Citrat) aus Ihrem Körper zu entfernen. Um sicherzugehen, dass Sie nicht schwanger sind, können Sie Nolvadex (Tamoxifen Citrat) einnehmen, während Sie Ihre Menstruationszeit haben. Oder Sie können einen Schwangerschaftstest durchführen, um sicherzugehen, dass Sie nicht schwanger sind, bevor Sie beginnen.
- Stillen. Wir wissen nicht, ob Nolvadex (Tamoxifen -Citrat) durch Ihre Milch gehen und Ihrem Baby schädigen kann.
- Haben eine allergische Reaktion auf Nolvadex (Tamoxifen Citrat) oder Tamoxifen gehabt (Der andere Name für Nolvadex (Tamoxifen -Citrat)) oder zu einer seiner inaktiven Zutaten.
Wenn Sie schwanger werden, während Sie Nolvadex (Tamoxifen Citrat) einnehmen, nehmen Sie es sofort auf und wenden Sie sich an Ihren Arzt. Nolvadex (Tamoxifen Citrat) kann Ihrem ungeborenen Baby schaden. Nehmen Sie Nolvadex (Tamoxifen Citrat) nicht, um Ihre Wahrscheinlichkeit zu senken, Brustkrebs zu bekommen, wenn
- Sie hatten jemals einen Blutgerinnsel, der eine medizinische Behandlung benötigte.
- Sie nehmen Medikamente ein, um Ihr Blut wie Warfarin zu verdünnen (auch Coumadin®*).
- Ihre Fähigkeit, sich zu bewegen, ist für den größten Teil Ihrer Wachzeiten begrenzt.
- Sie sind einem Risiko für Blutgerinnsel ausgesetzt. Ihr Arzt kann Ihnen sagen, ob Sie ein hohes Risiko für Blutgerinnsel haben.
- Sie haben keine höhere als normale Chance, Brustkrebs zu bekommen. Ihr Arzt kann Ihnen sagen, ob Sie eine Frau mit hohem Risiko sind.
Wie soll ich Nolvadex (Tamoxifen Citrat) einnehmen?
- Schlucken Sie die Tafel (en) mit Wasser oder einer anderen alkoholfreien Flüssigkeit. Sie können Nolvadex (Tamoxifen Citrat) mit oder ohne Nahrung einnehmen. Nehmen Sie jeden Tag Ihre Medizin. Es kann einfacher sein, sich zu erinnern, wenn Sie es jeden Tag zur gleichen Zeit einnehmen.
- Wenn Sie eine Dosis vergessen, nehmen Sie sie an, wenn Sie sich erinnern, dann nehmen Sie die nächste Dosis wie gewohnt. Wenn es fast Zeit für Ihre nächste Dosis ist oder Sie sich bei Ihrer nächsten Dosis erinnern, nehmen Sie keine zusätzlichen Tablets, um die verpasste Dosis auszugleichen.
- Nehmen Sie Nolvadex (Tamoxifen Citrat) für 5 Jahre ein, es sei denn, Ihr Arzt sagt es Ihnen etwas anderes.
Was sollte ich bei der Einnahme von Nolvadex (Tamoxifen Citrat) vermeiden?
- Nehmen Sie nicht schwanger, während Sie Nolvadex (Tamoxifen Citrat) oder für 2 Monate nach dem Aufhören einnehmen. Nolvadex (Tamoxifen Citrat) can stop hormonal birth control methods from working. Hormonal methods include birth control pills patches injections rings Und implants. Therefore while taking Nolvadex (Tamoxifen Citrat) Verwenden Sie Geburtenkontrollmethoden, die keine Hormone verwenden wie Kondome -Membran mit Spermiziden oder einfachen IUPs. Wenn Sie schwanger werden, hören Sie sofort auf Nolvadex (Tamoxifen Citrat) ein und rufen Sie Ihren Arzt an.
- Nicht stillen. Wir wissen nicht, ob Nolvadex (Tamoxifen -Citrat) durch Ihre Milch gehen kann und ob es dem Baby schaden kann.
Was soll ich bei Nolvadex (Tamoxifen Citrat) machen?
- Machen Sie regelmäßige Gynäkologieuntersuchungen (weibliche Prüfungen) Brustuntersuchungen und Mammogramme. Ihr Arzt wird Ihnen sagen, wie oft. Diese werden nach Anzeichen von Brustkrebs und Krebs des Endometriums (Auskleidung der Gebärmutter) prüfen. Da Nolvadex (Tamoxifen -Citrat) nicht alle Brustkrebserkrankungen verhindert und Sie möglicherweise andere Krebsarten erhalten, benötigen Sie diese Prüfungen, um Krebserkrankungen so früh wie möglich zu finden.
- Weil Nolvadex (Tamoxifen Citrat) schwerwiegende Nebenwirkungen verursachen kann, achten Sie genau auf Ihren Körper. Anzeichen, nach denen Sie suchen sollten, sind in den möglichen Nebenwirkungen von Nolvadex (Tamoxifen Citrat) aufgeführt?
- Sagen Sie allen Ärzten, dass Sie sehen, dass Sie Nolvadex (Tamoxifen Citrat) einnehmen.
- Sagen Sie Ihrem Arzt sofort, wenn Sie neue Brustklumpen haben.
Allgemein information about the safe Und effective use of Nolvadex (Tamoxifen Citrat)
Medikamente werden manchmal für andere Zwecke als die in einem Medikamentenhandbuch aufgeführten Zwecke verschrieben. Ihr Arzt hat Nolvadex (Tamoxifen Citrat) nur für Sie verschrieben. Geben Sie es anderen Menschen nicht, auch wenn sie einen ähnlichen Zustand haben, weil dies ihnen schaden kann. Verwenden Sie es nicht für einen Zustand, für den es nicht vorgeschrieben war.
Diese Medikamentenhandbuch ist eine Zusammenfassung der Informationen über Nolvadex (Tamoxifen Citrat) für Frauen, die Nolvadex (Tamoxifen Citrat) verwenden, um ihre hohe Chance auf Brustkrebs zu senken oder DCIs zu haben. Wenn Sie weitere Informationen zu Nolvadex (Tamoxifen Citrat) wünschen, fragen Sie Ihren Arzt oder Apotheker. Sie können Ihnen Informationen über Nolvadex (Tamoxifen Citrat) geben, die für Angehörige der Gesundheitsberufe geschrieben wurden. Weitere Informationen zu Nolvadex (Tamoxifen Citrat) oder Brustkrebs finden Sie unter www.nolvadex (Tamoxifen citrat) .com oder telefonisch unter 1-800-236-9933.
Zutaten: Tamoxifen Citrat Carboxymethylcellulose Calcium Magnesium Stearat Mannit und Stärke.
Dieser Medikamentenführer wurde von der US -amerikanischen Food and Drug Administration zugelassen