Vyvanse
Die Informationen Auf Dieser Website Stellen Keine Medizinische Beratung Dar. Wir Verkaufen Nichts. Die Richtigkeit Der Übersetzung Wird Nicht Garantiert. Haftungsausschluss
Drogenzusammenfassung
Was ist Vyvanse?
Vyvanse (Lisdexamfetamin -Dimemin) ist ein Stimulans des Zentralnervensystems zur Behandlung:
- Aufmerksamkeitsdefizit -Hyperaktivitätsstörung (ADHS) und
- mittelschwere bis schwere Binge Essstörung
Was sind Nebenwirkungen von Vyvanse?
Vyvanse
- Brustschmerzen
- Probleme beim Atmen
- Hämmerliche Herzschläge oder Flattern in Ihrer Brust
- Benommenheit
- Halluzinationen
- Neue Verhaltensprobleme
- Aggression
- Feindseligkeit
- Paranoia
- Taubheit
- Schmerz
- kaltes Gefühl
- ungeklärte Wunden und
- Hautfarbe ändert sich (hellrot oder blau) in Ihren Fingern oder Zehen
Holen Sie sich sofort medizinische Hilfe, wenn Sie eines der oben aufgeführten Symptome haben.
Häufige Nebenwirkungen von Vyvanse umfassen
- Anorexie
- Angst
- Verringerter Appetit
- Gewichtsverlust
- Durchfall
- Schwindel
- Trockener Mund
- Reizbarkeit
- Schlafprobleme (Schlaflosigkeit)
- Brechreiz
- Bauch- oder Magenschmerzen
- Erbrechen
- Erhöhte Herzfrequenz
- Verstopfung
- nervöses Gefühl
- milder Hautausschlag
- Ein unangenehmer Geschmack in Ihrem Mund
- Kopfschmerzen
- Nervosität
- schwitzen und
- Unruhe.
- verschwommenes Sehen
- Schnell/Schlagen/unregelmäßiger Herzschlag
- Veränderungen für mentale/stimmige/Verhaltensweisen wie:
- Agitation
- Aggression
- Stimmungsschwankungen
- Depression
- Halluzinationen
- abnormale Gedanken oder Verhalten
- Selbstmordgedanken oder Versuche
- Unkontrollierte Bewegungen
- Muskelzucken oder Schütteln
- Taubheit/Schmerz/skin color change/sensitivity to temperature in the fingers or toes
- Ausbrüche von Wörtern oder Geräuschen
- Eine Änderung der sexuellen Fähigkeiten oder des Interesses
- Schwellende Knöchel oder Füße
- Extreme Müdigkeit
- Schneller oder ungeklärter Gewichtsverlust oder
- Häufige oder längere Erektionen (bei Männern)
Suchen Sie medizinische Versorgung oder rufen Sie auf einmal 911 an, wenn Sie die folgenden schwerwiegenden Nebenwirkungen haben:
- Schwerwiegende Augensymptome wie plötzlicher Sehverlust verschwommenes Sehen Tunnel Sehschmerzen oder Schwellungen oder Halos in der Umgebung des Lichts;
- Schwerwiegende Herzsymptome wie schnelle unregelmäßige oder pochende Herzschläge; Flattern in deiner Brust; Kurzatmigkeit; und plötzliche Schwindel -Benommenheit oder ohnmächtig;
- Starke Kopfschmerzen Verwirrung verwirrt Spracharm oder Bein Schwäche Schwierigkeiten beim Verlust der Koordination unstabil sehr steifes Muskeln hoher Fieber problemlos Schwitzen oder Zittern.
Dieses Dokument enthält nicht alle möglichen Nebenwirkungen und andere können auftreten. Wenden Sie sich an Ihren Arzt nach zusätzlichen Informationen zu Nebenwirkungen.
Dosierung für Vyvanse
Die empfohlene Vyvanse -Dosis beträgt morgens 30 mg. Die maximal empfohlene Dosis beträgt 70 mg/Tag.
Welche Drogensubstanzen oder Nahrungsergänzungsmittel interagieren mit Vyvanse?
Vyvanse kann mit interagieren mit
- Ammoniumchlorid
- Ascorbinsäure (Vitamin C)
- K-Phos
- Blutdruckmedikamente
- Diuretika (Wasserpillen)
- Antihistaminika
- Chlorpromazin
- Ethosuximid
- Lithium
- Methenamin
- phable
- Phenobarbital
- Schmerz medication or
- Antidepressiva
Sagen Sie Ihrem Arzt alle Medikamente und Nahrungsergänzungsmittel, die Sie verwenden.
Vyvanse während der Schwangerschaft und Stillen
Während der Schwangerschaft sollte Vyvanse nur dann eingenommen werden, wenn sie verschrieben werden. Dieses Medikament geht in die Muttermilch über und könnte unerwünschte Auswirkungen auf ein Pflegekind haben. Das Stillen wird bei der Verwendung dieses Arzneimittels nicht empfohlen. Entzugssymptome können auftreten, wenn Sie plötzlich aufhören, dieses Medikament zu verwenden.
Weitere Informationen
Unser Vyvanse -Nebenwirkungen (Lisdexamfetamin Dimesylat) -Dedikamentenzentrum bietet eine umfassende Übersicht über die verfügbaren Arzneimittelinformationen über die potenziellen Nebenwirkungen bei der Einnahme dieses Medikaments.
FDA -Drogeninformationen
- Drogenbeschreibung
- Indikationen
- Nebenwirkungen
- Wechselwirkungen mit Arzneimitteln
- Warnungen
- Überdosis
- Klinische Pharmakologie
- Medikamentenhandbuch
WARNUNG
Missbrauch und Abhängigkeit
ZNS-Stimulanzien (Amphetamine und Methylphenidat-haltige Produkte) einschließlich Vyvanse haben ein hohes Potenzial für Missbrauch und Abhängigkeit. Beurteilen Sie das Missbrauchsrisiko vor der Verschreibung und Überwachung von Anzeichen von Missbrauch und Abhängigkeit während der Therapie [siehe WARNUNGS AND VORSICHTSMASSNAHMEN Und Drogenmissbrauch und Abhängigkeit ].
Beschreibung für Vyvanse
Vyvanse (Lisdexamfetamin-Dimemin) Ein ZNS-Stimulans ist eine einmalige orale Verabreichung. Die chemische Bezeichnung für Lisdexamfetamin-Dimesylat ist (2S) -26-Diamino N -[(1 S ) -1-methyl-2-phenylethyl] hexanamid dimethanesulfonat. Die molekulare Formel ist c15H25N3O • (Ch4O3S)2 das entspricht einem Molekulargewicht von 455,60. Die chemische Struktur ist:
 |
LisDexamfetamin-Dimesylat ist ein weißes bis malweißes Pulver, das in Wasser löslich ist (792 mg/ml).
Informationen für Vyvanse -Kapseln
Vyvanse -Kapseln enthalten 10 mg 20 mg 30 mg 40 mg 50 mg 60 mg und 70 mg Lisdexamfetamin -Dimesylat (äquivalent zu 5,8 mg 11,6 mg 17,3 mg 23,1 mg 28,9 mg 34,7 mg und 40,5 mg Lisdexamfetamin).
Inaktive Inhaltsstoffe: mikrokristallines Cellulose -Croscarmellose -Natrium und Magnesiumstearat. Die Kapselschalen enthalten Gelatine -Titandioxid und eine oder mehrere der folgenden: FD
Informationen für Vyvanse -Kautabletten
Vyvanse -Kautabletten enthalten 10 mg 20 mg 30 mg 40 mg 50 mg und 60 mg LISDEXAMFETAMIN -Dimesylat (äquivalent zu 5,8 mg 11,6 mg 17,3 mg 23,1 mg 28,9 mg und 34,7 mg Lisdexamfetamin).
Inaktive Inhaltsstoffe: kolloidales Siliziumdioxid Croscarmellose Natrium Guar Gum Magnesium Stearat Mannitol mikrokristallines Cellulose -Sucralosekünstliche Erdbeergeschmack.
Verwendung für Vyvanse
Vyvanse® ist für die Behandlung von: angezeigt:
- Aufmerksamkeitsdefizit -Hyperaktivitätsstörung (ADHS) bei Erwachsenen und pädiatrischen Patienten ab 6 Jahren [siehe Klinische Studien ]
- Mittelschwere bis schwere Essstörung (Bett) bei Erwachsenen [siehe Klinische Studien ].
Einschränkungen der Nutzung
- Pädiatrische Patienten mit ADHS unter älter als 6 Jahren hatten einen längerfristigen Gewichtsverlust als Patienten ab 6 Jahren [siehe Verwendung in bestimmten Populationen ].
- Vyvanse is not indicated or recommended for Gewichtsverlust. Use of other sympathomimetic drugs for Gewichtsverlust has been associated with serious cardiovascular adverse events. The safety Und effectiveness of Vyvanse for the treatment of obesity have not been established [see WARNUNGS AND VORSICHTSMASSNAHMEN ].
Dosierung für Vyvanse
Vorbehandlungs -Screening
Vor der Behandlung von Patienten mit Vyvanse beurteilen:
- Für das Vorhandensein von Herzerkrankungen (d. H. Eine sorgfältige Geschichte der Familiengeschichte plötzlicher Tod oder ventrikulärer Arrhythmie und körperlicher Untersuchung durchführen) [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
- Die Familienanamnese und klinisch bewerten Patienten für motorische oder verbale Tics oder Tourette -Syndrom vor der Initiierung von Vyvanse [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Allgemeine Verwaltungsinformationen
Nehmen Sie Vyvanse am Morgen oral mit oder ohne Essen; Vermeiden Sie Nachmittagsdosen aufgrund des Potenzials für Schlaflosigkeit. Vyvanse kann auf eine der folgenden Arten verabreicht werden:
Informationen für Vyvanse -Kapseln
- Vyvanse -Kapseln ganz oder schlucken
- Öffnen Sie die Kapseln leer und mischen Sie den gesamten Inhalt mit Joghurtwasser oder Orangensaft. Wenn der Inhalt der Kapsel ein verdichtetes Pulver enthält, kann ein Löffel verwendet werden, um das Pulver auseinander zu brechen. Der Inhalt sollte bis vollständig verteilt werden. Verbrauch die gesamte Mischung sofort. Es sollte nicht gespeichert werden. Der Wirkstoff löst sich nach dem Verteilten vollständig auf; Ein Film, der die inaktiven Zutaten enthält, kann jedoch im Glas oder im Behälter bleiben, sobald die Mischung verbraucht ist.
Informationen für Vyvanse -Kautabletten
- Vyvanse chewable tablets must be chewed thoroughly before swallowing.
Vyvanse capsules can be substituted with Vyvanse chewable tablets on a unit per unit/mg per mg basis (for example 30 mg capsules for 30 mg chewable tablet) [see Klinische Pharmakologie ].
Nehmen Sie nicht weniger als eine Kapsel oder ein Kautablette pro Tag. Eine einzelne Dosis sollte nicht geteilt werden.
Dosierung zur Behandlung von ADHS
Die empfohlene Startdosis bei Erwachsenen und pädiatrischen Patienten ab 6 Jahren beträgt 30 mg einmal täglich am Morgen. Die Dosierung kann in Schritten von 10 mg oder 20 mg in ungefähr wöchentlichen Intervallen bis zu einer maximalen empfohlenen Dosierung von 70 mg einmal täglich eingestellt werden [siehe Klinische Studien ].
Dosierung zur Behandlung von mittelschwerer bis schwerer Bett bei Erwachsenen
Die empfohlene Startdosis bei Erwachsenen beträgt 30 mg einmal täglich in Schritten von 20 mg in ungefähr wöchentlichen Intervallen, um die empfohlene Zieldosis von 50 mg bis 70 mg einmal täglich zu erreichen. Die maximal empfohlene Dosierung beträgt 70 mg einmal täglich [siehe Klinische Studien ]. Discontinue Vyvanse if binge eating does not improve.
Dosierung bei Patienten mit Nierenbehinderung
Bei Patienten mit schwerer Nierenbeeinträchtigung (GFR 15 bis <30 mL/min/1.73 m2) Die maximale Dosierung sollte 50 mg nicht einmal täglich überschreiten. Bei Patienten mit Nierenerkrankungen im Endstadium (ESRD GFR <15 mL/min/1.73 m2) Die maximal empfohlene Dosierung beträgt 30 mg einmal täglich [siehe Verwendung in bestimmten Populationen ].
Dosierungsmodifikationen aufgrund von Wechselwirkungen mit Arzneimitteln
Wirkstoffe, die den pH -Wert im Urin verändern, können die Ausscheidung im Urin beeinflussen und die Blutspiegel von Amphetamin verändern.
Die Ansäuern von Mitteln (z. B. Ascorbinsäure) verringern den Blutspiegel, während die Alkalinalisierung von Wirkstoffen (z. B. Natriumbicarbonat) den Blutspiegel erhöhen. Passen Sie die Vyvanse -Dosierung entsprechend an [siehe Wechselwirkungen mit Arzneimitteln ].
Wie geliefert
Dosierungsformen und Stärken
Vyvanse (LISDEXAMFETAMIN -DIMENYLATE) Kapseln:
- Kapseln 10 mg : Pink Body/Pink Cap (geprägt mit S489 und 10 mg)
- Kapseln 20 mg : Elfenbeinkörper/Elfenbeinkappe (geprägt mit S489 und 20 mg)
- Kapseln 30 mg : Weißer Körper-/Orangenmütze (geprägt mit S489 und 30 mg)
- Kapseln 40 mg : Weißer Körper/blau grüner Kappe (geprägt mit S489 und 40 mg)
- Kapseln 50 mg : Weißer Körper/blauer Kappe (geprägt mit S489 und 50 mg)
- Kapseln 60 mg : Aqua Blue Body/Aqua Blue Cap (geprägt mit S489 und 60 mg)
- Kapseln 70 mg : Blue Body/Orange Cap (geprägt mit S489 und 70 mg)
Vyvanse (Lisdexamfetamin Dimesylat) Kautabletten:
- Kautabletten 10 mg : Weiß bis nicht weiß rund geformte Tablette mit „10“ auf der einen Seite und auf der anderen Seite „S489“
- Kautabletten 20 mg : Weiß bis nicht weiße hexagonal geformte Tablette mit „20“ auf der einen Seite und auf der anderen Seite „S489“
- Kautabletten 30 mg : Weiß bis nicht weiße Lichtbogen dreieckig geformtes Tablette auf der einen Seite mit „30“ und auf der anderen Seite „S489“
- Kautabletten 40 mg : Weiß bis nicht weiße Kapsel geformte Tablette mit 40 auf der einen Seite und auf der anderen Seite „S489“
- Kautabletten 50 mg : Weiß bis nicht weiße Lichtbogenquadellungs-Tablette mit „50“ auf der einen Seite und auf der anderen Seite „S489“
- Kautabletten 60 mg : Weiß bis nicht weiße Arc Diamond-Form-Tablette mit 60 auf der einen Seite und auf der anderen Seite S489
Vyvanse (Lisdexamfetamine Dimesylate) Capsules
- Vyvanse capsules 10 mg : Pink Body/Pink Cap (geprägt mit S489 und 10 mg) bottles of 100 NDC 59417-101-10
- Vyvanse capsules 20 mg : Elfenbeinkörper/Elfenbeinkappe (geprägt mit S489 und 20 mg) bottles of 100 NDC 59417-102-10
- Vyvanse capsules 30 mg : Weißer Körper-/Orangenmütze (geprägt mit S489 und 30 mg) bottles of 100 NDC 59417-103-10
- Vyvanse capsules 40 mg : Weißer Körper/blau grüner Kappe (geprägt mit S489 und 40 mg) bottles of 100 NDC 59417-104-10
- Vyvanse capsules 50 mg : Weißer Körper/blauer Kappe (geprägt mit S489 und 50 mg) bottles of 100 NDC 59417-105-10
- Vyvanse capsules 60 mg : Aqua Blue Body/Aqua Blue Cap (geprägt mit S489 und 60 mg) bottles of 100 NDC 59417-106-10
- Vyvanse capsules 70 mg : Blue Body/Orange Cap (geprägt mit S489 und 70 mg) bottles of 100 NDC 59417-107-10
Vyvanse (Lisdexamfetamine Dimesylate) Chewable Tablets
- Vyvanse chewable tablets 10 mg : Weiß bis nicht weiß rund geformte Tablette mit „10“ auf der einen Seite und auf der anderen Seite „S489“ bottles of 100 NDC 59417-115-01
- Vyvanse chewable tablets 20 mg : Weiß bis nicht weiße hexagonal geformte Tablette mit „20“ auf der einen Seite und auf der anderen Seite „S489“ bottles of 100 NDC 59417-116-01
- Vyvanse chewable tablets 30 mg : Weiß bis nicht weiße Lichtbogen dreieckig geformtes Tablette auf der einen Seite mit „30“ und auf der anderen Seite „S489“ bottles of 100 NDC 59417-117- 01
- Vyvanse chewable tablets 40 mg : Weiß bis nicht weiße Kapsel geformte Tablette mit 40 auf der einen Seite und auf der anderen Seite „S489“ bottles of 100 NDC 59417-118-01
- Vyvanse chewable tablets 50 mg : Weiß bis nicht weiße Lichtbogenquadellungs-Tablette mit „50“ auf der einen Seite und auf der anderen Seite „S489“ bottles of 100 NDC 59417-119-01
- Vyvanse chewable tablets 60 mg : Weiß bis nicht weiße Arc Diamond-Form-Tablette mit 60 auf der einen Seite und auf der anderen Seite S489 bottles of 100 NDC 59417-120-01
Lagerung und Handhabung
In einem engen, lichtbeständigen Behälter wie im USP definierten Behälter geben.
Bei Raumtemperatur 20 ° C bis 25 ° C (68 ° F bis 77 ° F) aufbewahren. Exkursionen zwischen 15 ° C und 30 ° C (59 ° F bis 86 ° F) [siehe USP -kontrollierte Raumtemperatur].
Verteilt von: Takeda Pharmaceuticals America Inc. Lexington MA 02421. Überarbeitet: Okt. 2023.
Nebenwirkungen for Vyvanse
Die folgenden Nebenwirkungen werden in anderen Abschnitten der Kennzeichnung ausführlicher erörtert:
- Bekannte Überempfindlichkeit gegen Amphetaminprodukte oder andere Inhaltsstoffe von Vyvanse [siehe Kontraindikationen ]
- Hypertensive Krise bei gleichzeitig mit Monoaminoxidase -Inhibitoren [siehe Kontraindikationen Und Wechselwirkungen mit Arzneimitteln ]
- Missbrauchsmissbrauch und Sucht [siehe Boxwarnung WARNUNGS AND VORSICHTSMASSNAHMEN Und Drogenmissbrauch und Abhängigkeit ]
- Risiken für Patienten mit schwerwiegende Herzerkrankungen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Erhöhter Blutdruck und Herzfrequenz [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Psychiatrische Nebenwirkungen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Langzeitunterdrückung des Wachstums bei pädiatrischen Patienten [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Periphere Vaskulopathie einschließlich Raynauds Phänomen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Serotons Syndrom [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Motorische und verbale Tics und Verschlechterung des Tourette -Syndroms [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
Klinische Studien Erfahrung
Da klinische Studien unter stark unterschiedlichen Bedingungen durchgeführt werden, die in den klinischen Studien eines Arzneimittels beobachtet werden, können in den klinischen Studien eines anderen Arzneimittels nicht direkt mit den Raten verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Aufmerksamkeitsdefizit -Hyperaktivitätsstörung
Die Sicherheitsdaten in diesem Abschnitt basieren auf Daten aus den 4-wöchigen kontrollierten klinischen Untersuchungen der parallelen Gruppe von Vyvanse bei pädiatrischen und erwachsenen Patienten mit ADHS [siehe Klinische Studien ].
Nebenwirkungen mit dem Absetzen der Behandlung in klinischen ADHS -Studien ADHS im Zusammenhang mit der Behandlung von ADHS
In der kontrollierten Studie bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren (Studie 1) 8% (18/218) von mit Vyvanse behandelten Patienten wurden aufgrund von Nebenwirkungen im Vergleich zu 0% (0/72) von Placebo-behandelten Patienten abgesetzt. Die am häufigsten berichteten unerwünschten Reaktionen (1% oder mehr und zweimal Placebo -Rate) waren EKG -Spannungskriterien für die ventrikuläre Hypertrophie TIC Erbrechen psychomotorischer Hyperaktivität verringerten Appetit und Hautausschlag [2 Instanzen für jede unerwünschte Reaktion, d. H. 2/218 (1%). Zu den weniger häufig berichteten unerwünschten Reaktionen (weniger als 1% oder weniger als zweimal die Placebo -Rate) gehörten abdominale Schmerzen im oberen trockenen Mundgewicht verringerte Schwindel -Schläfrigkeit -Logorrhoe -Brustschmerz Wut und Bluthochdruck.
In der kontrollierten Studie bei pädiatrischen Patienten im Alter von 13 bis 17 Jahren (Studie 4) 3% (7/233) von mit Vyvanse behandelten Patienten wurden aufgrund unerwünschter Reaktionen im Vergleich zu 1% (1/77) von mit Placebo behandelten Patienten abgesetzt. Die am häufigsten berichteten unerwünschten Reaktionen (1%oder mehr und zweimal Placebo -Rate) wurden verringerter Appetit (2/233; 1%) und Schlaflosigkeit (2/233; 1%). Zu den weniger häufig gemeldeten unerwünschten Reaktionen (weniger als 1% oder weniger als zweimal die Placebo -Rate) gehörten Reizfaktoren für die Wermatillomanie und Dyspnoe.
In der kontrollierten Studie für Erwachsene (Studie 7) 6% (21/358) von mit Vyvanse behandelten Patienten wurden aufgrund unerwünschter Reaktionen im Vergleich zu 2% (1/62) von Placebo-behandelten Patienten abgesetzt. Die am häufigsten berichteten unerwünschten Reaktionen (1%oder mehr und zweimal Placebo) waren Schlaflosigkeit (8/358; 2%) Tachykardie (3/358; 1%) Reizbarkeit (2/358; 1%) Hypertonie (4/358; 1%) Kopfschütze (2/358; 1%). 1%). Zu den weniger häufig berichteten unerwünschten Reaktionen (weniger als 1% oder weniger als zweimal Placebo -Rate) gehörten Palpitations -Durchfall. Übelkeit verringerte den Appetit -Schwindel -Agitation -Depression Paranoia und Unruhe.
Nebenwirkungen, die bei einer Inzidenz von ≥ 5% oder mehr bei mit Vyvanse behandelten Patienten mit ADHS in klinischen Studien auftreten
Die häufigsten unerwünschten Reaktionen (Inzidenz ≥ 5% und mindestens zweimal Placebo) bei pädiatrischen Patienten im Alter von 6 bis 17 Jahren und/oder Erwachsenen waren anerkannte Angstzustände verringerten den Appetit durch Durchfall durch Durchfall.
Nebenwirkungen, die bei einer Inzidenz von 2% oder mehr bei mit Vyvanse behandelten Patienten mit ADHS in klinischen Studien auftreten
Nebenwirkungen berichteten in den kontrollierten Studien bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren (Studie 1) pädiatrische Patienten im Alter von 13 bis 17 Jahren (Studie 4) und erwachsene Patienten (Studie 7), die mit Vyvanse oder Placebo behandelt werden, sind in den Tabellen 1 2 und 3 unten dargestellt.
Tabelle 1 Nebenwirkungen von 2% oder mehr pädiatrischen Patienten im Alter von 6 bis 12 Jahren, wobei ADHS Vyvanse einnimmt und mehr oder gleich doppelt so hoch ist wie bei Patienten, die in einer 4-wöchigen klinischen Studie Placebo einnehmen (Studie 1)
| Vyvanse (n = 218) | Placebo (n = 72) | |
| Verringerter Appetit | 39% | 4% |
| Schlaflosigkeit | 22% | 3% |
| Bauchschmerzen obere | 12% | 6% |
| Reizbarkeit | 10% | 0% |
| Erbrechen | 9% | 4% |
| Gewicht nahm ab | 9% | 1% |
| Brechreiz | 6% | 3% |
| Trockener Mund | 5% | 0% |
| Schwindel | 5% | 0% |
| Labilität beeinflussen | 3% | 0% |
| Ausschlag | 3% | 0% |
| Pyrexie | 2% | 1% |
| Schläfrigkeit | 2% | 1% |
| Tic | 2% | 0% |
| Anorexie | 2% | 0% |
Tabelle 2 Nebenwirkungen von 2% oder mehr pädiatrischen Patienten im Alter von 13 bis 17 Jahren, wobei ADHS Vyvanse einnimmt und mehr oder gleich doppelt so hoch ist wie bei Patienten, die in einer 4-wöchigen klinischen Studie Placebo einnehmen (Studie 4)
| Vyvanse (n = 233) | Placebo (n = 77) | |
| Verringerter Appetit | 34% | 3% |
| Schlaflosigkeit | 13% | 4% |
| Gewicht nahm ab | 9% | 0% |
| Trockener Mund | 4% | 1% |
| Herzklopfen | 2% | 1% |
| Anorexie | 2% | 0% |
| Tremor | 2% | 0% |
Tabelle 3 Nebenwirkungen von 2% oder mehr erwachsenen Patienten mit ADHS, die Vyvanse einnehmen und bei Patienten in einer 4-wöchigen klinischen Studie Placebo einnehmen (Studie 7), mehr oder gleich doppelt so
| Vyvanse (n = 358) | Placebo (n = 62) | |
| Verringerter Appetit | 27% | 2% |
| Schlaflosigkeit | 27% | 8% |
| Trockener Mund | 26% | 3% |
| Durchfall | 7% | 0% |
| Brechreiz | 7% | 0% |
| Angst | 6% | 0% |
| Anorexie | 5% | 0% |
| Fühle mich nervös | 4% | 0% |
| Agitation | 3% | 0% |
| Erhöhter Blutdruck | 3% | 0% |
| Hyperhidrose | 3% | 0% |
| Unruhe | 3% | 0% |
| Vermindertes Gewicht | 3% | 0% |
| Dyspnoe | 2% | 0% |
| Erhöhte Herzfrequenz | 2% | 0% |
| Tremor | 2% | 0% |
| Herzklopfen | 2% | 0% |
Zusätzlich wurde bei 2,6% der Männer auf Vyvanse und 0% auf Placebo eine erektile Dysfunktion der erwachsenen Bevölkerung beobachtet. Eine verminderte Libido wurde bei 1,4% der Probanden auf Vyvanse und 0% auf Placebo beobachtet.
Gewichtsverlust und Verlangsamung der Wachstumsrate bei pädiatrischen Patienten mit ADHS
In einer kontrollierten Studie mit Vyvanse bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren (Studie 1) betrug der mittlere Gewichtsverlust aus dem Ausgangswert nach 4 Wochen Therapie -0,9 -1,9 bzw. -2,5 Pfund für Patienten, die 30 mg 50 mg und 70 mg Vyvanse im Vergleich zu einem Gewichtsgewinn von 1 Pfund für Patienten erhalten. Höhere Dosen waren mit einem stärkeren Gewichtsverlust mit 4 Wochen Behandlung verbunden. Eine sorgfältige Nachuntersuchung bei Gewicht bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren, die über 12 Monate Vyvanse erhielten, legt nahe, dass konsequent medikamente pädiatrische Patienten (d. H. Die Behandlung von 7 Tagen pro Woche im Laufe des Jahres) eine Verlangsamung der Wachstumsrate aufweist, die nach dem Körpergewicht gemessen wurde, wie nach dem Nachweis von Alters- und Geschlechtsnorm, durchschnittlich die Durchschnittsänderung von 40 monatig (40). In einer 4 -wöchigen kontrollierten Studie mit Vyvanse bei pädiatrischen Patienten im Alter von 13 bis 17 Jahren betrug der mittlere Gewichtsverlust vom Ausgangswert bis zum Endpunkt -2,7 -4,3 und -4,8 lbs. jeweils bei Patienten, die 30 mg 50 mg bzw. 70 mg Vyvanse erhalten, im Vergleich zu einer Gewichtszunahme von 2,0 Pfund bei Patienten, die Placebo erhalten.
Careful follow-up of weight and height in pediatric patients ages 7 to 10 years who were randomized to either methylphenidate or non-medication treatment groups over 14 months as well as in naturalistic subgroups of newly methylphenidate-treated and non-medication treated pediatric patients over 36 months (to the ages of 10 to 13 years) suggests that consistently medicated pediatric patients ages 7 to 13 years (i.e. treatment for 7 days per week throughout the year) eine vorübergehende Verlangsamung der Wachstumsrate (im Durchschnitt insgesamt etwa 2 cm weniger Höhe und 2,7 kg weniger Gewichtswachstum über 3 Jahre) ohne Anzeichen einer Wachstumserholung in dieser Entwicklungszeit. In einer kontrollierten Studie mit Amphetamin (D- zu L -Enantiomer -Verhältnis von 3: 1) bei pädiatrischen Patienten im Alter von 13 bis 17 Jahren betrug die mittlere Gewichtsänderung gegenüber dem Ausgangswert innerhalb der ersten 4 Wochen der Therapie -1,1 Pfund bzw. -2,8 Pfund für Patienten, die 10 mg und 20 mg Amphetamtam erhielten. Höhere Dosen waren innerhalb der ersten 4 Wochen der Behandlung mit einem höheren Gewichtsverlust verbunden [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Gewichtsverlust bei Erwachsenen mit ADHS
In der kontrollierten Studie für Erwachsene (Studie 7) betrug der mittlere Gewichtsverlust nach 4 Wochen Therapie 2,8 Pfund 3,1 Pfund und 4,3 Pfund für Patienten, die eine endgültige Dosen von 30 mg 50 mg und 70 mg Vyvanse erhielten, verglichen mit einer mittleren Gewichtszunahme von 0,5 Pfund für Patienten, die Placebo erhalten.
Binge Essstörung
Die Sicherheitsdaten in diesem Abschnitt basieren auf Daten aus zwei 12-wöchigen parallelen Gruppen, die flexibel dosiert placebokontrollierte Studien bei Erwachsenen mit Bett sind [siehe Klinische Studien 14.2]. Patienten mit anderen kardiovaskulären Risikofaktoren als Fettleibigkeit und Rauchen wurden ausgeschlossen.
Nebenwirkungen im Zusammenhang mit dem Absetzen der Behandlung in klinischen Studien des Bettes im Zusammenhang mit der Behandlung
In kontrollierten Studien mit Patienten im Alter von 18 bis 55 Jahren 5,1% (19/373) von mit Vyvanse behandelten Patienten wurden aufgrund von Nebenwirkungen im Vergleich zu 2,4% (9/372) von Placebo-behandelten Patienten abgesetzt. Keine einzige nachteilige Reaktion führte zum Absetzen von 1% oder mehr von mit Vyvanse behandelten Patienten. Zu den weniger häufig berichteten unerwünschten Reaktionen (weniger als 1% oder weniger als zweimal die Placebo -Rate) gehörten erhöhte Herzfrequenzkopfschmerzen Bauchschmerzen obere Dyspnoe -Hautausschlagslosigkeit Irritabilität, die sich nervös und ängstlich anfühlten.
Nebenwirkungen auf eine Inzidenz von 5% oder mehr und mindestens zweimal Placebo unter vyvanse behandelten Patienten mit Bett in klinischen Studien auftreten
Die häufigsten Nebenwirkungen (Inzidenz ≥ 5% und mindestens zweimal Placebo), die bei Erwachsenen berichteten, waren trockene Mund -Schlaflosigkeit verringerten den Appetit erhöhte die Herzfrequenzverstopfung, die sich nervös und ängstlich anfühlte.
Nebenwirkungen auf eine Inzidenz von 2% oder mehr und mindestens zweimal Placebo bei mit Vyvanse behandelten Patienten mit Bett in klinischen Studien auftreten
Nebenwirkungen in den gepoolten kontrollierten Studien bei erwachsenen Patienten (Studie 11 und 12), die mit Vyvanse oder Placebo behandelt wurden, sind in Tabelle 4 unten dargestellt.
Tabelle 4 Nebenwirkungen von 2% oder mehr erwachsenen Patienten mit Bett, die Vyvanse einnehmen, und mehr oder gleich doppelt so hoch wie bei Patienten, die in 12-wöchigen klinischen Studien Placebo einnehmen (Studie 11 und 12)
| Vyvanse (N = 373) | Placebo (N = 372) | |
| Trockener Mund | 36% | 7% |
| Schlaflosigkeit1 | 20% | 8% |
| Verringerter Appetit | 8% | 2% |
| Erhöhte Herzfrequenz2 | 7% | 1% |
| Fühle mich nervös | 6% | 1% |
| Verstopfung | 6% | 1% |
| Angst | 5% | 1% |
| Durchfall | 4% | 2% |
| Vermindertes Gewicht | 4% | 0% |
| Hyperhidrose | 4% | 0% |
| Erbrechen | 2% | 1% |
| Gastroenteritis | 2% | 1% |
| Parästhesie | 2% | 1% |
| Pruritus | 2% | 1% |
| Schmerzen im Oberbauch | 2% | 0% |
| Energie nahm zu | 2% | 0% |
| Harnwegsinfektion | 2% | 0% |
| Alptraum | 2% | 0% |
| Unruhe | 2% | 0% |
| Oropharyngealschmerz | 2% | 0% |
| 1 Enthält alle bevorzugten Begriffe, die das Wort Schlaflosigkeit enthalten. 2 Enthält die bevorzugten Begriffe, die die Herzfrequenz erhöht und Tachykardie. |
Nachmarkterfahrung
Die folgenden nachteiligen Reaktionen wurden während der Verwendung von Vyvanse nach der Annahme identifiziert. Da diese Reaktionen freiwillig aus einer Population unsicherer Größe berichtet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder ein kausales Verhältnis zur Arzneimittelexposition herzustellen. Diese Ereignisse sind wie folgt: Kardiomyopathie mydriassis diplopie Schwierigkeiten mit visuellem Anstand verlängerte Erektionen Verstopfung Rhabdomyolyse und Darmischämie.
Wechselwirkungen mit Arzneimitteln for Vyvanse
Medikamente mit klinisch wichtigen Wechselwirkungen mit Amphetaminen
Tabelle 5 Medikamente mit klinisch wichtigen Wechselwirkungen mit Amphetaminen.
| Mao -Inhibitoren (en) | |
| Klinische Auswirkung | Maoi -Antidepressiva Langsamen Amphetaminstoffwechsel erhöhen den Amphetaminen auf die Freisetzung von Noradrenalin und anderen Monoaminen aus adrenergen Nervenenden, die Kopfschmerzen und andere Anzeichen einer hypertensiven Krise verursachen. Toxische neurologische Wirkungen und maligne Hyperpyrexie können manchmal mit tödlichen Ergebnissen auftreten. |
| Intervention | Verabreichen Sie Vyvanse während oder innerhalb von 14 Tagen nach der Verabreichung von Maoi nicht [siehe Kontraindikationen ]. |
| Serotonerge Medikamente | |
| Klinische Auswirkung | Die gleichzeitige Verwendung von Vyvanse- und Serotonergen -Arzneimitteln erhöht das Risiko eines Serotonin -Syndroms. |
| Intervention | Mit niedrigeren Dosen einleiten und Patienten auf Anzeichen und Symptome des Serotonin -Syndroms insbesondere während der Vyvanse -Initiierung oder der Dosierungssteigerung überwachen. Wenn ein Serotonin -Syndrom auftritt WARNUNGS AND VORSICHTSMASSNAHMEN ]. |
| CYP2D6 -Inhibitoren | |
| Klinische Auswirkung | Die gleichzeitige Anwendung von Vyvanse- und CYP2D6 -Inhibitoren kann die Exposition von Dextroamphetamin erhöhen, den aktiven Metaboliten von Vyvanse im Vergleich zur Verwendung des Arzneimittels allein und das Risiko eines Serotonin -Syndroms erhöhen. |
| Intervention | Mit niedrigeren Dosen einleiten und Patienten auf Anzeichen und Symptome des Serotonin -Syndroms insbesondere während der Vyvanse -Initiation und nach einer Dosierungssteigerung überwachen. Wenn das Serotonin -Syndrom auftritt, stellen Sie Vyvanse und den Cyp2D6 -Inhibitor ein WARNUNGS AND VORSICHTSMASSNAHMEN Und ÜBERDOSIS ]. |
| Alkalinierungen | |
| Klinische Auswirkung | Harnalkalinisierungsmittel können den Blutspiegel erhöhen und die Wirkung von Amphetamin potenzieren. |
| Intervention | Die gleichzeitige Verabreichung von Vyvanse- und Harnalkalinierungsmitteln sollte vermieden werden. |
| Senden von Wirkstoffen | |
| Klinische Auswirkung | Die gesäuerten Mittel im Urin können den Blutspiegel und die Wirksamkeit von Amphetaminen senken. |
| Intervention | Erhöhen Sie die Dosis basierend auf dem klinischen Ansprechen. |
| Trizyklische Antidepressiva | |
| Klinische Auswirkung | Kann die Aktivität von trizyklischen oder sympathomimetischen Wirkstoffen verbessern, die auffällige und anhaltende Zunahme der Konzentration von D-Amamphetamin im Gehirn verursachen. Herz -Kreislauf -Effekte können potenziert werden. |
| Intervention | Überwachen Sie häufig und passen Sie eine alternative Therapie an, die auf klinischem Ansprechen basiert. |
Medikamente mit klinisch wichtigen Wechselwirkungen mit Vyvanse
Aus pharmakokinetischer Sicht ist keine Dosisanpassung von Vyvanse erforderlich, wenn Vyvanse mit Guanfacine Venlafaxin oder Omeprazol gemeinsam verabreicht wird. Darüber hinaus ist keine Dosisanpassung von Guanfacin oder Venlafaxin erforderlich, wenn Vyvanse gemeinsam verabreicht wird [siehe Klinische Pharmakologie ].
Aus einer pharmakokinetischen Perspektive keine Dosisanpassung für Arzneimittel, die Substrate von CYP1A2 (z. Simvastatin) ist notwendig, wenn Vyvanse gemeinsam verabreicht wird [siehe Klinische Pharmakologie ].
Drogenmissbrauch und Abhängigkeit
Kontrollierte Substanz
Vyvanse contains lisdexamfetamine a prodrug of amphetamine a Schedule II controlled substance.
Missbrauch
Vyvanse has a high potential for abuse Und misuse which can lead to the development of a substance use disorder including addiction [see WARNUNGS AND VORSICHTSMASSNAHMEN ]. Vyvanse can be diverted for non-medical use into illicit channels or distribution.
Missbrauch is the intentional non-therapeutic use of a drug even once to achieve a desired psychological or physiological effect. Misuse is the intentional use for therapeutic purposes of a drug by an individual in a way other than prescribed by a health care provider or for whom it was not prescribed. Drug addiction is a cluster of behavioral cognitive Und physiological phenomena that may include a strong desire to take the drug difficulties in controlling drug use (e.g. continuing drug use despite harmful consequences giving a higher priority to drug use than other activities Und obligations) Und possible tolerance or physical dependence.
Missbrauch und Missbrauch von Lisdexamfetamin Ein Prodrug von Amphetamin kann eine erhöhte Herzfrequenzreatrate oder einen Blutdruck verursachen; Schwitzen; erweiterte Schüler; Hyperaktivität; Unruhe; Schlaflosigkeit; verminderter Appetit; Koordinierungsverlust; Zittern; Spülhaut; Erbrechen; und/oder Bauchschmerzen. Die Feindseligkeit Aggression von Angstpsychose und Suizid- oder Mordgedanken wurden ebenfalls bei Missbrauch und/oder Missbrauch von ZNS -Stimulanzien beobachtet. Missbrauch und Missbrauch von ZNS -Stimulanzien einschließlich Vyvanse können zu Überdosierung und Tod führen [siehe ÜBERDOSIS ] und dieses Risiko wird mit höheren Dosen oder nicht genehmigten Verabreichungsmethoden wie Schnauben oder Injektion erhöht.
Untersuchungen von Vyvanse bei Drogenmissbrauchern
Eine randomisierte Doppelblind-Placebokontrollkreuz-Missbrauchs-Haftungsstudie bei 38 Patienten mit einem Arzneimittelmissbrauch wurde mit einem Dosen von 50 100 oder 150 mg Vyvanse 40 mg Sofortlösungs-D-Amamphetaminsulfat (ein kontrollierter II-Substanz) und 200 mg Diethylpropion-Hydrochlhorid-Hydrochlhorid-Hydrochlhorid-Hydrochorid (a kontrolliert). Vyvanse 100 mg erzeugte signifikant weniger medikamentenmagierende Auswirkungen, gemessen an der Wirkstoffbewertung im Vergleich zu D-Amphetamin 40 mg; und 150 mg Vyvanse zeigten ähnliche medikamentenmedikamentöse Wirkungen im Vergleich zu 40 mg D-Amphetamin und 200 mg Diethylpropion.
Die intravenöse Verabreichung von 50 mg Lisdexamfetamin-Dimesylat an Personen mit einer Vorgeschichte von Drogenmissbrauch führte zu positiven subjektiven Reaktionen auf Skalen, die das Arzneimittel messen, das Euphorie-Amphetamin-Effekte und Benzedrin-Wirkungen, die größer waren, aber weniger als die von einer äquivalenten Dosis (20 Mg) von intravenösen D-Ampern produzierten Dose waren.
Abhängigkeit
Physische Abhängigkeit
Vyvanse may produce physical dependence. Physical dependence is a state that develops as a result of physiological adaptation in response to repeated drug use manifested by withdrawal signs Und symptoms after abrupt discontinuation or a significant dose reduction of a drug. Withdrawal signs Und symptoms after abrupt discontinuation or dose reduction following prolonged use of CNS stimulants including Vyvanse include dysphoric mood; Depression; fatigue; vivid unpleasant dreams ; insomnia or hypersomnia; increased appetite; Und psychomotor retardation or Agitation.
Toleranz
Vyvanse may produce tolerance. Toleranz is a physiological state characterized by a reduced response to a drug after repeated administration (i.e. a higher dose of a drug is required to produce the same effect that was once obtained at a lower dose).
Warnungen für Vyvanse
Eingeschlossen als Teil der 'VORSICHTSMASSNAHMEN' Abschnitt
Vorsichtsmaßnahmen für Vyvanse
Missbrauch Misuse And Addiction
Vyvanse has a high potential for abuse Und misuse. The use of Vyvanse exposes individuals to the risks of abuse Und misuse which can lead to the development of a substance use disorder including addiction. Vyvanse can be diverted for non-medical use into illicit channels or distribution [see Drogenmissbrauch und Abhängigkeit ]. Misuse Und abuse of CNS stimulants including Vyvanse can result in overdose Und death [see ÜBERDOSIS ] und dieses Risiko wird mit höheren Dosen oder nicht genehmigten Verabreichungsmethoden wie Schnauben oder Injektion erhöht.
Vor der Verschreibung von Vyvanse das Risiko jedes Patienten für Missbrauchsmissbrauch und Sucht beurteilen. Bildung von Patienten und ihren Familien über diese Risiken und die ordnungsgemäße Entsorgung eines ungenutzten Arzneimittels. Raten Sie den Patienten, Vyvanse an einem sicheren Ort aufzubewahren, der vorzugsweise gesperrt ist, und weist die Patienten an, Vyvanse niemand anderem zu geben. Während der gesamten Vyvanse -Behandlung müssen das Risiko eines Missbrauchs und der Sucht des Patienten das Risiko eines Missbrauchs neu bewerten und häufig Anzeichen und Symptome von Missbrauchsmissbrauch und Sucht überwachen.
Risiken für Patienten mit schweren Herzerkrankungen
Bei Patienten mit strukturellen Herzanomalien oder anderen schwerwiegenden Herzerkrankungen, die bei der empfohlenen ADHS -Dosierung mit ZNS -Stimulanzien behandelt wurden, wurde ein plötzlicher Tod berichtet. Vermeiden Sie den Einsatz von Vyvanse bei Patienten mit bekannten strukturellen Herzanomalien kardiomyopathisch schwerwiegende Herzrhythmus -Koronararterienkrankheiten oder andere schwerwiegende Herzerkrankungen.
Erhöhter Blutdruck And Heart Rate
ZNS -Stimulanzien verursachen einen Anstieg des Blutdrucks (mittlerer Anstieg von etwa 2 bis 4 mm Hg) und Herzfrequenz (mittlerer Anstieg von etwa 3 bis 6 bpm). Einige Patienten können größere Erhöhungen aufweisen.
Überwachen Sie alle mit Vyvanse behandelten Patienten auf potenzielle Tachykardie und Bluthochdruck.
Psychiatrische Nebenwirkungen
Verschlimmerung der bereits bestehenden Psychose
ZNS-Stimulanzien können Symptome einer Verhaltensstörung und der Gedankenstörung bei Patienten mit einer bereits bestehenden psychotischen Störung verschlimmern.
Induktion einer manischen Episode bei Patienten mit bipolarer Störung
ZNS -Stimulanzien können eine manische oder gemischte Episode induzieren. Vor der Einleitung von Vyvanse -Behandlungspatienten für Risikofaktoren für die Entwicklung einer manischen Episode (z. B. komorbiden oder Vorgeschichte von depressiven Symptomen oder eine Familienanamnese des Selbstmordes bipolare Störung Und Depression).
Neue psychotische oder manische Symptome
ZNS -Stimulanzien bei der empfohlenen Dosierung können bei Patienten ohne Vorgeschichte von psychotischen Krankheiten oder Manie psychotische oder manische Symptome (z. B. Halluzinationen täuschen oder Manie) verursachen. Bei einer gepoolten Analyse mehrerer kurzfristiger, placebokontrollierter Studien mit ZNS-Stimulanzien traten bei ungefähr 0,1% der stimulanzierten Patienten von ZNS-Patienten im Vergleich zu 0% der mit Placebo behandelten Patienten auf. Wenn solche Symptome auftreten, sollten Sie Vyvanse absetzen.
Langzeitunterdrückung des Wachstums bei pädiatrischen Patienten
ZNS -Stimulanzien wurden mit Gewichtsverlust und Verlangsamung der Wachstumsrate bei pädiatrischen Patienten in Verbindung gebracht.
In einer 4-wöchigen, placebokontrollierten Studie mit Vyvanse bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren mit ADHS trat in den Vyvanse-Gruppen im Vergleich zur Gewichtszunahme in der Placebo-Gruppe eine dosisbedingte Gewichtsabnahme auf. Zusätzlich wurde in Untersuchungen eines anderen Stimulans eine Verlangsamung der Höhe der Größe [siehe Nebenwirkungen ].
Überwachen Sie das Wachstum (Gewicht und Größe) bei mit Vyvanse behandelten pädiatrischen Patienten. Patienten, die nicht wie erwartet wachsen oder zunehmen, müssen möglicherweise ihre Behandlung unterbrochen werden. Vyvanse ist nicht zur Verwendung bei pädiatrischen Patienten unter 6 Jahren zugelassen [siehe Verwendung in bestimmten Populationen ].
Periphere Vaskulopathie einschließlich Raynauds Phänomen
ZNS -Stimulanzien, einschließlich Vyvanse zur Behandlung von ADHS, sind mit einer peripheren Vaskulopathie einschließlich Raynauds Phänomen verbunden. Anzeichen und Symptome sind normalerweise intermittierend und mild; Sequelae umfassten jedoch digitale Geschwüre und/oder Weichgewebeverletzung. Die Auswirkungen der peripheren Vaskulopathie einschließlich des Phänomens von Raynaud wurden in Berichten nach dem Stempeln und in den therapeutischen Dosierungen von ZNS -Stimulanzien in allen Altersgruppen während des gesamten Behandlungsprogramms beobachtet. Anzeichen und Symptome verbesserten sich im Allgemeinen nach Dosierungsreduzierung oder Abbruch des ZNS -Stimulans.
Bei der Behandlung von Vyvanse ist eine sorgfältige Beobachtung digitaler Veränderungen erforderlich. Eine weitere klinische Bewertung (z. B. rheumatologische Überweisung) kann für mit Vyvanse behandelte Patienten geeignet sein, die Anzeichen oder Symptome einer peripheren Vaskulopathie entwickeln.
Serotons Syndrom
Serotonin syndrome a potentially life-threatening reaction may occur when amphetamines are used in combination with other drugs that affect the serotonergic neurotransmitter systems such as monoamine oxidase inhibitors (MAOIs) selective serotonin reuptake inhibitors (SSRIs) serotonin norepinephrine reuptake inhibitors (SNRIs) triptans tricyclic antidepressants Fentanyl Lithium tramadol Tryptophan Buspirone und St. Johns Würze [siehe Wechselwirkungen mit Arzneimitteln (7.1)]. Die gleichzeitige Verabreichung mit Cytochrom-P450 2D6 (CYP2D6) -Hemmer kann auch das Risiko erhöhen, wobei die Exposition gegenüber dem aktiven Metaboliten von Vyvanse (Dextroamphetamin) erhöht ist. In diesen Situationen berücksichtigen ein alternatives nicht-serotonerge Arzneimittel oder ein alternatives Arzneimittel, das CYP2D6 nicht hemmt [siehe Wechselwirkungen mit Arzneimitteln ].
Serotonin syndrome symptoms may include mental status changes (e.g. agitation hallucinations delirium and coma) autonomic instability (e.g. tachycardia labile blood pressure dizziness diaphoresis flushing hyperthermia) neuromuscular symptoms (e.g. tremor rigidity myoclonus hyperreflexia incoordination) seizures and/or gastrointestinal symptoms (e.g. nausea Erbrechen Durchfall).
Die gleichzeitige Verwendung von Vyvanse mit Maoi -Medikamenten ist kontraindiziert [siehe Kontraindikationen ].
Abbruchbehandlung mit Vyvanse und gleichzeitigen serotonergen Wirkstoffen sofort, wenn Symptome des Serotonin -Syndroms auftreten und eine unterstützende symptomatische Behandlung initiieren. Wenn ein gleichzeitiger Einsatz von Vyvanse mit anderen serotonergen Arzneimitteln oder CYP2D6 -Inhibitoren klinisch gerechtfertigt ist, initiieren Sie Vyvanse mit niedrigeren Dosen die Patienten für das Auftreten des Serotonin -Syndroms während der Initiierung oder Titration des Serotonin -Syndroms.
Motorische und verbale Tics und Verschlechterung des Tourette -Syndroms
ZNS -Stimulanzien einschließlich Amphetamin wurden mit dem Beginn oder einer Verschlimmerung von motorischen und verbalen Tics in Verbindung gebracht. Die Verschlechterung des Tourette -Syndroms wurde ebenfalls berichtet [siehe Nebenwirkungen ].
Bewerten Sie vor der Einleitung von Vyvanse die Familienanamnese und bewerten Sie die Patienten für Tics oder das Tourette -Syndrom klinisch. Überwachen Sie regelmäßig mit Vyvanse behandelte Patienten auf Entstehung oder Verschlechterung von Tics oder das Tourette-Syndrom und die Behandlung der Behandlung, wenn sie klinisch angemessen sind.
Patientenberatungsinformationen
Raten Sie dem Patienten, die von der FDA zugelassene Patientenkennzeichnung zu lesen ( Medikamentenhandbuch ).
Missbrauch Misuse And Addiction
Schulung von Patienten und ihren Familien über das Risiko von Missbrauchsmissbrauch und Abhängigkeit von Vyvanse, die zu Überdosierung und Tod und ordnungsgemäßer Entsorgung eines ungenutzten Arzneimittels führen können [siehe WARNUNGS AND VORSICHTSMASSNAHMEN Drogenmissbrauch und Abhängigkeit ÜBERDOSIS ]. Advise patients to store Vyvanse in a safe place preferably locked Und instruct patients to not give Vyvanse to anyone else.
Risiken für Patienten mit schweren Herzerkrankungen
Raten Sie den Patienten, dass Patienten mit schwerwiegenden Herzerkrankungen potenzielle Risiken bestehen, einschließlich des plötzlichen Todes mit Vyvanse. Weisen Sie die Patienten an, sich sofort an einen Gesundheitsdienstleister zu wenden, wenn sie Symptome wie Anstrengungstrustschmerzen entwickeln, ungeklärte Synkope oder andere Symptome, die auf Herzerkrankungen deuten [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Erhöhter Blutdruck And Heart Rate
Weisen Sie die Patienten an, dass Vyvanse Erhöhungen ihres Blutdrucks und der Pulsfrequenz verursachen kann, und sie sollten auf solche Effekte überwacht werden.
Psychiatrische Nebenwirkungen
Beraten Sie den Patienten, dass Vyvanse in empfohlenen Dosen auch bei Patienten ohne Vorgeschichte von psychotischen Symptomen oder Manie psychotische oder manische Symptome verursachen kann [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Langzeitunterdrückung des Wachstums bei pädiatrischen Patienten
Beraten Sie den Patienten, dass Vyvanse eine Verlangsamung des Wachstums einschließlich Gewichtsverlust verursachen kann [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
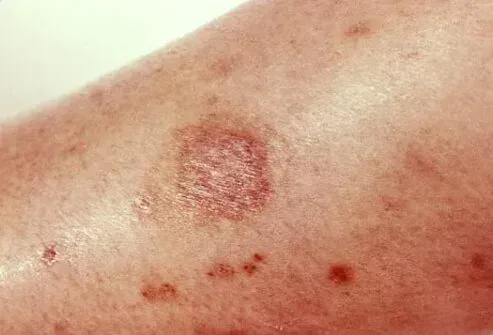
Kreislaufprobleme bei Fingern und Zehen [periphere Vaskulopathie einschließlich Raynauds Phänomen]
Weisen Sie die Patienten mit der Behandlung mit Vyvanse über das Risiko einer peripheren Vaskulopathie einschließlich Raynauds Phänomen und damit verbundenen Anzeichen und Symptomen an: Finger oder Zehen können taubkühles schmerzhaft und/oder von blass zu blau zu rot wechseln. Weisen Sie die Patienten an, ihrem Arzt eine neue Taubheitsschmerz -Hautfarbe zu melden, um die Temperatur bei Fingern oder Zehen zu empfinden. Weisen Sie die Patienten an, ihren Arzt sofort mit Anzeichen von ungeklärten Wunden auf den Fingern oder Zehen anzurufen, während sie Vyvanse einnehmen. Eine weitere klinische Bewertung (z. B. rheumatologische Überweisung) kann für bestimmte Patienten geeignet sein [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Serotons Syndrom
Warnungspatienten vor dem Risiko eines Serotonin -Syndroms mit gleichzeitiger Anwendung von Vyvanse und anderen Serotonergen Medikamenten, einschließlich SSRIS Snris Triptans tricyclischer Antidepressiva Fentanyl lithium tramadol tryptophan bustophan buspspiron St. Johns Würdel, die auch die Metabolism -Störungen des Serotons von SEROTONICINISICINISHAHRINN (SEROTONISCHEN SINDEN (SEROTONISCH) und SEROTONS VON SEROTONINEN (SERTORING DER SEROTONINGE linezolid [siehe Kontraindikationen WARNUNGS AND VORSICHTSMASSNAHMEN Und Wechselwirkungen mit Arzneimitteln ]. Advise patients to contact their healthcare provider or report to the emergency room if they experience signs or symptoms of serotonin syndrome.
Begleitmedikamente
Raten Sie den Patienten, ihre Ärzte zu benachrichtigen, wenn sie eine verschreibungspflichtige oder rezeptfreie Medikamente einnehmen oder planen, da Interaktionen Potenzial bestehen [siehe Wechselwirkungen mit Arzneimitteln ].
Motorische und verbale Tics und Verschlechterung des Tourette -Syndroms
Beraten Sie Patienten, dass motorische und verbale Tics und Verschlechterung des Tourette -Syndroms während der Behandlung mit Vyvanse auftreten können. Weisen Sie die Patienten an, ihren Gesundheitsdienstleister zu benachrichtigen, wenn neue Tics oder eine Verschlechterung von Tics oder das Tourette -Syndrom auftreten [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Schwangerschaftsregister
Beraten Sie den Patienten, dass es ein Register für Schwangerschaftsbelastung gibt, das die Schwangerschaftsergebnisse bei Frauen überwacht, die während der Schwangerschaft Vyvanse ausgesetzt sind [siehe Verwendung in bestimmten Populationen ].
Schwangerschaft
Beraten Sie die Patienten über die potenziellen fetalen Effekte aus der Verwendung von Vyvanse während der Schwangerschaft. Raten Sie den Patienten, ihren Gesundheitsdienstleister zu benachrichtigen, wenn sie schwanger werden oder beabsichtigen, während der Behandlung mit Vyvanse schwanger zu werden [siehe Verwendung in bestimmten Populationen ].
Stillzeit
Raten Sie Frauen, nicht zu stillen, wenn sie Vyvanse einnehmen [siehe Verwendung in bestimmten Populationen ].
Verwaltungsanweisungen
- Kapseln: Raten Sie den Patienten, die Kapseln ganz oder leeren zu nehmen und den gesamten Inhalt mit Joghurtwasser oder Orangensaft zu mischen. Raten Sie den Patienten, die Mischung sofort zu konsumieren und nicht für die zukünftige Verwendung zu speichern [siehe Dosierung und Verwaltung ].
- Kautabletten: Raten Sie den Patienten, dass Kautabletten vor dem Schlucken gründlich gekaut werden müssen [siehe Dosierung und Verwaltung ].
Nichtklinische Toxikologie
Karzinogenese -Mutagenese und Beeinträchtigung der Fruchtbarkeit
Karzinogenese
Karzinogenitätsstudien zu Lisdexamfetamin -Dimesylat wurden nicht durchgeführt. Es wurden keine Hinweise auf Karzinogenität in Studien gefunden, in denen Mäuse und Ratten in der Ernährung 2 Jahre bei Dosen von bis zu 30 mg/kg/Tag bei männlichen und weiblichen Ratten mit bis zu 30 mg/kg/kg/kg/tag bei männlichen und weiblichen Ratten mit bis zu 30 mg/kg/kg/kg/kg/kg/kg/kg/kg/tag bei männlichen und tag bei männlichen Ratten verabreicht wurden.
Mutagenese
Lisdexamfetamin -Dimesylat war im Maus -Knochenmarkmikronukleus -Test nicht klastogen vergeblich Und was negative when tested in the E. coli Und S. Typhimurium Komponenten des Ames -Tests und im L5178Y/TK/-- Maus -Lymphom -Assay in vitro .
Beeinträchtigung der Fruchtbarkeit
Amphetamin (D- zu L-Enantiomer-Verhältnis von 3: 1) beeinflusste die Fertilität oder die frühe embryonale Entwicklung in der Ratte bei Dosen von bis zu 20 mg/kg/Tag nicht nachteilig.
Verwendung in bestimmten Populationen
Schwangerschaft
Schwangerschaft Exposure Registry
Es gibt ein Schwangerschafts -Expositionsregister, das die Schwangerschaftsergebnisse bei Frauen, die während der Schwangerschaft ADHS -Medikamenten ausgesetzt sind, überwacht. Gesundheitsdienstleister werden ermutigt, Patienten unter der Telefonnummer 1-866-961-2388 zu registrieren oder online unter https://womenmentalhealth.org/clinical-and ResearchPrograms/Schwangerschaftsregistrierung/Adhdmedications/zu besuchen.
Risikozusammenfassung
Die begrenzten verfügbaren Daten aus veröffentlichten Literatur- und Nachmarktberichten zur Verwendung von Vyvanse bei schwangeren Frauen reichen nicht aus, um ein drogenassoziiertes Risiko für schwere Geburtsfehler und eine Fehlgeburt zu informieren. Bei Säuglingen, die von Müttern geboren wurden, die von Amphetaminen abhängig sind, wurden unerwünschte Schwangerschaftsergebnisse einschließlich vorzeitiger Entbindung und niedrigem Geburtsgewicht beobachtet [siehe klinische Überlegungen]. In tierischen Fortpflanzungsstudien hatte Lisdexamfetamin-Dimesylat (ein Prodrug von D-Amphetamin) keine Auswirkungen auf die morphologische Entwicklung oder das Überleben von Embryo-fetalen, wenn sie während der gesamten Organogenese oral an schwangere Ratten und Kaninchen verabreicht wurden. Vor- und postnatale Studien wurden nicht mit Lisdexamfetamin-Dimesylat durchgeführt. Amphetamin (D-zu L-Verhältnis von 3: 1) gegenüber schwangeren Ratten während der Schwangerschaft und Laktation führte jedoch zu einer Abnahme des Puppenüberlebens und zu einer Abnahme des PUP-Körpergewichts, die mit einer Verzögerung der Entwicklungsgrad an klinisch relevanten Amphetamin-Dosen korrelierten. Darüber hinaus wurden bei Welpen, deren Mütter mit Amphetamin behandelt wurden, nachteilige Auswirkungen auf die Fortpflanzungsleistung beobachtet. Langzeit-neurochemische und Verhaltenseffekte wurden auch in Tierentwicklungsstudien mit klinisch relevanten Amphetamin-Dosen berichtet [siehe Daten ].
Das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburt für die angegebene Bevölkerung ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für einen Verlust von Geburtsfehlern oder andere nachteilige Ergebnisse. In der US-allgemeinen Bevölkerung beträgt das geschätzte Hintergrundrisiko für größere Geburtsfehler und eine Fehlgeburt bei klinisch anerkannten Schwangerschaften 2-4% bzw. 15 bis 20%.
Klinische Überlegungen
Nebenwirkungen von fetalen/Neugeborenen
Amphetamine wie Vyvanse verursachen Vasokonstriktion und können dadurch die Plazenta -Perfusion verringern. Darüber hinaus können Amphetamine Uteruskontraktionen stimulieren, die das Risiko einer vorzeitigen Abgabe erhöhen. Säuglinge, die von amphetaminabhängigen Müttern geboren wurden, haben ein erhöhtes Risiko für vorzeitige Abgabe und niedriges Geburtsgewicht.
Überwachen Sie Säuglinge, die von Müttern geboren wurden, die Amphetamine auf Entzugssymptome einnehmen, wie z. B. Fütterungsschwierigkeiten Reizbarkeit und übermäßige Schläfrigkeit.
Daten
Tierdaten
Lisdexamfetamin-Dimesylat hatte keine offensichtlichen Auswirkungen auf die morphologische Entwicklung oder das Überleben von Embryo-fetalen, wenn sie während der gesamten Organogenese in Dosen von bis zu 40 bzw. 120 mg/kg/Tag oral an schwangere Ratten und Kaninchen verabreicht wurden. Diese Dosen betragen ungefähr 5,5 bzw. 33 -mal die maximal empfohlene menschliche Dosis (MRHD) von 70 mg/Tag, die Erwachsenen auf einem mg/m gegeben hat2 Basis der Körperoberfläche.
Eine Studie wurde mit Amphetamin (D- zu L-Enantiomer-Verhältnis von 3: 1) durchgeführt, bei dem schwangere Ratten täglich orale Dosen von 2 6 und 10 mg/kg vom Schwangerschaftstag 6 bis zum Laktationstag 20 erhielten. Alle Dosen verursachten Hyperaktivität und verringerte Gewichtszunahme der Dämme. In allen Dosen wurde eine Abnahme des Welpenüberlebens beobachtet. Eine Abnahme des PUP -Körpergewichts wurde bei 6 und 10 mg/kg beobachtet, die mit Verzögerungen bei Entwicklungsgründen wie der Preputialtrennung und der vaginalen Öffnung korrelierten. Eine erhöhte Aktivität der PUP -Lokomotor -Aktivität wurde am 22. Tag nach der Geburt bei 10 mg/kg beobachtet, nicht jedoch 5 Wochen nach der Abgabe. Wenn Welpen auf die Fortpflanzungsleistung bei der Reife -Schwangerschaftsgewichtszahlenzahl von Implantationen getestet wurden, und die Anzahl der abgegebenen Welpen in der Gruppe verringert wurden, deren Mütter 10 mg/kg verabreicht worden waren.
Eine Reihe von Studien aus der Literatur an Nagetieren zeigen, dass vorgeburtliche oder frühe postnatale Exposition gegenüber Amphetamin (D- oder D l-) in Dosen ähnlich denen, die klinisch verwendet werden, zu langfristigen neurochemischen und Verhaltensveränderungen führen können. Zu den gemeldeten Verhaltenseffekten gehören Lern- und Gedächtnisdefizite veränderte lokomotorische Aktivitäten und Änderungen der sexuellen Funktion.
Stillzeit
Risikozusammenfassung
Lisdexamfetamin ist ein Pro-Drogen aus Dextroamphetamin. Basierend auf begrenzten Fallberichten in der veröffentlichten Literatur Amphetamin (D-OR D L-) ist in der Muttermilch in relativen Säuglingsdosen von 2% bis 13,8% der mütterlichen Gewichtsdosis und eines Milch/Plasmas-Verhältnisses zwischen 1,9 und 7,5 vorhanden. Es gibt keine Berichte über nachteilige Auswirkungen des gestillten Kindes. Langzeit neurologische Entwicklungseffekte auf Säuglinge aus der Amphetamin-Exposition sind unbekannt. Es ist möglich, dass große Dosierungen von Dextroamphetamin die Milchproduktion beeinträchtigen könnten, insbesondere bei Frauen, deren Laktation nicht gut etabliert ist. Aufgrund des Potenzials für schwerwiegende unerwünschte Reaktionen bei Säuglingen, einschließlich schwerwiegender kardiovaskulärer Reaktionen, Blutdruck und Herzfrequenz erhöhen die Unterdrückung des Wachstums und die periphere Vaskulopathie den Patienten, dass das Stillen während der Behandlung mit Vyvanse nicht empfohlen wird.
Pädiatrische Verwendung
ADHS
Sicherheit und Wirksamkeit von Vyvanse wurden bei pädiatrischen Patienten mit ADHS im Alter von 6 bis 17 Jahren festgelegt [siehe Dosierung und Verwaltung Nebenwirkungen Klinische Pharmakologie Und Klinische Studien ].
Sicherheit und Wirksamkeit von Vyvanse wurde bei pädiatrischen Patienten unter 6 Jahren nicht festgelegt.
Die Sicherheit und Wirksamkeit von Vyvanse wurde in einer doppelblinden randomisierten parallel-Gruppen-Placebokontrollstudie bei pädiatrischen Patienten im Alter von 4 bis 5 Jahren mit ADHS bewertet, gefolgt von einer 1-jährigen Open-Label-Erweiterungsstudie. In diesen Studien verzeichneten Patienten erhöhte Raten von unerwünschten Reaktionen, einschließlich des Gewichtsverlusts, verringerte den BMI -verringerte Appetit -Schlaflosigkeitsinfektionen (obere Atemwege und Nasopharyngitis) Reizbarkeit und beeinflussen die Labilität.
Bei der gleichen Vyvanse -Dosis war die mittlere Exposition gegenüber Dextroamphetamin bei pädiatrischen Patienten im Alter von 4 bis 5 Jahren im Alter von 6 bis 11 Jahren um etwa 44% höher.
BETT
Sicherheit und Wirksamkeit von Vyvanse wurde bei pädiatrischen Patienten mit einem Bett von weniger als 18 Jahren nicht festgestellt.
Wachstumsunterdrückung
Das Wachstum sollte während der Behandlung mit Stimulanzien wie Vyvanse und pädiatrischen Patienten überwacht werden WARNUNGS AND VORSICHTSMASSNAHMEN Und Nebenwirkungen ].
Jugendliche Tierdaten
Studien, die an jugendlichen Ratten und Hunden in klinisch relevanten Dosen durchgeführt wurden, zeigten eine Wachstumsunterdrückung, die bei Hunden und weiblichen Ratten, jedoch nicht bei männlichen Ratten nach einer vierwöchigen medikamentenfreien Erholungsperiode, teilweise oder vollständig umgekehrt war.
Es wurde eine Studie durchgeführt, in der jugendliche Ratten vom 7. Tag 63 von Tag 6 bis Tag 63 orale Dosen von 4 10 oder 40 mg/kg/Tag Lisdexamfetamin -Dimetamin erhielten. Diese Dosen betragen ungefähr 0,3 0,7 und das dreifache der maximal empfohlenen täglichen Dosis von 70 mg auf einem mg/m2 Basis für ein Kind. Es wurden dosisbedingte Abnahmen des Lebensmittelverbrauchs Körpergewichtsgewinn und Kronenrumpflänge beobachtet; Nach einer vierwöchigen medikamentenfreien Erholungsperiode hatten sich Körpergewichte und Kronen-Rump-Längen bei Frauen signifikant erholt, bei Männern jedoch immer noch wesentlich reduziert. Die Zeit bis zur vaginalen Öffnung verzögerte sich bei Frauen bei der höchsten Dosis, aber es gab keine Arzneimitteleffekte auf die Fruchtbarkeit, wenn die Tiere am Tag 85 am Alter gepaart wurden.
In einer Studie, in der jugendliche Hunde 6 Monate lang mit 10 Wochen im Alter von 10 Wochen eine Verringerung des Körpergewichts bei allen getesteten Dosen beobachtet wurden2 Basis für ein Kind). Dieser Effekt wurde während einer vierwöchigen medikamentenfreien Erholungsperiode teilweise oder vollständig umgekehrt.
Geriatrische Verwendung
Klinische Studien von Vyvanse umfassten nicht eine ausreichende Anzahl von Probanden im Alter von 65 Jahren und mehr, um festzustellen, ob sie anders als jüngere Probanden reagieren. Andere gemeldete klinische Erfahrung und pharmakokinetische Daten [siehe Klinische Pharmakologie ] haben keine Unterschiede in den Antworten zwischen älteren und jüngeren Patienten identifiziert. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten am unteren Ende des Dosierungsbereichs beginnen, was die größere Häufigkeit einer verminderten Nieren- oder Herzfunktion der Leber und einer gleichzeitigen Erkrankung oder einer anderen medikamentösen Therapie widerspiegelt.
Nierenbehinderung
Aufgrund einer verringerten Clearance bei Patienten mit schwerer Nierenbeeinträchtigung (GFR 15 bis <30 mL/min/1.73 m2) Die maximale Dosis sollte 50 mg/Tag nicht überschreiten. Die maximal empfohlene Dosis in ESRD (GFR <15 mL/min/1.73 m2) Patienten sind 30 mg/Tag [siehe Klinische Pharmakologie ].
Lisdexamfetamin und D-Amphetamin sind nicht dialyzierbar.
Überdosierungsinformationen für Vyvanse
Klinische Auswirkungen von Überdosierung
Überdosis von ZNS -Stimulanzien ist durch die folgenden sympathomimetischen Effekte gekennzeichnet:
- Kardiovaskuläre Wirkungen einschließlich Tachyarrhythmien und Bluthochdruck oder Hypotonie. Der Vasospasmus -Myokardinfarkt oder die Aortensektion kann einen plötzlichen Herz Tod verursachen. Die Kardiomyopathie von Takotsubo kann sich entwickeln.
- ZNS -Effekte einschließlich psychomotorischer Agitationsverwirrung und Halluzinationen. Das Serotonin -Syndrom -Anfälle zerebraler Gefäßunfälle und Koma können auftreten.
- Es können sich lebensbedrohliche Hyperthermie (Temperaturen von mehr als 104 ° F) und Rhabdomyolyse entwickeln.
Überdosierungsmanagement
Betrachten Sie die Möglichkeit einer multiplen Drogenaufnahme. Das pharmakokinetische Profil von Vyvanse sollte bei der Behandlung von Patienten mit Überdosierung berücksichtigt werden. Lisdexamfetamin und Damphetamin sind nicht dialyzierbar. Erwägen Sie, sich mit der Gifthelp-Linie (1-800-222-1222) oder einem medizinischen Toxikologen zu wenden, um zusätzliche Empfehlungen zur Überdosierungsmanagement zu erhalten.
Kontraindikationen für Vyvanse
Vyvanse is contraindicated in patients with:
- Bekannte Überempfindlichkeit gegen Amphetaminprodukte oder andere Inhaltsstoffe von Vyvanse. Anaphylaktische Reaktionen Stevens-Johnson-Syndrom Angioödem und Urtikaria wurden in Nachmarktberichten beobachtet [siehe Nebenwirkungen ].
- Patienten, die Monoaminoxidase -Inhibitoren (MAOIS) oder innerhalb von 14 Tagen nach Stoppen von Maois (einschließlich Maois wie Linezolid oder intravenösem Methylenblau) aufgrund des erhöhten Risikos einer hypertensiven Krise einnehmen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN Und Wechselwirkungen mit Arzneimitteln ].
Klinische Pharmakologie for Vyvanse
Wirkungsmechanismus
Lisdexamfetamin ist ein Prodrug von Dextroamphetamin. Amphetamine sind nicht Katecholamin Sympathomimetische Amine mit ZNS -Stimulanzienaktivität. Die genaue Art der therapeutischen Wirkung in ADHS und Bett ist nicht bekannt.
Pharmakodynamik
Amphetamine blockieren die Wiederaufnahme von Noradrenalin und Dopamin in das präsynaptische Neuron und erhöhen Sie die Freisetzung dieser Monoamine in den außereruronalen Raum. Das Elternmedikament Lisdexamfetamin bindet nicht an die für die Wiederaufnahme von Noradrenalin und Dopamin verantwortlichen Stellen in vitro .
Pharmakokinetik
Pharmakokinetische Studien nach oraler Verabreichung von LISDExamfetamin -Dimesylat wurden bei gesunden Erwachsenen (Kapsel- und Kautablettenformulierungen) und pädiatrischen (6 bis 12 Jahren) Patienten mit ADHS (Kapselformulierung) durchgeführt. Nach einer einzelnen Dosisverabreichung von Lisdexamfetamin -Dimetamin -Pharmakokinetik von Dextroamphetamin in einer pädiatrischen Studie (6 bis 12 Jahre) und in einer Erwachsenenstudie wurde festgestellt, dass sie linear zwischen 30 mg und 70 mg sind. Dextroamphetamin pharmakokinetische Parameter nach Verabreichung von Lisdexamfetamin-Dimesylat bei Erwachsenen zeigten ein niedriges Inter-Subjekt (<25%) Und intra-subject (<8%) variability. There is no accumulation of lisdexamfetamine Und dextroamphetamine at steady state in healthy adults.
Absorption
Kapselformulierung
Nach einer oralen Verabreichung der Vyvanse-Kapsel (30 mg 50 mg oder 70 mg) bei Patienten im Alter von 6 bis 12 Jahren mit ADHD unter Gewitter wurde Tmax von Lisdexamfetamin und Dextroamphetamin nach etwa 1 Stunde bzw. 3,5 Stunden nach der Dosis erreicht. Gewicht/Dosis normalisierte AUC- und Cmax -Werte waren bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren gleich wie die Erwachsenen nach einzelnen Dosen von 30 mg bis 70 mg Vyvanse -Kapsel.
Welche Art von Pille ist 2410 V
Auswirkung von Lebensmitteln auf die Kapselformulierung
Weder Lebensmittel (ein Fettmehl oder Joghurt) noch Orangensaft beeinflussen die beobachteten AUC und Cmax von Dextroamphetamin bei gesunden Erwachsenen nach einer oralen Verabreichung von 70 mg Vyvanse-Kapseln mit einer Dosierung. Die Nahrung verlängert sich um ca. 1 Stunde (von 3,8 Stunden im fastenzustand auf 4,7 Stunden nach einer fettreichen Mahlzeit oder bis zu 4,2 Stunden mit Joghurt). Nach einem 8-stündigen Fasten der AUC für Dextroamphetamin nach oraler Verabreichung von Lisdexamfetamin-Dimesylat in Lösung und als intakte Kapseln waren gleichwertig.
Kautable -Tablet -Formulierung
Nach einer einzigen Dosisverabreichung von 60 mg Vyvanse -Kau -Tablette bei gesunden Probanden unter fastdlichen Bedingungen wurde Tmax von Lisdexamfetamin und Dextroamphetamin ungefähr 1 Stunde bzw. 4,4 Stunden nach der Dosis erreicht. Im Vergleich zur 60 mg Vyvanse -Kapsel -Exposition (CMAX und AUC) gegenüber Lisdexamfetamin war etwa 15% niedriger. Die Exposition (CMAX und Aucinf) von Dextroamphetamin ist zwischen Vyvanse -Kautabletten und Vyvanse -Kapsel ähnlich.
Auswirkung von Lebensmitteln auf die Tablettenformulierung
Die Verabreichung von 60 mg Vyvanse-Kautabletten mit Lebensmitteln (eine fettreiche Mahlzeit) verringert die Exposition (CMAX und Aucinf) von Dextroamphetamin um etwa 5% bis 7% und länger danach um ca. 1 Stunde (von 3,9 Stunden bei einem Bedarf auf 4,9 Stunden).
Beseitigung
Die Plasmakonzentrationen von nicht konvertiertem Lisdexamfetamin sind niedrig und vorübergehend im Allgemeinen werden nach Verabreichung im Allgemeinen nicht quantifizierbar. Die Plasma-Eliminierungs-Halbwertszeit von Lisdexamfetamin lag in der Regel bei Freiwilligen ab 6 Jahren durchschnittlich weniger als eine Stunde. Die Plasma-Eliminierungs-Halbwertszeit von Dextroamphetamin betrug bei pädiatrischen Patienten 6 bis 12 Jahre und 10 bis 11,3 Stunden bei gesunden Erwachsenen ungefähr 8,6 bis 9,5 Stunden.
Stoffwechsel
Lisdexamfetamin wird aufgrund der hydrolytischen Aktivität von roten Blutkörperchen nach oraler Verabreichung von LISDExamfetamin-Dimetylat in Dextroamphetamin und Lysin, hauptsächlich im Blut, umgewandelt.
In vitro Die Daten zeigten, dass rote Blutkörperchen eine hohe Kapazität für den Stoffwechsel von Lisdexamfetamin haben. Eine wesentliche Hydrolyse trat auch bei niedrigen Hämatokrit -Werten (33% des Normalwerts) auf. Lisdexamfetamin wird durch Cytochrom -P450 -Enzyme nicht metabolisiert.
Ausscheidung
Nach oraler Verabreichung einer 70 -mg -Dosis von radioaktiv markiertem Lisdexamfetamin -Dimesylat an 6 gesunde Probanden wurde ungefähr 96% der oralen Dosis -Radioaktivität im Urin gewonnen und über einen Zeitraum von 120 Stunden nur 0,3% im Kot gewonnen. Von der im Urin gewonnenen Radioaktivität standen 42% der Dosis mit Amphetamin 25% mit Hippursäure und 2% mit intaktem Lisdexamfetamin.
Spezifische Populationen
Expositionen von Dextroamphetamin in bestimmten Populationen sind in Abbildung 1 zusammengefasst.
Abbildung 1: Spezifische Populationen*:
| *Abbildung 1 zeigt die geometrischen mittleren Verhältnisse und die 90% -Konfidenzgrenzen für Cmax und AUC von D-Amphetamin. Der Vergleich für das Geschlecht verwendet Männer als Referenz. Der Vergleich für das Alter verwendet 55-64 Jahre als Referenz. |
Arzneimittelinteraktionsstudien
Die Auswirkungen anderer Arzneimittel auf die Exposition von Dextroamphetamin sind in Abbildung 2 zusammengefasst.
Abbildung 2: Wirkung anderer Medikamente auf Vyvanse:
Die Auswirkungen von Vyvanse auf die Expositionen anderer Medikamente sind in Abbildung 3 zusammengefasst.
Abbildung 3: Wirkung von Vyvanse auf andere Medikamente:
Tiertoxikologie und/oder Pharmakologie
Es wurde gezeigt, dass die akute Verabreichung hoher Dosen von Amphetamin (D- oder D l-) langlastende neurotoxische Effekte erzeugt, einschließlich irreversibler Nervenfaserschäden bei Nagetieren. Die Bedeutung dieser Erkenntnisse für den Menschen ist unbekannt.
Klinische Studien
Aufmerksamkeitsdefizit -Hyperaktivitätsstörung (ADHS)
Pädiatrische Patienten im Alter von 6 bis 12 Jahren mit ADHS
Eine doppelblinde randomisierte, placebokontrollierte Parallelgruppenstudie (Studie 1) wurde bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren (n = 290) durchgeführt, die die DSM-IV-Kriterien für ADHS (entweder der kombinierte Typ oder den hyperaktiv-impulsiven Typ) erfüllten. Die Patienten erhielten randomisiert, um eine endgültige Dosen von 30 mg 50 mg oder 70 mg Vyvanse oder Placebo für insgesamt vier Wochen täglich zu erhalten. Alle Patienten, die Vyvanse erhielten, wurden in der ersten Behandlungswoche auf 30 mg initiiert. Patienten, die den 50 mg und 70 mg Dosisgruppen zugeordnet waren, wurden um 20 mg pro Woche titriert, bis sie ihre zugewiesene Dosis erreichten. Das primäre Wirksamkeitsergebnis war die Änderung des Gesamtwerts von Basislinie zu Endpunkt in den Investigator-Bewertungen auf der ADHD-Bewertungsskala (ADHD-RS), einem 18-Punkte-Fragebogen mit einem Score-Bereich von 0-54 Punkten, der die Kernsymptome von ADHD misst, die sowohl hyperaktive/impulsiv als auch unaufmerksam gehören. Der Endpunkt wurde als die letzte Woche nach der Zufallsbehandlung (d. H. Wochen 1 bis 4) definiert, für die ein gültiger Wert erhalten wurde. Alle Vyvanse -Dosisgruppen waren Placebo im primären Wirksamkeitsergebnis überlegen. Die mittleren Effekte bei allen Dosen waren ähnlich; Die höchste Dosis (70 mg/Tag) war jedoch beiden niedrigeren Dosen numerisch überlegen (Studie 1 in Tabelle 6). Die Auswirkungen wurden im Laufe des Tages auf der Grundlage der Elternbewertungen (Conners 'Elternbewertungsskala) am Morgen (ca. 10 Uhr) nachmittags (ca. 14 Uhr) und am frühen Abend (ca. 18 Uhr) aufrechterhalten.
Eine doppelblinde, placebokontrollierte randomisierte Crossover-Design-Design-Analog-Klassenzimmerstudie (Studie 2) wurde bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren (n = 52) durchgeführt, die die DSM-IV-Kriterien für ADHS (entweder der kombinierte Typ oder den hyperaktiv-impulsiven Typ) erfüllten. Nach einer 3-wöchigen Open-Label-Dosisoptimierung mit Adderall XR®-Patienten wurde zufällig zugewiesen, um ihre optimierte Dosis von Adderall XR (10 mg 20 mg oder 30 mg) zu fortzusetzen. Wirksamkeitsbewertungen wurden unter 1 2 3 4,5 6 8 10 und 12 Stunden nach der Dosierung unter Verwendung der Swanson Kotkin Agler M.Flynn- und Pelham-Deportment-Scores (SKAMP-Ds) eine 4-Punkte-Unterskala des Skamp mit Punkten von 0 bis 24 Punkten durchgeführt, bei denen Probleme mit dem Ablagerungen des Unterrichts von 0 bis 24 Punkten reichen. Ein signifikanter Unterschied im Patientenverhalten, der auf dem Durchschnitt der Forschungsbewertungen für die SKAMP-DDs in den 8 Bewertungen beruhte, wurden zwischen Patienten beobachtet, wenn sie Vyvanse im Vergleich zu Patienten erhielten, als sie Placebo erhielten (Studie 2 in Tabelle 6). Der Arzneimitteleffekt erreichte die statistische Signifikanz von den Stunden 2 bis 12 nach der Dosis, war jedoch nach 1 Stunde nicht signifikant.
Eine zweite doppelblinde, placebokontrollierte randomisierte Crossover-Design-Design-Analog-Klassenzimmerstudie (Studie 3) wurde bei pädiatrischen Patienten im Alter von 6 bis 12 Jahren (n = 129) durchgeführt, die die DSMIV-Kriterien für ADHS (entweder der kombinierte Typ oder den hyperaktiv-impulsiven Typ) erfüllten. Nach einer 4-wöchigen Open-Label-Dosisoptimierung mit Vyvanse (30 mg 50 mg 70 mg) wurden Patienten nach dem Zufallsprinzip eine optimierte Dosis von Vyvanse oder Placebo für 1 Woche pro Morgen für jede Behandlung fortgesetzt. Ein signifikanter Unterschied im Patientenverhalten, der auf dem Durchschnitt der Prüferbewertungen für die SKAMP-Anteilswerte in allen 7 Bewertungen bei 1,5 2,5 5,0 7,5 10,0 12,0 und 13,0 Stunden nach der Dosierung beruhte, wurden zwischen den Patienten beobachtet, als sie Vyvanse im Vergleich zu Patienten erhielten, als sie Placebo erhielten (Studie 3 in Tabelle 4).
Pädiatrische Patienten im Alter von 13 bis 17 Jahren mit ADHS
Eine doppelblinde randomisierte, placebokontrollierte Parallelgruppenstudie (Studie 4) wurde bei pädiatrischen Patienten im Alter von 13 bis 17 Jahren (n = 314) durchgeführt, die die DSM-IV-Kriterien für ADHS erfüllten. In dieser Studie wurden die Patienten in einem Verhältnis von 1: 1: 1: 1 zu einer täglichen morgendlichen Dosis von Vyvanse (30 mg/Tag 50 mg/Tag oder 70 mg/Tag) oder Placebo für insgesamt vier Wochen Behandlung. Alle Patienten, die Vyvanse erhielten, wurden in der ersten Behandlungswoche auf 30 mg initiiert. Patienten, die den 50 mg und 70 mg Dosisgruppen zugeordnet waren, wurden um 20 mg pro Woche titriert, bis sie ihre zugewiesene Dosis erreichten. Das primäre Wirksamkeitsergebnis war die Veränderung des Gesamtwerts von Basislinie zu Endpunkt in den Investigator-Ratings auf der ADHD-Bewertungsskala (ADHD-RS). Der Endpunkt wurde als die letzte Woche nach der Zufallsbehandlung (d. H. Wochen 1 bis 4) definiert, für die ein gültiger Wert erhalten wurde. Alle Vyvanse -Dosisgruppen waren Placebo im primären Wirksamkeitsergebnis überlegen (Studie 4 in Tabelle 6).
Kinderpatienten im Alter von 6 bis 17 Jahren: Kurzzeitbehandlung bei ADHS
Eine doppelblinde randomisierte, placebo- und aktiv kontrollierte Dosisoptimisierungsstudie mit paralleler Gruppen (Studie 5) wurde bei pädiatrischen Patienten im Alter von 6 bis 17 Jahren (n = 336) durchgeführt, die DSM-IV-Kriterien für ADHD erfüllten. In dieser achtwöchigen Studie wurden die Patienten zu einer täglichen morgendlichen Dosis von Vyvanse (30 50 oder 70 mg/Tag) eine aktive Kontrolle oder Placebo (1: 1: 1) randomisiert. Die Studie bestand aus einer Screening- und Auswaschzeit (bis zu 42 Tage) einer 7-wöchigen Doppelblind-Bewertungszeit (bestehend aus einer 4-wöchigen Dosisoptimierungsperiode, gefolgt von einer 3-wöchigen Dosis-wartungspflichtigen Periode) und einer 1-wöchigen Auswasch- und Follow-up-Periode. Während der Dosisoptimierungsperiode wurden die Probanden titriert, bis eine optimale Dosis basierend auf Verträglichkeit und das Urteil des Ermittlers erreicht wurde. Vyvanse zeigte eine signifikant größere Wirksamkeit als Placebo. Die placeboad angepasste durchschnittliche Reduzierung von Ausgangswert im ADHD-RS-IV-Gesamtwert betrug 18,6. Die Probanden von Vyvanse zeigten auch eine stärkere Verbesserung der Bewertungsskala für klinische globale Impression-Improvement (CGI-I) im Vergleich zu Probanden auf Placebo (Studie 5 in Tabelle 6).
Kinderpatienten im Alter von 6 bis 17 Jahren: Erhaltungsbehandlung bei ADHS
Aufrechterhaltung der Wirksamkeitsstudie (Studie 6)-Eine doppelblinde placebokontrollierte randomisierte Entzugsstudie wurde bei pädiatrischen Patienten im Alter von 6 bis 17 Jahren (n = 276) durchgeführt, die die Diagnose von ADHS (DSM-IV-Kriterien) erfüllten. Insgesamt 276 Patienten wurden in die Studie aufgenommen. 236 Patienten nahmen an Studien 5 und 40 Probanden direkt teil. Die Probanden wurden mindestens 26 Wochen lang mit offenem Label Vyvanse behandelt, bevor sie für den Eintritt in die randomisierte Auszahlungsfrist beurteilt wurden. Berechtigte Patienten mussten das Ansprechen des Behandlungsverhaltens gemäß CGI-S nachweisen <3 Und Total Score on the ADHS-RS ≤22. Patients that maintained treatment response for 2 weeks at the end of the open label treatment period were eligible to be rUndomized to ongoing treatment with the same dose of Vyvanse (N=78) or switched to placebo (N=79) during the double-blind phase. Patients were observed for relapse (treatment failure) during the 6 week double blind phase. A significantly lower proportion of treatment failures occurred among Vyvanse subjects (15.8%) compared to placebo (67.5%) at endpoint of the rUndomized withdrawal period. The endpoint measurement was defined as the last postrUndomization treatment week at which a valid ADHS-RS Total Score Und CGI-S were observed. Treatment failure was defined as a ≥50% increase (worsening) in the ADHS-RS Total
Score und ein Anstieg des CGI-S-Scores um ≥2 Punkte im Vergleich zu den Punktzahlen beim Eintritt in die randomisierte Doubleblind-Randomisierungsphase. Probanden, die sich aus der randomisierten Rückzugszeit zurückziehen und bei ihrem letzten Besuch bei der Behandlung keine Wirksamkeitsdaten lieferten, wurden als Behandlungsfehler klassifiziert (Studie 6 Abbildung 5).
Erwachsene: Kurzzeitbehandlung bei ADHS
Eine doppelblinde randomisierte, placebokontrollierte Parallelgruppenstudie (Studie 7) wurde in Erwachsenen im Alter von 18 bis 55 (n = 420) durchgeführt, die die DSM-IV-Kriterien für ADHS erfüllten. In dieser Studie erhielten Patienten für insgesamt vier Wochen der Behandlung eine endgültige Dosen von 30 mg 50 mg oder 70 mg Vyvanse oder Placebo. Alle Patienten, die Vyvanse erhielten, wurden in der ersten Behandlungswoche auf 30 mg initiiert. Patienten, die den 50 mg und 70 mg Dosisgruppen zugeordnet waren, wurden um 20 mg pro Woche titriert, bis sie ihre zugewiesene Dosis erreichten. Das primäre Wirksamkeitsergebnis war die Veränderung des Gesamtwerts von Basislinie zu Endpunkt in den Investigator-Ratings auf der ADHD-Bewertungsskala (ADHD-RS). Der Endpunkt wurde als die letzte Woche nach der Zufallsbehandlung (d. H. Wochen 1 bis 4) definiert, für die ein gültiger Wert erhalten wurde. Alle Vyvanse -Dosisgruppen waren Placebo im primären Wirksamkeitsergebnis überlegen (Studie 7 in Tabelle 6).
Die zweite Studie war eine multizentrische randomisierte, doppelblinde, placebokontrollierte Cross-Over-modifizierte analoge Klassenzimmerstudie (Studie 8) von Vyvanse, um eine Arbeitsplatzumgebung in 142 Erwachsenen im Alter von 18 bis 55 Jahren zu simulieren, die DSM-IV-TR-Kriterien für ADHD erfüllten. Es gab eine 4-wöchige OpenLabel-Dosi-Optimierungsphase mit Vyvanse (30 mg/Tag 50 mg/Tag oder 70 mg/Tag am Morgen). Die Patienten wurden dann in eine von zwei Behandlungssequenzen randomisiert: 1) Vyvanse (optimierte Dosis), gefolgt von einem Placebo für eine Woche oder 2) Placebo, gefolgt von Vyvanse jeweils für eine Woche. Wirksamkeitsbewertungen ereigneten sich am Ende jeder Woche unter Verwendung des permanenten Produktmaßes für die Leistung (Permp). Permp Gesamtpunktzahl ergibt sich aus der Summe der Anzahl der versuchten Mathematikprobleme zuzüglich der Anzahl der korrekt beantworteten Mathematikprobleme. Die Vyvanse-Behandlung im Vergleich zu Placebo führte zu einer statistisch signifikanten Verbesserung der Aufmerksamkeit über alle Zeitpunkte nach der Dosierung, gemessen durch durchschnittliche Permp-Gesamtwerte im Verlauf eines Bewertungstages sowie zu jedem gemessenen Zeitpunkt. Die PERMP-Bewertungen wurden bei Vordosis (-0,5 Stunden) und bei 2 4 8 10 12 und 14 Stunden nach der Dosierung (Studie 8 in Tabelle 6 Abbildung 6) durchgeführt.
Erwachsene: Erhaltungsbehandlung in ADHS
Eine doppelblinde, placebokontrollierte randomisierte Abzugsdesignstudie (Studie 9) wurde in Erwachsenen im Alter von 18 bis 55 (n = 123) durchgeführt, die eine dokumentierte Diagnose von ADHS oder DSM-IV-Kriterien für ADHD dokumentierte. Bei den Studieneintrittseintrittsdokumentation mindestens 6 Monate lang dokumentiert <22. ADHS-RS Total Score is a measure of core symptoms of ADHS. The CGI-S score assesses the clinician’s impression of the patient’s current illness state Und ranges from 1 (not at all ill) to 7 (extremely ill). Patients that maintained treatment response at Week 3 of the open label treatment phase (N=116) were eligible to be rUndomized to ongoing treatment with the same dose of Vyvanse (N=56) or switched to placebo (N=60) during the double-blind phase. Patients were observed for relapse (treatment failure) during the 6-week double-blind phase. The efficacy endpoint was the proportion of patients with treatment failure during the double-blind phase. Treatment failure was defined as a ≥50% increase (worsening) in the ADHS-RS Total Score Und ≥2-point increase in the CGI-S score compared to scores at entry into the double-blind phase. Maintenance of efficacy for patients treated with Vyvanse was demonstrated by the significantly lower proportion of patients with treatment failure (9%) compared to patients receiving placebo (75%) at endpoint during the double-blind phase (Study 9 Figure 7).
Tabelle 6: Zusammenfassung der primären Wirksamkeitsergebnisse aus kurzfristigen Studien von Vyvanse bei pädiatrischen Patienten (6 bis 17 Jahre) und Erwachsenen mit ADHS
| Studienzahl (Altersspanne) | Primärer Endpunkt | Behandlungsgruppe | Mittlere Basisbewertung (SD) | Ls mittlere Änderung gegenüber dem Ausgangswert (SE) | Placebo-subtracted Differencea (95% dort) |
| Studie 1 (6 - 12 Jahre) | ADHS-RSIV | Vyvanse (30 mg/day)* | 43,2 (6,7) | -21.8 (1,6) | -15.6 (-19.9 -11.2) |
| Vyvanse (50 mg/day)* | 43,3 (6.7) | -23.4 (1,6) | -17.2 (-21.5 -12.9) | ||
| Vyvanse (70 mg/day)* | 45,1 (6,8) | -26,7 (1,5) | -20,5 (-24,8 -16,2) | ||
| Placebo | 42,4 (7.1) | -6.2 (1,6) | - - | ||
| Studie 2 (6 - 12 Jahre) | Durchschnittliche Skamp-Ds | Vyvanse (30 50 or 70 mg/day)* | - - b | 0,8 (0,1) d | -0.9 (-1.1 -0.7) |
| Placebo | - - b | 1,7 (0,1) d | - - | ||
| Studie 3 (6 - 12 Jahre) | Durchschnittliche Skamp-Ds | Vyvanse (30 50 or 70 mg/day)* | 0,9 (1,0)c | 0,7 (0,1)d | -0.7 (-0,9 -0.6) |
| Placebo | 0,7 (0,9)c | 1,4 (0,1)d | - - | ||
| Studie 4 (13 - 17 Jahre) | ADHS-RSIV | Vyvanse (30 mg/day)* | 38,3 (6.7) | -18.3 (1,2) | -5.5 (-9.0 -2.0) |
| Vyvanse (50 mg/day)* | 37,3 (6.3) | -21.1 (1.3) | -8.3 (-11.8 -4.8) | ||
| Vyvanse (70 mg/day)* | 37,0 (7,3) | -20,7 (1.3) | -7,9 (-11.4 -4.5) | ||
| Placebo | 38,5 (7.1) | -12.8 (1.2) | - - | ||
| Studie 5 (6 - 17 Jahre) | ADHS-RSIV | Vyvanse (30 50 or 70 mg/day)* | 40.7 (7,3) | -24.3 (1,2) | -18.6 (-21.5 -15.7) |
| Placebo | 41,0 (7.1) | -5.7 (1.1) | - - | ||
| Studie 7 (18 - 55 Jahre) | ADHS-RSIV | Vyvanse (30 mg/day)* | 40,5 (6,2) | -16.2 (1.1) | -8.0 (-11.5 -4.6) |
| Vyvanse (50 mg/day)* | 40,8 (7,3) | -17.4 (1.0) | 9.2 (-12,6 -5.7) | ||
| Vyvanse (70 mg/day)* | 41,0 (6.0) | -18.6 (1.0) | -10.4 (-13,9 -6.9) | ||
| Placebo | 39,4 (6.4) | -8.2 (1,4) | - - | ||
| Studie 8 (18 - 55 Jahre) | Durchschnittlicher Permp | Vyvanse (30 50 or 70 mg/day)* | 260,1 (86,2)c | 312.9 (8.6)d | 23,4 (15.6 31,2) |
| Placebo | 261,4 (75,0)c | 289,5 (8,6)d | - - | ||
| SD: Standardabweichung; SE: Standardfehler; Ls Mittelwert: kleinste Quadrate Mittelwert; CI: Konfidenzintervall. a Differenz (Medikament Minus Placebo) in der mittleren Durchschnittsänderung der geringsten Quadrate gegenüber dem Ausgangswert. b Vordosierte Skamp-Ds wurde nicht gesammelt. c Vordosierte Skamp-Ds (Studie 3) oder Perm (Studie 8) Gesamtpunktzahl über beide Zeiträume. d Der LS-Mittelwert für Skamp-Ds (Studie 2 und 3) oder Perm (Studie 8) ist nach dosierter Durchschnittsbewertung über alle Sitzungen des Behandlungstages und nicht die Veränderung von Ausgangswert. * Dosen statistisch signifikant überlegen gegenüber Placebo. |
Abbildung 4 LS MEAN SKAMP Deportment Subskaly -Score durch Behandlung und Zeitpunkt für pädiatrische Patienten im Alter von 6 bis 12 Jahren mit ADHS nach 1 Woche doppelter Blindbehandlung (Studie 3)
Eine höhere Punktzahl auf der Skam-Deporungsskala zeigt schwerere Symptome an
Abbildung 5 Kaplan-Meier geschätzter Anteil der Patienten mit Behandlungsversagen für pediatrische Patienten im Alter von 6 bis 17 Jahren (Studie 6)
Abbildung 6 LS-Mittelwert (SE) Permps Gesamtwert durch Behandlung und Zeitpunkt für Erwachsene im Alter von 18 bis 55 Jahren mit ADHS nach 1 Woche doppelter Blindbehandlung (Studie 8)
Eine höhere Punktzahl auf der Perm -Skala zeigt weniger schwere Symptome an.
Abbildung 7 Kaplan-Meier geschätzter Anteil der Probanden mit Rückfall bei Erwachsenen mit ADHS (Studie 9)
Binge Essstörung (BETT)
In einer Phase -2 -Studie wurde die Wirksamkeit von Vyvanse 30 50 und 70 mg/Tag im Vergleich zum Placebo bei der Verringerung der Anzahl der Binge -Tage pro Woche bei Erwachsenen mit mindestens moderatem bis schwerem Bett bewertet. Diese randomisierte doppelblinde parallele, placebokontrollierte Titrationsstudie für Zwangsdosis (Studie 10) bestand aus einer 11-wöchigen doppelblinden Behandlungszeit (3 Wochen Titration für Zwangsdosis, gefolgt von 8 Wochen Dosiserhalt). Vyvanse 30 mg/Tag unterschieden sich statistisch nicht von Placebo im primären Endpunkt. Die Dosen von 50 und 70 mg/Tag waren Placebo am primären Endpunkt statistisch überlegen.
Die Wirksamkeit von Vyvanse bei der Behandlung von Bett wurde in zwei 12-wöchigen randomisierten doppelblinden multizentrischen parallelen Gruppen-Placebokontrollierten Dosisoptimierungsstudien (Studie 11 und Studie 11 und Studie 12) bei Erwachsenen im Alter von 18 bis 55 Jahren (Studie 11: n = 374 Studie 12: n = 350) mit gemäßigten Minderwerten zu schwerem Bett. Eine Bettdiagnose wurde unter Verwendung von DSM-IV-Kriterien für das Bett bestätigt. Die Schwere des Bettes wurde aufgrund von mindestens 3 Binge-Tagen pro Woche für 2 Wochen vor dem Basisbesuch und auf dem Basisbesuch 2 Wochen vor dem Basisbesuch von ≥4 auf dem Basis-Besuch von ≥ 4 festgelegt. Für beide Studien wurde ein Binge -Day als Tag mit mindestens 1 Binge -Episode definiert, wie aus dem täglichen Tagebuch des Subjekts festgelegt.
Beide 12-wöchigen Studien bestanden aus einer 4-wöchigen Dosisoptimierungsperiode und einer 8-wöchigen DOSEMAINING-Periode. Während der Dosisoptimierung, die Vyvanse zugewiesen wurden, wurden mit einer Titrationsdosis von 30 mg/Tag behandelt und nach einer Woche der Behandlung anschließend auf 50 mg/Tag titriert. Zusätzliche Erhöhungen auf 70 mg/Tag wurden als toleriert und klinisch angezeigt. Nach der Dosisoptimierungsperiode setzte die Probanden ihre optimierte Dosis für die Dauer der Dosiswartungszeit fort.
Das primäre Wirksamkeitsergebnis für die beiden Studien wurde als die Änderung gegenüber dem Ausgangswert in Woche 12 in der Anzahl der Tagen pro Woche definiert. Die Grundlinie ist definiert als der wöchentliche Durchschnitt der Anzahl der Binge -Tage pro Woche für die 14 Tage vor dem Basisbesuch. Die Probanden beider Studien zu Vyvanse hatten in Woche 12 eine statistisch signifikant höhere Verringerung gegenüber dem Ausgangswert. Zusätzlich zeigten die Probanden auf Vyvanse eine stärkere Verbesserung im Vergleich zu Placebo über die Schlüsselsekundärergebnisse mit höherem Anteil an Probanden, die sich für die CGI-I-Bewertungsskala mit 4-Wochen-Modifizierungs-Modifizierung verbessert hatten. (Y-bocs-be) Gesamtpunktzahl.
Tabelle 7: Zusammenfassung der primären Wirksamkeit führt zu Bett
| Studienzahl | Behandlungsgruppe | Hauptwirksamkeitsmaßnahme: Binge -Tage pro Woche in Woche 12 | ||
| Mittlere Basisbewertung (SD) | Ls mittlere Änderung gegenüber dem Ausgangswert (SE) | Placebo-subtracted Differencea(95% dort) | ||
| Studie 11 | Vyvanse (50 or 70 mg/day)* | 4,79 (1,27) | -3.87 (0,12) | -1.35 (-1.70 -1.01) |
| Placebo | 4.60 (1,21) | -2,51 (0,13) | - - | |
| Studie 12 | Vyvanse (50 or 70 mg/day)* | 4,66 (1,27) | -3.92 (0,14) | -1.66 (-2.04 -1.28) |
| Placebo | 4,82 (1,42) | -2.26 (0,14) | - - | |
| SD: Standardabweichung; SE: Standardfehler; Ls Mittelwert: kleinste Quadrate Mittelwert; CI: Konfidenzintervall. a Differenz (Medikament Minus Placebo) in der mittleren Durchschnittsänderung der geringsten Quadrate gegenüber dem Ausgangswert. * Dosen statistisch signifikant überlegen gegenüber Placebo. |
Eine doppeltblindes placebokontrollierte randomisierte Entwurfsstudie (Studie 13) wurde durchgeführt, um die Aufrechterhaltung der Wirksamkeit auf der Grundlage der Zeit bis zum Rückfall zwischen Vyvanse und Placebo bei Erwachsenen im Alter von 18 bis 55 (n = 267) mit moderatem bis schwerem Bett zu bewerten. In dieser längerfristigen Studie wurden Patienten, die in der vorangegangenen 12-wöchigen Behandlungsphase auf Vyvanse reagiert hatten, randomisiert, um Vyvanse oder Placebo für bis zu 26 Wochen der Beobachtung für einen Rückfall zu erreichen. Die Reaktion in der Open-Label-Phase wurde für vier aufeinanderfolgende Wochen vor dem letzten Besuch am Ende der 12-wöchigen Open-Label-Phase und einem CGI-S-Score von 2 oder weniger bei demselben Besuch als 1 oder weniger Tage pro Woche als 1 oder weniger Binge-Tage pro Woche definiert. Der Rückfall während der doppelblinden Phase wurde in zwei aufeinanderfolgenden Wochen (14 Tagen) vor jedem Besuch 2 oder mehr Tagen pro Woche und einen Anstieg des CGI-S-Scores von 2 oder mehr Punkten im Vergleich zum randomisierten Withdrawal-Baseline definiert. Die Aufrechterhaltung der Wirksamkeit bei Patienten, die während der offenen Labelperiode eine erste Reaktion hatten und dann während der 26-wöchigen doppelblinden, randomisierten Phase mit zweiblindem Randomie mit Vyvanse weitergegeben wurden, wurde über das Placebo überlegen, gemessen nach Zeit bis zum Zurückziehen.
Abbildung 8 Kaplan-Meier geschätzte Proportionen von Probanden mit Rückfall bei Erwachsenen mit Bett (Studie 13)
Untersuchung der Bevölkerungsuntergruppen auf der Grundlage des Alters (es gab keine Patienten über 65) Geschlecht und Rasse zeigten keine klaren Hinweise auf eine unterschiedliche Reaktionsfähigkeit bei der Behandlung von Bett.
Patienteninformationen für Vyvanse
Vyvanse®
(Wir - Vans)
(Lisdexamfetamin -Dimesylat) Kapseln und kaubare Tabletten
Was sind die wichtigsten Informationen, die ich über Vyvanse wissen sollte?
Vyvanse may cause serious side effects including:
Rufen Sie Ihren Gesundheitsdienstleister sofort an oder gehen Sie sofort in die nächstgelegene Notaufnahme des Krankenhauses, wenn Sie oder Ihr Kind während der Behandlung mit Vyvanse Anzeichen für Herzprobleme wie Schmerzschmerzen oder Ohnmacht haben.
Teilen Sie Ihrem Gesundheitsdienstleister von psychischen Problemen mit, die Sie oder Ihr Kind haben, oder über eine Familiengeschichte von bipolaren Erkrankungen oder Depressionen von Selbstmord.
Rufen Sie Ihren Gesundheitsdienstleister sofort an, wenn Sie oder Ihr Kind während der Behandlung mit Vyvanse neue oder sich verschlechternde mentale Symptome oder Probleme haben, insbesondere wenn Sie Stimmen hören oder glauben, die keine realen oder neuen manischen Symptome sind.
- Missbrauch misuse Und addiction. Vyvanse has a high chance for abuse Und misuse Und may lead to substance use problems including addiction. Misuse Und abuse of Vyvanse other amphetamine containing medicines Und methylphenidate containing medicines can lead to overdose Und death. The risk of overdose Und death is increased with higher doses of Vyvanse or when it is used in ways that are not approved such as snorting or injection.
- Ihr Gesundheitsdienstleister sollte Sie oder das Risiko Ihres Kindes für Missbrauchsmissbrauch und Sucht überprüfen, bevor Sie mit Vyvanse behandelt werden, und überwacht Sie oder Ihr Kind während der Behandlung.
- Vyvanse may lead to physical dependence after prolonged use even if taken as directed by your healthcare provider.
- Geben Sie Vyvanse niemandem. Sehen Was ist Vyvanse? Weitere Informationen.
- Halten Sie Vyvanse an einem sicheren Ort und entsorgen Sie ungenutzte Medikamente ordnungsgemäß. Sehen Wie soll ich Vyvanse aufbewahren? Weitere Informationen.
- Sagen Sie Ihrem Gesundheitsdienstleister, ob Sie oder Ihr Kind jemals von Alkohol verschreibungspflichtigen Medikamenten oder Straßenmedikamenten missbraucht oder angewiesen sind.
- Risiken für Menschen mit schwerer Herzerkrankungen. Bei Menschen mit Herzfehlern oder anderen schwerwiegenden Herzerkrankungen ist ein plötzlicher Tod geschehen.
Ihr Gesundheitsdienstleister sollte Sie oder Ihr Kind vor der Behandlung mit Vyvanse sorgfältig auf Herzprobleme überprüfen. Sagen Sie Ihrem Gesundheitsdienstleister, ob Sie oder Ihr Kind Herzprobleme Herzkrankheiten oder Herzfehler haben.
- Erhöhter Blutdruck und Herzfrequenz.
- Ihr Gesundheitsdienstleister sollte Sie oder den Blutdruck und die Herzfrequenz Ihres Kindes regelmäßig während der Behandlung mit Vyvanse überprüfen.
- Mentale (psychiatrische) Probleme, einschließlich:
- Neues oder schlechteres Verhalten und Gedankenprobleme
- Neue oder schlechtere bipolare Krankheit
- Neue psychotische Symptome (z. B. Stimmen hören oder Dinge sehen oder glauben, die nicht real sind) oder neue manische Symptome
Was ist Vyvanse?
Vyvanse is a central nervous system (CNS) stimulant prescription medicine used for the treatment of:
- Aufmerksamkeitsdefizit -Hyperaktivitätsstörung (ADHS) in adults Und children 6 years of age Und older. Vyvanse may help increase attention Und decrease impulsiveness Und hyperactivity in people with ADHS.
- Mittelschwere bis schwere Essstörung (Bett) bei Erwachsenen. Vyvanse kann dazu beitragen, die Anzahl der Alkohole -Essenstage bei Menschen mit Bett zu verringern.
Vyvanse is not for use in children under 6 years of age with ADHS.
Vyvanse is not for Gewichtsverlust. It is not known if Vyvanse is safe Und effective for the treatment of obesity .
Es ist nicht bekannt, ob Vyvanse sicher und wirksam für die Verwendung bei Kindern mit Bett ist.
Vyvanse is a federally controlled substance (CII) because it contains Lisdexamfetamin -Dimesylat that can be a target for people who abuse prescription medicines or street drugs. Halten Sie Vyvanse an einem sicheren Ort, um es vor Diebstahl zu schützen. Geben Sie Ihrem Vyvanse niemals jemand anderem, weil es den Tod verursachen oder ihnen schaden kann. Der Verkauf oder Verschenken von Vyvanse kann anderen Schaden zufügen und verstößt gegen das Gesetz.
Nehmen Sie Vyvanse nicht, wenn Sie oder Ihr Kind sind:
- Allergisch gegen Amphetaminprodukte oder einen der Zutaten in Vyvanse. Das Ende dieses Medikamentenleitfadens finden Sie in einer vollständigen Liste von Zutaten in Vyvanse.
- Eingenommen oder aufgehört, in den letzten 14 Tagen ein Medikament namens Monoaminoxidase -Inhibitor (MAOI) zu nehmen.
- mit dem Antibiotika -Liniezolid oder dem intravenösen Methylenblau behandelt werden.
Bevor Sie Vyvanse nehmen, teilen Sie Ihrem Gesundheitsdienstleister über alle Erkrankungen mit, einschließlich der Frage, ob Sie oder Ihr Kind:
- Haben Sie Herzerkrankungen Herzerkrankungen Herzfehler oder Bluthochdruck
- haben psychische Probleme, einschließlich Psychose Manie bipolarer Krankheiten oder Depressionen oder eine Familienanamnese mit bipolarer Krankheit oder Depression von Selbstmordkrankheit oder Depression
- Zirkulationsprobleme bei Fingern und Zehen haben
- Nierenprobleme haben
- haben oder hatten wiederholte Bewegungen oder Sounds (TICs) oder Tourette -Syndrom oder eine Familiengeschichte von Tics oder Tourette -Syndrom
- sind schwanger oder planen, schwanger zu werden. Vyvanse kann dem ungeborenen Baby schaden.
- Es gibt ein Schwangerschaftsregister für Frauen, die während der Schwangerschaft Vyvanse ausgesetzt sind. Ziel des Registers ist es, Informationen über die Gesundheit von Frauen zu sammeln, die Vyvanse und ihrem Baby ausgesetzt sind. Wenn Sie oder Ihr Kind während der Behandlung mit Vyvanse schwanger werden, sprechen Sie mit Ihrem Gesundheitsdienstleister über die Registrierung im Nationalen Schwangerschaftsregister für Psychostimulanten unter 1-866-961-2388 oder besuchen Sie online unter https://womensmentalhealth.org/clinical-and-researchprograms/pregnancy:
- stillen oder planen zu stillen. Vyvanse geht in die Muttermilch. Sie sollten während der Behandlung mit Vyvanse nicht stillen. Sprechen Sie mit Ihrem Gesundheitsdienstleister über die beste Möglichkeit, das Baby während der Behandlung mit Vyvanse zu füttern.
Sagen Sie Ihrem Gesundheitsdienstleister über alle Medikamente, die Sie oder Ihr Kind einnehmen einschließlich verschreibungspflichtiger und Over-the-Counter-Medikamente Vitamine und pflanzliche Nahrungsergänzungsmittel.
Vyvanse can affect the way other medicines work Und other medicines may affect how Vyvanse works. Taking Vyvanse with other medicines can cause serious side effects. Sometimes the doses of other medicines will need to be changed while taking Vyvanse.
Sagen Sie Ihrem Gesundheitsdienstleister vor allem mit, wenn Sie oder Ihr Kind nehmen:
- Selektive Serotonin -Wiederaufnahmehemmer (SSRIs)
- Serotonin -Noradrenalin -Wiederaufnahmehemmer (SNRIS)
- Medikamente zur Behandlung von Migränekopfschmerzen namens Triptans
- trizyklische Antidepressiva
- Lithium
- Fentanyl
- Tramadol
- Tryptophan
- Buspiron
- St. Johns Würze
Halten Sie eine Liste aller Medikamente, um Ihren Gesundheitsdienstleister und Apotheker zu zeigen, wenn Sie ein neues Medikament erhalten. Ihr Gesundheitsdienstleister entscheidet, ob Vyvanse mit anderen Medikamenten eingenommen werden kann.
Beginnen Sie während der Behandlung mit Vyvanse keine neue Medizin, ohne zuerst mit Ihrem Gesundheitsdienstleister zu sprechen.
Wie sollte Vyvanse genommen werden?
Nehmen Sie Vyvanse Kapules:
Einnahme von Vyvanse -Kau -Tablets:
- Nehmen Sie Vyvanse genau wie von Ihrem Gesundheitsdienstleister verschrieben.
- Ihr Gesundheitsdienstleister kann die Dosis bei Bedarf ändern.
- Nehmen Sie Vyvanse täglich morgens mit oder ohne Essen.
- Vyvanse comes in capsules or chewable tablets.
- Vyvanse capsules may be swallowed whole.
- Wenn Vyvanse -Kapseln nicht abschluckt werden können, kann die Kapsel geöffnet und der gesamte Inhalt auf Joghurt gestreut oder in Wasser oder Orangensaft gegossen werden.
- Brechen Sie mit einem Löffel jedes Pulver auseinander, das zusammengeklebt ist. Rühren Sie das Vyvanse -Pulver und Joghurtwasser oder Orangensaft, bis sie vollständig zusammengemischt sind.
- Schlucken Sie alle Joghurtwasser- oder Orangensaftmischungen sofort. Lagern Sie die Joghurtwasser- oder Orangensaftmischung nicht.
- Es ist normal, eine filmische Beschichtung auf der Innenseite Ihres Glass oder Behälters zu sehen, nachdem Sie die gesamte Vyvanse -Mischung gegessen oder trinken.
- Kauen Sie Vyvanse -Tabletten vollständig vor dem Schlucken.
Wenn Sie oder Ihr Kind zu viel Vyvanse nehmen, rufen Sie Ihren Gesundheitsdienstleister oder Ihre Gifthilfe unter 1-800-222-1222 an oder gehen Sie sofort in die nächste Notaufnahme des Krankenhauses.
Was sind die möglichen Nebenwirkungen von Vyvanse?
Vyvanse may cause serious side effects including:
Rufen Sie Ihren Gesundheitsdienstleister sofort an, wenn Sie oder Ihr Kind während der Behandlung mit Vyvanse Anzeichen von unerklärlichen Wunden haben, die an den Fingern oder Zehen erscheinen.
- Sehen Was sind die wichtigsten Informationen, die ich über Vyvanse wissen sollte?
- Verlangsamung des Wachstums (Größe und Gewicht) bei Kindern. Kinder sollten ihre Größe und ihr Gewicht während der Behandlung mit Vyvanse häufig überprüfen lassen. Die Vyvanse -Behandlung kann gestoppt werden, wenn Ihr Kind nicht wächst oder zunimmt.
- Kreislaufprobleme bei Fingern und Zehen (periphere Vaskulopathie einschließlich Raynauds Phänomen). Anzeichen und Symptome können umfassen:
- Finger oder Zehen können sich taubkühl anfühlen, schmerzhaft
- Finger oder Zehen können die Farbe von blass nach blau nach rot verändern
Sagen Sie Ihrem Gesundheitsdienstleister, ob Sie oder Ihr Kind Taubheitsschmerz Hautfarbe ändern oder die Temperatur in Ihren Fingern oder Zehen empfindlich machen.
- Neue oder verschlechterende Tics oder verschlechterende Tourette -Syndrom. Teilen Sie Ihrem Gesundheitsdienstleister mit, ob Sie oder Ihr Kind während der Behandlung mit Vyvanse neue oder verschlechternde Tics oder sich verschlimmernden Tourette -Syndrom erhalten.
- Serotons Syndrom. Ein potenziell lebensbedrohliches Problem, das als Serotonin-Syndrom bezeichnet wird, kann auftreten, wenn Vyvanse mit bestimmten anderen Medikamenten eingenommen wird. Hören Sie auf, Vyvanse zu nehmen, und rufen Sie Ihren Gesundheitsdienstleister an oder gehen Sie sofort in die nächstgelegene Krankenhaus -Notaufnahme, wenn Sie oder Ihr Kind die folgenden Anzeichen und Symptome des Serotonin -Syndroms entwickeln:
- Agitation
- Schneller Herzschlag
- spülen
- Anfälle
- Koma
- Schwitzen
- Koordinierungsverlust
- Verwirrung
- Schwindel
- Zittern steife Muskeln oder Muskelzucken
- Dinge sehen oder hören, die nicht real sind (Halluzination)
- Blutdruckänderungen
- hohe Körpertemperatur (Hyperthermie)
- Brechreiz Erbrechen Durchfall
Die häufigsten Nebenwirkungen von Vyvanse bei Kindern 6 bis 17 Jahre und Erwachsene mit ADHS sind:
- Appetitverlust (Anorexie)
- Angst
- Verringerter Appetit
- Durchfall
- Trockener Mund
- Probleme beim Schlafen
- Magenschmerzen
- Gewichtsverlust
- Schwindel
- Reizbarkeit
- Brechreiz
- Erbrechen
Die häufigsten Nebenwirkungen von Vyvanse bei Erwachsenen mit Bett sind:
- Trockener Mund
- Probleme beim Schlafen
- Verringerter Appetit
- Erhöhte Herzfrequenz
- Verstopfung
- fühle mich nervös
- Angst
Dies sind nicht alle möglichen Nebenwirkungen von Vyvanse.
Rufen Sie Ihren Arzt an, um medizinische Beratung zu Nebenwirkungen zu erhalten. Sie können die FDA bei 1-800-FDA-1088 Nebenwirkungen melden.
Wie soll ich Vyvanse aufbewahren?
- Lagern Sie Vyvanse an einem sicheren Ort (wie einem verschlossenen Schrank) und in einem dicht geschlossenen Behälter bei Raumtemperatur zwischen 68 ° F und 77 ° F (20 ° C bis 25 ° C).
- Schützen Sie Vyvanse vor Licht.
- Entsorgen Sie, dass Vyvanse von einem Medicine-Take-Back-Programm auf einer amerikanischen Drogenbehörde (DEA) autorisierte Sammelstelle übernommen wird. Wenn kein Einnahmeprogramm oder ein DEA-autorisierter Sammler verfügbar ist, mischen Sie Vyvanse mit einer unerwünschten ungiftigen Substanz wie Dirt-Katzenstreu oder gebrauchten Kaffeesatz, um es für Kinder und Haustiere weniger attraktiv zu machen. Legen Sie die Mischung in einen Behälter wie eine versiegelte Plastiktüte und werfen Sie Vyvanse in den Haushaltsmüll weg. Besuchen Sie www.fda.gov/drugdisposal, um zusätzliche Informationen zur Entsorgung ungenutzter Arzneimittel zu erhalten.
Halten Sie Vyvanse und alle Medikamente außerhalb der Reichweite der Kinder.
Allgemeine Informationen über den sicheren und effektiven Einsatz von Vyvanse.
Medikamente werden manchmal für andere Zwecke als die in einem Medikamentenhandbuch aufgeführten Zwecke verschrieben. Verwenden Sie Vyvanse nicht für einen Zustand, für den sie nicht verschrieben wurde. Geben Sie Vyvanse nicht an andere Menschen, auch wenn sie die gleichen Symptome haben, die Sie haben. Es kann ihnen schaden und es ist gegen das Gesetz. Sie können Ihren Apotheker oder Gesundheitsdienstleister um Informationen über Vyvanse bitten, die für medizinische Fachkräfte geschrieben wurden.
Was sind die Zutaten in Vyvanse?
Wirkstoff: Lisdexamfetamin -Dimesylat
Kapsel inaktive Zutaten: Mikrokristalline Cellulose -Croscarmellose -Natrium und Magnesiumstearat. Die Kapselschalen (mit S489 geprägt) enthalten Gelatine -Titandioxid und eine oder mehrere der folgenden: FD
Kautable Tablette Inaktive Zutaten: kolloidales Siliziumdioxid Croscarmellose Natrium Guar Gum Magnesium Stearat Mannitol Mikrokristalline Cellulose -Sucralose -künstliche Erdbeergeschmack.
Dieser Medikamentenführer wurde von der US -amerikanischen Food and Drug Administration zugelassen.