Campath
Die Informationen Auf Dieser Website Stellen Keine Medizinische Beratung Dar. Wir Verkaufen Nichts. Die Richtigkeit Der Übersetzung Wird Nicht Garantiert. Haftungsausschluss
Drogenzusammenfassung
Was ist Campath?
Campath (Alemtuzumab) ist ein Antikörper aus tierischer DNA zur Behandlung chronischer lymphozytischer Leukämie. Campath wird normalerweise verabreicht, nachdem andere Medikamente ohne erfolgreiche Behandlung vor Gericht gestellt wurden.
Was sind Nebenwirkungen von Campath?
Campath kann schwerwiegende Nebenwirkungen verursachen, einschließlich:
- Nesselsucht
- Schwierigkeiten beim Atmen
- Schwellung Ihrer Gesichtslippen Zunge oder Hals
- Fieber
- Schüttelfrost
- Brechreiz
- Benommenheit
- Ausschlag
- Keuchen
- Brustschmerzen
- Probleme mit Sprachgedanken Vision oder Muskelbewegung
- Einfach Blutergüsse
- ungewöhnliche Blutungen
- lila oder rote Flecken unter Ihrer Haut
- Mundgeschäfte
- Hautwunden
- Halsschmerzen
- Husten
- blasse oder vergilbte Haut
- dunkel gefärbter Urin
- Verwirrung
- ungewöhnliche Schwäche
- Kurzatmigkeit
- kalte Hände und Füße
- Schwellung in Ihren Unterbeinen
- Gewichtszunahme
- Appetitverlust
- plötzliche Schmerzen in Ihrem Magen oder Rücken und
- Urin, der rosa braun oder schaumig aussieht
Holen Sie sich sofort medizinische Hilfe, wenn Sie eines der oben aufgeführten Symptome haben.
Häufige Nebenwirkungen von Campath sind:
- Fieber
- Schüttelfrost
- Schwindel
- Muskelsteifigkeit
- Gelenk- oder Muskelschmerzen
- Brechreiz
- Erbrechen
- Appetitverlust
- Bauchschmerzen
- Kopfschmerzen
- Durchfall
- Ausschlag or itching
- Nesselsucht
- Müdigkeit
- Schlafprobleme (Schlaflosigkeit)
- Angst
- Ermüdung
- Husten
- schwitzen oder
- Probleme beim Atmen während oder nach der Infusion.
Diese Nebenwirkungen treten in der ersten Behandlungswoche mit Campath häufiger auf. Sagen Sie Ihrem Arzt, wenn Sie ernsthafte Nebenwirkungen von Campath haben, einschließlich:
- Kurzatmigkeit
- Veränderungen für geistige/stimmige Veränderungen (wie Angst an Depressionen)
- Knochen oder Rückenschmerzen
- Muskelkrampf
- ungewöhnliche Schwäche
- Schwellende Knöchel oder Füße
- Gelbhaut oder Augen vergilbt
- Änderungen der Urinmenge
- schmerzhaftes Wasserlassen
- rosa oder blutiger Urin
- Taubheit oder Kribbeln von Armen oder Beinen oder
- Schmerz/Rötung/Schwellung von Armen/Beinen/Injektionsstelle.
Suchen Sie medizinische Versorgung oder rufen Sie auf einmal 911 an, wenn Sie die folgenden schwerwiegenden Nebenwirkungen haben:
- Schwerwiegende Augensymptome wie plötzlicher Sehverlust verschwommenes Sehen Tunnel Sehschmerzen oder Schwellungen oder Halos in der Umgebung des Lichts;
- Schwerwiegende Herzsymptome wie schnelle unregelmäßige oder pochende Herzschläge; Flattern in deiner Brust; Kurzatmigkeit; und plötzliche Schwindel -Benommenheit oder ohnmächtig;
- Starke Kopfschmerzen Verwirrung verwirrt Spracharm oder Bein Schwäche Schwierigkeiten beim Verlust der Koordination unstabil sehr steifes Muskeln hoher Fieber problemlos Schwitzen oder Zittern.
Dieses Dokument enthält nicht alle möglichen Nebenwirkungen und andere können auftreten. Wenden Sie sich an Ihren Arzt nach zusätzlichen Informationen zu Nebenwirkungen.
Dosierung für Campath
Campath -Medikamente werden in der Regel unter 2 Stunden intravenös unter Arztaufsicht vergeben. Die Dosierung basiert auf der Reaktion des Patienten auf die Behandlung. Die Patienten werden normalerweise mit einer geringen Dosis des Medikaments begonnen und die Dosis kann langsam erhöht werden.
Welche Drogensubstanzen oder Nahrungsergänzungsmittel interagieren mit Campath?
Andere Drogen können den Campath beeinflussen. Erzählen Sie Ihrem Arzt von all den von Ihnen verwendeten verschreibungspflichtigen und rezeptfreien Medikamenten. Dies schließt Vitamine Minerals Kräuterprodukte und Medikamente ein, die von anderen Ärzten verschrieben wurden. Verwenden Sie kein neues Medikament, ohne Ihrem Arzt mitzuteilen.
Welche Art von Pille ist M367
Campath während der Schwangerschaft und Stillen
Während des Schwangerschaftscampaths sollte nur bei Verschreibungen verwendet werden. Es wird empfohlen, dass Männer und Frauen, die diese Medikamente erhalten, während der Behandlung mit diesem Medikament und mindestens 6 Monaten danach mindestens 2 Formen der Geburtenkontrolle (z. B. Kondome Geburtenpills) verwenden. Es ist nicht bekannt, ob dieses Medikament in die Muttermilch übergeht. Aufgrund des möglichen Risikos für das Säuglingsstillung bei der Verwendung dieses Arzneimittels wird während der Behandlung mit diesem Medikament und mindestens 3 Monaten danach nicht empfohlen.
Weitere Informationen
Unsere Seitwirkungen des Campaths (Alemtuzumab) bietet einen umfassenden Überblick über die verfügbaren Arzneimittelinformationen über die potenziellen Nebenwirkungen bei der Einnahme dieses Medikaments.
FDA -Drogeninformationen
- Drogenbeschreibung
- Indikationen
- Nebenwirkungen
- Warnungen
- Überdosis
- Klinische Pharmakologie
- Medikamentenhandbuch
WARNUNG
Reaktionen und Infektionen von Zytopenien -Infusionen
Zytopenien
Ernsthaft, einschließlich tödlicher Panzytopenie/Marrow -Hypoplasie autoimmune idiopathische Thrombozytopenie, und bei Patienten, die Campath erhalten, können eine autoimmune hämolytische Anämie auftreten. Einzeldosen von Campath von mehr als 30 mg oder kumulativen Dosen von mehr als 90 mg pro Woche erhöhen die Inzidenz von Panzytopenie [siehe Warnungen und VORSICHTSMASSNAHMEN ].
Infusionsreaktionen
Die Verabreichung von Campaths kann zu schwerwiegendem Infusionsreaktionen führen. Überwachen Sie die Patienten sorgfältig während der Infusionen und halten Sie Campath für Infusionsreaktionen des Grades 3 oder 4 zurück. Campath nach und nach auf die empfohlene Dosis bei der Einleitung der Therapie und nach Unterbrechung der Therapie für 7 oder mehr Tage zu eskalieren [siehe Dosierung und Verwaltung und Warnungen und VORSICHTSMASSNAHMEN ].
Infektionen
Bei Patienten, die Campath erhalten, können schwerwiegende bakterielle virale Pilz- und Protozoeninfektionen auftreten. Prophylaxe gegen Pneumocystis Jiroveci Pneumonia (PCP) und Herpes -Virusinfektionen verabreichen [siehe Dosierung und Verwaltung und Warnungen und VORSICHTSMASSNAHMEN ].
Beschreibung für Campath
Campath (Alemtuzumab) ist ein rekombinanter DNA-abgeleiteter humanisierter monoklonaler Antikörper (CAMPATH-1H), der gegen den Glykoprotein-CD52 von 21–28 kD-Zellen gerichtet ist. Campath-1H ist ein IgG1-Kappa-Antikörper mit menschlichem variablem Gerüst und konstanten Regionen und Komplementaritätskostenregionen aus einem monoklonalen Antikörper (Campath-1G) aus Maus (Ratten). Der Campath-1H-Antikörper hat ein ungefähres Molekulargewicht von 150 kD. Campath wird in einem Medium, das Neomycin enthält, in einer Suspensionskultur von Säugetierzellen (chinesischer Hamster -Eierstock) produziert. Neomycin ist im Endprodukt nicht nachweisbar.
Campath ist eine sterile klare farblose isotonische Lösung (pH 6,8–7,4) zur Injektion. Jedes Ein-Gebrauch-Campathfläschchen enthält 30 mg Alemtuzumab 8,0 mg Natriumchlorid 1,44 mg Dibasisch-Natriumphosphat 0,2 mg Kaliumchlorid 0,2 mg monobasisches Kaliumphosphat 0,1 mg Polysorbat 80 und 0,0187 mg Disodrium-Edetate Dihydrat. Es werden keine Konservierungsmittel hinzugefügt.
Verwendung für Campath
Campath wird als Einzelmittel zur Behandlung von chronischer lymphozytischer B-Cell-Leukämie (B-CLL) angezeigt.
Dosierung für Campath
Dosierungsplan und Verwaltung
- Über 2 Stunden als intravenöse Infusion verabreichen. Nicht als intravenöser Push oder Bolus verabreichen.
- Empfohlener Dosierungsschema
- Eskalieren Sie allmählich die maximal empfohlene Einzeldosis von 30 mg. Es ist eine Eskalation erforderlich, um die Dosierung einzuleiten oder wenn die Dosierung während der Behandlung ≥ 7 Tage aufgenommen wird. Eskalation auf 30 mg normalerweise kann in 3 bis 7 Tagen erreicht werden.
- Eskalationsstrategie
- 3 mg täglich verabreichen, bis die infusionsbedingten Reaktionen ≤ Grad 2 sind [siehe Nebenwirkungen ].
- Dann 10 mg täglich verabreichen, bis die infusionsbedingten Reaktionen ≤ Grad 2 sind.
- Dann dreimal pro Woche 30 mg/Tag an alternativen Tagen (z. B. Mon-Ed-Fr-Fr) verabreichen. Die Gesamtdauer der Therapie einschließlich der Dosiskalation beträgt 12 Wochen.
- Einzeldosen von mehr als 30 mg oder kumulativen Dosen von mehr als 90 mg pro Woche erhöhen die Inzidenz von Panzytopenie.
Empfohlene damit verbundene Medikamente
- Prämedikat mit Diphenhydramin (50 mg) und Paracetamol (500-1000 mg) 30 Minuten vor der ersten Infusion und jeder Dosiskalation. Institut ein angemessenes medizinisches Management (z. B. Glukokortikoide Epinephrin-Meperidin) für infusionsbedingte Reaktionen nach Bedarf [siehe WARNUNGS AND VORSICHTSMASSNAHMEN Und Nebenwirkungen ].
- Den Trimethoprim/Sulfamethoxazol -Doppelstärke (DS) zweimal täglich dreimal pro Woche (oder gleichwertig) als Pneumocystis Jirovecii Pneumonia (PCP) -Prophylaxie verabreichen.
- Verwalten Sie Famciclovir 250 mg Gebot oder gleichwertig wie die Herpetische Prophylaxe.
Fahren Sie die PCP- und Herpes -Virusprophylaxe mindestens 2 Monate nach Abschluss des CAMPath oder bis die CD4 -Anzahl ≥200 Zellen/μl beträgt, je nachdem, was später auftritt [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Dosierungsänderung
- Zurückhalten Campath während schwerer Infektion oder anderen schwerwiegenden Nebenwirkungen bis zur Lösung.
- Campath für Autoimmunanämie oder Autoimmun -Thrombozytopenie einstellen.
- Für Lymphopenie werden keine Dosismodifikationen empfohlen.
Dosisänderung für Neutropenie oder Thrombozytopenie [siehe Warnungen und Vorsichtsmaßnahmen]
| Hämatologische Werte | Dosierungsänderung* |
| ANC <250/μL Und/or platelet count ≤25000/μL | |
| Für das erste Ereignis: | Campath -Therapie zurückhalten. Lebenslauf Campath bei 30 mg, wenn ANC ≥ 500/μl und Thrombozytenzahl ≥50000/μl. |
| Für das zweite Ereignis: | Campath -Therapie zurückhalten. Lebenslauf Campath bei 10 mg, wenn ANC ≥ 500/μl und Thrombozytenzahl ≥50000/μl. |
| Für das dritte Ereignis: | Campath -Therapie abschließen. |
| > 50% Abnahme von Ausgangswert bei Patienten, die die Therapie mit einem Grundlinien -ACN ≤ 2550/μl und/oder einer Thrombozytzahl von ≤ 25000/μl initiieren | |
| Für das erste Ereignis: | Campath -Therapie zurückhalten. Nehmen Sie Campath bei 30 mg bei der Rückkehr zum Basiswert (en) wieder auf. |
| Für das zweite Ereignis: | Campath -Therapie zurückhalten. Nehmen Sie Campath bei 10 mg bei der Rückkehr zum Baseline -Wert (en) wieder auf. |
| Für das dritte Ereignis: | Campath -Therapie abschließen. |
| ! Dosierung und Verwaltung ]. |
Vorbereitung und Verwaltung
Parenterale Arzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden. Wenn Partikel vorliegen oder die Lösung verfärbt wird, verwerfen Sie den Fläschchen. Schütteln Sie keine Fläschchen.
Verwenden Sie die aseptische Technik während der Vorbereitung und Verabreichung von Campath. Zeichnen Sie die notwendige Menge Campath aus dem Fläschchen in eine Spritze.
- Um die 3 mg Dosis vorzubereiten, ziehen Sie 0,1 ml in eine 1 ml Spritze zurück, die in Schritten von 0,01 ml kalibriert ist.
- Um die 10 mg Dosis vorzubereiten, ziehen Sie 0,33 ml in eine 1 ml Spritze, die in Schritten von 0,01 ml kalibriert ist.
- Um die 30 mg Dosis vorzubereiten, ziehen Sie 1 ml entweder in 1 ml oder 3 ml Spritze in 0,1 ml Schritten zurück.
Spritzengehalte in 100 ml sterile 0,9% Natriumchlorid USP oder 5% Dextrose in Wasser USP injizieren. Die Beutel vorsichtig umkehren, um die Lösung zu mischen. Spritze wegwerfen.
Die Fläschchen enthält keine Konservierungsstoffe und ist nur für den einzelnen Gebrauch vorgesehen. Verwerfen Sie die Fläschchen, einschließlich eines ungenutzten Teils nach dem Rückzug der Dosis.
Verwendung innerhalb von 8 Stunden nach der Verdünnung. Speichern Sie verdünntes Campath bei Raumtemperatur zwischen 15 ° C und 30 ° C (59 ° F bis 86 ° F) oder bei 2 ° C bis 8 ° C (36 ° F bis 46 ° F). Vor Licht schützen.
Inkompatibilitäten
Campath ist mit Polyvinylchlorid (PVC) -Taschen und PVC- oder Polyethylen-ausgekleideten PVC-Verabreichungssätzen kompatibel. Fügen Sie andere Drogensubstanzen nicht durch die gleiche intravenöse Linie hinzu oder gleichzeitig.
Wie geliefert
Dosierungsformen und Stärken
Injektion : 30 mg/1 ml als klare farblose Lösung in einem Dosis-Fläschchen
Lagerung und Handhabung
Campath (Alemtuzumab) wird in einem eindosierten Durchblätter mit einem eindosierten Glas mit 30 mg Alemtuzumab in 1 ml Lösung geliefert. Jeder Karton enthält drei Campathfläschchen ( NDC 58468â0357-3) oder ein Campathfläschchen (Fläschchen ( NDC 58468-0357-1).
Campath bei 2 ° C bis 8 ° C (36 ° F bis 46 ° F) aufbewahren. NICHT einfrieren. Wenn es versehentlich vor Verabreichung bei 2 ° C bis 8 ° C aufgetaut wird. Vor direktem Sonnenlicht schützen.
Hergestellt und verteilt von: Genzyme Corporation Cambridge MA 02142 US -Lizenznummer: 1596. Überarbeitet: Apr 2023
Nebenwirkungen für Campath
Die folgenden klinisch signifikanten Nebenwirkungen werden in anderen Abschnitten des Etiketts ausführlicher erörtert:
- Zytopenien [see WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Infusionsbezogene Reaktionen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
- Immunsuppression/Infektionen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ]
Klinische Studien Erfahrung
Da klinische Studien unter stark unterschiedlichen Bedingungen durchgeführt werden, die in den klinischen Studien eines Arzneimittels beobachtet werden, können in den klinischen Studien eines anderen Arzneimittels nicht direkt mit den Raten verglichen werden und spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider.
Die folgenden Daten spiegeln die Exposition gegenüber Campath bei 296 Patienten mit CLL wider, von denen 147 zuvor unbehandelt waren und 149 mindestens 2 vorherige Chemotherapie -Regime erhielten. Die mediane Expositionsdauer betrug 11,7 Wochen für zuvor unbehandelte Patienten und 8 Wochen für zuvor behandelte Patienten.
Die häufigsten unerwünschten Reaktionen mit campath sind: Infusionsbezogene Reaktionen (Pyrexie-Kälte Hypotsion Urticaria übeltachykardie Dyspnoe) Cytopenien (Neutropenie-Lymphopenie-Thrombozytopenie-Anämie-Infektionen (Neutropenie-Lymphopenie-Infektionen) GaSroinktinktionen (CMV-Viremia-Emerämie-Emerämie-Emerämie-Emerämie-Emerämie-Meilen-Ableitungen) GaSroinktinktions-Meilen-MVV-Ableitungen) GaSroinktinktionen-GaSointin-Abtroinktroinkton-Abtroinktroinkton-Abtroinktroinktroinkton-Ableitungen. und neurologische Symptome (Schlaflosigkeit). Die häufigsten schwerwiegenden unerwünschten Reaktionen sind zytopenien-infusionsbedingte Reaktionen und Immunsuppression/Infektionen.
Lymphopenie
Eine schwere Lymphopenie und eine schnelle und anhaltende Abnahme der Lymphozyten -Untergruppen traten bei zuvor unbehandelten und zuvor behandelten Patienten nach Verabreichung von Campath auf. Bei zuvor unbehandelten Patienten betrug der Median CD4 einen Monat nach der Behandlung 0 Zellen/μl und 238 Zellen/μl [25% -75% Interquartilbereich 115 bis 418 Zellen/μl 6 Monate nach der Behandlung [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Neutropenie
Bei bisher unbehandelten Patienten betrug die Inzidenz der Neutropenie Grades 3 oder 4 42% mit einem mittleren Zeitpunkt von 31 Tagen und einer mittleren Dauer von 37 Tagen. Bei zuvor behandelten Patienten betrug die Inzidenz der Neutropenie Grades 3 oder 4 64% bei einer mittleren Dauer von 28 Tagen. Zehn Prozent der zuvor unbehandelten Patienten und 17% der zuvor behandelten Patienten erhielten stimulierende Faktoren der Granulozytenkolonie.
Anämie
Bei bisher unbehandelten Patienten betrug die Inzidenz der Anämie des Grades 3 oder 4 12% mit einem mittleren Zeitpunkt von 31 Tagen und einer mittleren Dauer von 8 Tagen. Bei zuvor behandelten Patienten betrug die Inzidenz der Anämie des Grades 3 oder 4 38%. Siebzehn Prozent der zuvor unbehandelten Patienten und 66% der zuvor behandelten Patienten erhielten entweder eine Erythropoese -Stimulierung von Wirkstoffen oder beides.
Thrombozytopenie
Bei bisher unbehandelten Patienten betrug die Inzidenz der Thrombozytopenie des Grades 3 oder 4 14% mit einem mittleren Zeitpunkt von 9 Tagen und einer mittleren Dauer von 14 Tagen. Bei zuvor behandelten Patienten betrug die Inzidenz der Thrombozytopenie des Grades 3 oder 4 bei einer mittleren Dauer von 21 Tagen 52%. Autoimmun -Thrombozytopenie wurde bei 2% der zuvor behandelten Patienten mit einem Todesfall berichtet.
Infusionsbedingte Reaktionen
Infusionsbedingte Reaktionen, die Pyrexia-Chills-Hypotonie-Urtikaria und Dyspnoe umfassten, waren häufig. Pyrexie und/oder Schüttelfrost des Grades 3 und 4 traten bei ungefähr 10% der zuvor unbehandelten Patienten und bei ungefähr 35% der zuvor behandelten Patienten auf. Das Auftreten von infusionsbedingten Reaktionen war in der ersten Behandlungwoche am größten und nahm mit nachfolgenden Campath-Dosen ab. Alle Patienten wurden mit Antipyretika und Antihistaminika vorbehandelt; Zusätzlich erhielten 43% der zuvor unbehandelten Patienten Glukokortikoid -Vorbehandlung.
Hilft Wellbutrin bei Fibromyalgieschmerzen?
Infektionen
In der Studie an zuvor unbehandelten Patienten wurden die Patienten wöchentlich auf CMV unter Verwendung eines PCR -Assays aus der Einweihung bis zum Abschluss der Therapie und alle 2 Wochen in den ersten 2 Monaten nach der Therapie getestet. CMV -Infektion trat bei 16% (23/147) von zuvor unbehandelten Patienten auf; Ungefähr ein Drittel dieser Infektionen war ernst oder lebensbedrohlich. In Studien zuvor behandelter Patienten, bei denen eine routinemäßige CMV -Überwachung nicht erforderlich war, wurde bei 6% (9/149) der Patienten eine CMV -Infektion dokumentiert; Fast alle diese Infektionen waren ernst oder lebensbedrohlich.
Andere Infektionen wurden bei etwa 50% der Patienten in allen Studien berichtet. Grad 3 bis 5 Sepsis lag zwischen 3% und 10% über Studien und war bei zuvor behandelten Patienten höher. Die Neutropenie von 3 bis 4. Februar lag zwischen 5% und 10% über Studien und war bei zuvor behandelten Patienten höher. Bei 2% der zuvor unbehandelten Patienten und 16% der zuvor behandelten Patienten traten bei 2% infektionsbedingten Todesfälle auf. Bei 109 zuvor unbehandelten Patienten gab es 198 Episoden mit anderer Infektionen; 16% waren bakterielle 7% fungale 4% waren andere virale und in 73% wurden der Organismus nicht identifiziert.
Herz
Herz dysrhythmias occurred in approximately 14% of previously untreated patients. The majority were tachycardias Und were temporally associated with infusion; dysrhythmias were Grade 3 or 4 in 1% of patients.
Zuvor unbehandelte Patienten
Tabelle 1 enthält ausgewählte unerwünschte Reaktionen, die bei 294 Patienten beobachtet wurden (1: 1), um Campath oder Chlorambucil als erste Linientherapie für B-CLL zu erhalten. Campath wurde bis zu 12 Wochen lang dreimal wöchentlich mit einer Dosis von 30 mg intravenös verabreicht. Die durchschnittliche Therapiedauer betrug 11,7 Wochen mit einer mittleren wöchentlichen Dosis von 82 mg (25% -75% Interquartilbereich: 6990 mg).
Tabelle 1: Pro Patienten Inzidenz ausgewählter* Nebenwirkungen bei der Behandlung naive B-CLL-Patienten
| Campath (n = 147) | Chlorambucil (n = 147) | ||||
| Alle Klassen † % | Klassen 3-4 % | Alle Klassen % | Klassen 3-4 % | ||
| Blut- und Lymphsystemstörungen | Lymphopenie | 97 | 97 | 9 | 1 |
| Neutropenie | 77 | 42 | 51 | 26 | |
| Anämie | 76 | 13 | 54 | 18 | |
| Thrombozytopenie | 71 | 13 | 70 | 14 | |
| Allgemeine Erkrankungen und Verwaltungsortbedingungen | Pyrexie | 69 | 10 | 11 | 1 |
| Schüttelfrost | 53 | 3 | 1 | 0 | |
| Infektionen Und Infestations | CMV -Virämie ‡ | 55 | 4 | 8 | 0 |
| CMV -Infektion | 16 | 5 | 0 | 0 | |
| Andere Infektionen | 74 | 21 | 65 | 10 | |
| Haut- und subkutane Gewebeerkrankungen | Urtikaria | 16 | 2 | 1 | 0 |
| Ausschlag | 13 | 1 | 4 | 0 | |
| Erythem | 4 | 0 | 1 | 0 | |
| Gefäßstörungen | Hypotonie | 16 | 1 | 0 | 0 |
| Hypertonie | 14 | 5 | 2 | 1 | |
| Störungen des Nervensystems | Kopfschmerzen | 14 | 1 | 8 | 0 |
| Tremor | 3 | 0 | 1 | 0 | |
| Atemstillstand und Mediastinalstörungen | Dyspnoe | 14 | 4 | 7 | 3 |
| Magen -Darm -Störungen | Durchfall | 10 | 1 | 4 | 0 |
| Psychiatrische Störungen | Schlaflosigkeit | 10 | 0 | 3 | 0 |
| Angst | 8 | 0 | 1 | 0 | |
| Herz Disorders | Tachykardie | 10 | 0 | 1 | 0 |
| * Nebenwirkungen, die bei einer höheren relativen Frequenz im Campatharm auftreten † NCI CTC Version 2.0 für unerwünschte Reaktionen; NCI CTCAE Version 3.0 für Laborwerte ‡ CMV -Virämie (ohne Hinweise auf Symptome) umfasst sowohl Fälle von EinzelpCR -positiven Testergebnissen als auch von bestätigten CMV -Virämie (≥2 Anlässe in aufeinanderfolgenden Proben in Abstand von 1 Woche). Für den letzteren Ganciclovir (oder gleichwertig) wurde pro Protokoll eingeleitet. |
Zuvor behandelte Patienten
Zusätzliche Sicherheitsinformationen wurden aus 3 Einzelarmstudien mit 149 zuvor behandelten Patienten mit CLL erhalten, die 4 bis 12 Wochen lang dreimal dreimal dreimal intravenisch verabreicht wurden (mediane kumulative Dosis 673 mg [Bereich 2-1106 mg]; mittlere Dauer der Therapie 8,0 Wochen). Nebenwirkungen in diesen Studien, die nicht in Tabelle 1 aufgeführt sind, die mit einer Inzidenzrate von> 5% auftraten, waren Müdigkeitswire -Ermense -Musculoskelettal -Anorexie -Dysästhesie -Mukositis und Bronchospasmus.
Immunogenität
Wie bei allen therapeutischen Proteinen besteht eine Immunogenitätspotential. Die Inzidenz der Antikörperbildung hängt stark von der Empfindlichkeit und Spezifität des Assays ab. Zusätzlich kann die beobachtete Inzidenz von Antikörper (einschließlich neutralisierender Antikörper) positiv in einem Assay durch verschiedene Faktoren beeinflusst werden, einschließlich der Timing der Probenentnahme von Proben und zugrunde liegenden Erkrankungen. Aus diesen Gründen kann der Vergleich der Inzidenz von Antikörpern mit der Inzidenz von Antikörpern mit anderen Alemtuzumab -Produkten irreführend sein.
Unter Verwendung eines ELISA-Assay-Anti-Human-Antikörper (HAHA) wurden bei 11 von 133 (8,3%) zuvor unbehandelte Patienten nachgewiesen. Zusätzlich waren zwei Patienten schwach positiv für die neutralisierende Aktivität. Begrenzte Daten legen nahe, dass die Anti-Campath-Antikörper die Tumorreaktion nicht nachteilig beeinflussten. Vier von 211 (1,9%) zuvor behandelte Patienten haben nach der Behandlung Antikörper gegen Campath.
Nachmarkterfahrung
Campath
Die folgenden nachteiligen Reaktionen wurden während der Verwendung von Campath nach der Anbetungsnutzung identifiziert. Da diese Reaktionen freiwillig aus einer Population unsicherer Größe berichtet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder ein kausales Verhältnis zur Arzneimittelexposition herzustellen.
Allgemeine Erkrankungen und Verwaltungsortbedingungen: Tödliche Reaktionen im Zusammenhang mit Infusionsbezogenen.
Herz -Kreislauf -Störungen: Kardiomyopathie mit Herzinsuffizienz verringerte die Ejektionsfraktion (einige Patienten wurden zuvor mit kardiotoxischen Wirkstoffen behandelt).
Zerebrovaskuläre Störungen: Cervicocephale arterielle Dissektionsschlag einschließlich hämorrhagischer und ischämischer Schlaganfall.
Magen -Darm -Störungen: Akute Akalkous -Cholezystitis.
Störungen des Immunsystems: Goodpasture-Syndrom-Graves-Krankheit Aplastische Anämie Guillain-Barré-Syndrom chronisch entzündungshemmend demyelinisierende Polyradiculoneuropathie Serumkrankheit Fatale Transfusion assoziiertes Transplantat gegen Hämophagozytose der Hämophagozytose der Wirtskrankheit (HLH).
Infektionen: Epstein-Barr-Virus (EBV) Infektion Progressive multifokale Leukoenzephalopathie (PML) Reaktivierung latenter Viren.
Stoffwechsel- und Ernährungsstörungen: Tumor -Lyse -Syndrom.
Neoplasmen: EBV-assoziierte lymphoproliferative Störung.
Störungen des Nervensystems: Optische Neuropathie.
Nieren- und Harnstörungen: Glomeruläre Nephropathien.
Andere Alemtuzumab -Produkte
Die folgenden nachteiligen Reaktionen wurden während der Verwendung eines anderen Alemtuzumab -Produkts nach der Annahme identifiziert. Da diese Reaktionen freiwillig aus einer Population unsicherer Größe berichtet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder ein kausales Verhältnis zur Arzneimittelexposition herzustellen.
Endokrine Störungen: Hypothyreose Hyperthyreose und Thyreoiditis.
Störungen des Nervensystems: Autoimmunerzephalitis.
Wechselwirkungen mit Arzneimitteln für Campath
Mit Campath wurden keine formalen Studien zur Wechselwirkung von Arzneimitteln durchgeführt.
Warnungen für Campath
Eingeschlossen als Teil der VORSICHTSMASSNAHMEN Abschnitt.
Vorsichtsmaßnahmen für Campath
Zytopenien
Bei Patienten, die Campath erhielten, wurden schwerwiegend, einschließlich tödlicher Autoimmunanämie und Thrombozytopenie und längerer Myelosuppression berichtet.
Zusätzlich wurden eine hämolytische Anämie reine rote Zell -Aplasie -Knochenmarkaplasie und Hypoplasie nach der Behandlung mit Campath bei der empfohlenen Dosis berichtet. Einzeldosen von Campaths von mehr als 30 mg oder kumulativen Dosen von mehr als 90 mg pro Woche erhöhen die Inzidenz von Panzytopenie.
Zurückhalten Campath für schwere Zytopenien (außer Lymphopenie). Einstellung von Autoimmunzytopenien oder wiederkehrenden/persistenten schweren Zytopenien (außer Lymphopenie) [siehe Dosierung und Verwaltung ]. No data exist on the safety of Campath resumption in patients with autoimmune cytopenias or marrow aplasia [see Nebenwirkungen ].
Erhalten Sie in wöchentlichen Abständen eine vollständige Blutzahl (CBC) während der Campath -Therapie und häufiger, wenn sich die Anämie -Neutropenie oder Thrombozytopenie verschlechtert. Bewerten Sie die CD4 -Zahlen nach der Behandlung bis zur Erholung auf ≥200 Zellen/μl [siehe Dosierung und Verwaltung Und Nebenwirkungen ].
USP normale Kochsalzlösung 0,9 Natriumchlorid
Infusionsbedingte Reaktionen
Neben oder kurz nach der Campath -Infusion sind unerwünschte Reaktionen zu verzeichnen Nebenwirkungen ]. In clinical trials the frequency of infusion-related reactions was highest in the first week of treatment. Monitor for the signs Und symptoms listed above Und withhold infusion for Grade 3 or 4 infusion-related reactions.
Die folgenden schwerwiegenden Reaktionen mit tödlicher Infusion wurden in Berichten nach dem Stempeln identifiziert: Synkope Lungeninfiltrate Akutes Atemnots-Syndrom (ARDS) Atemstillstand Herz-Arrhythmien-Myokardinfarkt akutem Herzinsuffizienz Herzangussangioedem und Angiotoidschock akutem Herzinsuffizienz.
Campath nach dem empfohlenen Dosis-Eskalationsschema einleiten [siehe Dosierung und Verwaltung ]. Premedicate patients with an antihistamine Und acetaminophen prior to each dose. Institute appropriate medical management (e.g. glucocorticoids epinephrine meperidine) for infusion-related reactions as needed [see Dosierung und Verwaltung ]. If therapy is interrupted for 7 or more days reinstitute Campath with gradual dose escalation [see Dosierung und Verwaltung ].
Immunsuppression/Infektionen
Campath treatment results in severe Und prolonged lymphopenia with a concomitant increased incidence of opportunistic infections [see Nebenwirkungen ]. Administer PCP Und herpes viral prophylaxis during treatment with Campath Und for a minimum of 2 months after completion of Campath or until the CD4+ count is ≥200 cells/μL whichever occurs later [see Dosierung und Verwaltung ]. Prophylaxis does not eliminate these infections.
Überwachen Sie die Patienten routinemäßig auf eine CMV -Infektion während der Behandlung mit Campath und mindestens 2 Monate nach Abschluss von Campath. Zurückhalten Campath für schwerwiegende Infektionen und während der antiviralen Behandlung für CMV -Infektionen oder bestätigte CMV -Virämie (definiert als Polymerasekettenreaktion [PCR] positives CMV in ≥2 aufeinanderfolgenden Proben, die 1 Woche abseits erhalten wurden). Initiieren Sie therapeutische Ganciclovir (oder gleichwertig) für eine CMV -Infektion oder bestätigte CMV -Virämie.
Bei Patienten, die Campath erhielten, wurde eine Epstein-Barr-Virus (EBV) -Nektion mit schwerer und tödlicher EBV-assoziierter Hepatitis berichtet.
Überwachen Sie das Zeichen und die Symptome von EBV -Infektionen. Zurückhalten Campath für EBV -Reaktivierung oder schwere Infektion.
Verabreichen Sie nur bestrahlte Blutprodukte, um Transfusions -assoziierte Transplantate im Vergleich zu Wirtskrankheiten (tagvhd) zu vermeiden, es sei denn, die aufkommenden Umstände diktieren sofortige Transfusion.
Bei Patienten, die Campath als anfängliche Therapie -Wiederherstellung von CD4 -Zahlen auf ≥200 Zellen/μl erhielten, traten 6 Monate nach Abschluss des Campaths auf; 2 Monate nach der Behandlung betrug der Median jedoch 183 Zellen/μl. Bei zuvor behandelten Patienten, die Campath erhielten, betrug die mediane Zeit bis zur Wiederherstellung der CD4 -Zahlen auf ≥200 Zellen/μl 2 Monate; Die vollständige Wiederherstellung (zu Grundlinien) von CD4- und CD8 -Zählungen kann jedoch mehr als 12 Monate dauern [siehe Nebenwirkungen ].
Immunisierung
Die Sicherheit der Immunisierung mit lebenden viralen Impfstoffen nach Campath -Therapie wurde nicht untersucht. Verabreichen Sie Patienten oder Säuglingen, die bei Patienten, die Campath erhalten, geboren, keine lebenden viralen Impfstoffe ab. Die Fähigkeit, eine Immunantwort auf einen Impfstoff nach der Campath -Therapie zu erzeugen, wurde nicht untersucht.
Nichtklinische Toxikologie
Karzinogenese -Mutagenese -Beeinträchtigung der Fruchtbarkeit
Studien zur Bewertung des krebserzeugenden oder genotoxischen Potentials von Campath wurden nicht durchgeführt.
In Fertilitätsstudien wurde Alemtuzumab (3 oder 10 mg/kg intravenös) an 5 aufeinanderfolgenden Tagen vor dem Zusammenleben mit unbehandelten Wildtyp-Frauen an transgene männliche Mäuse von HUCD52 verabreicht. Es wurde kein Effekt auf die Fruchtbarkeit oder die Fortpflanzungsleistung beobachtet. In beiden getesteten Dosen wurden jedoch nachteilige Auswirkungen auf die Spermienparameter (einschließlich abnormaler Morphologie [Abstand/kein Kopf] und verringerter Gesamtzahl und Motilität) beobachtet.
Wenn Alemtuzumab (3 oder 10 mg/kg intravenös) 5 vor dem Zusammenleben mit unbehandelten Wildtyp-Männern an transgene weibliche Mäuse mit hucd52-Mäusen verabreicht wurde, war die durchschnittliche Anzahl von Korpora-Lutea- und Implantationsstaaten und eine Anstieg der nachsiedligen Verluste zu einem Anstieg der nachsiedligen Verluste zu einem Anstieg der Häufigkeitsdosenverluste zu einer Anstieg der nachsiedligen Verluste, die zu einer höheren Nachverlust führten, um die Verluste der Nachsteuerung zu einer Anstieg der Highlu-Teste zu erzielen.
Verwendung in bestimmten Populationen
Schwangerschaft
Risikozusammenfassung
Basierend auf Ergebnissen von Animal Studies kann Campath bei der Verabreichung einer schwangeren Frau fetalen Schaden verursachen. Die verfügbaren Daten aus veröffentlichten Kohortenstudien bei schwangeren Frauen reichen nicht aus, um ein Campath-assoziiertes Risiko für schwerwiegende Geburtsfehler zu etablieren. Alemtuzumab war in schwangeren transgenen HUCD52 Daten ). Es ist bekannt, dass menschliche IgG -Antikörper die Plazentasperre überqueren; Daher kann Campath von der Mutter auf den sich entwickelnden Fötus übertragen werden. Beraten Sie Frauen über das potenzielle Risiko für den Fötus. Säuglinge, die von schwangeren Frauen geboren wurden, die mit Campath behandelt werden, können ein erhöhtes Infektionsrisiko haben (siehe Klinische Überlegungen ).
Das Hintergrundrisiko von schweren Geburtsfehlern und Fehlgeburten für die angegebene Bevölkerung ist unbekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für einen Verlust von Geburtsfehlern oder andere nachteilige Ergebnisse. In der US -allgemeinen Bevölkerung beträgt das geschätzte Hintergrundrisiko für größere Geburtsfehler und eine Fehlgeburt bei klinisch anerkannten Schwangerschaften 2% bis 4% bzw. 15% bis 20%.
Klinische Überlegungen
Nebenwirkungen von fetalen/Neugeborenen
Monoklonale Antikörper werden im Laufe der Schwangerschaft über die Plazenta transportiert, wobei die größte Menge im dritten Trimester übertragen wird. Berücksichtigen Sie die Risiken und Vorteile der Verabreichung von lebenden oder lebendigen Impfstoffen an Säuglinge, die Campath in Utero ausgesetzt sind [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Daten
Tierdaten
Wenn Alemtuzumab während der Organogenese (Schwangerschaftstage [GD] 6-10 oder GD 11-15) an schwangere hucd52 transgene Mäuse verabreicht wurde, wurden bei intravenösen Dosen von 3 oder 10 mg/kg keine teratogenen Wirkungen beobachtet. Es gab jedoch einen Anstieg der Embryolethalität (erhöhter Nachimplantationsverlust und die Anzahl der Dämme mit allen Feten toten oder resorbierten) bei schwangeren Tieren, die während der GD 11-15 dosiert wurden. In einer separaten Studie an schwangeren HUCD52-transgenen Mäusenverabreichung von Alemtuzumab während der Organogenese (GD 6-10 oder GD 11-15) in intravenösen Dosen von 3 oder 10 mg/kg wurden Abnahmen in B-Lymphozyten abgenommen, und T-Lymphozyten-Populationen bei beiden in beiden getesteten Dosen bei beiden in den Offsings bei den Offsings bei den Untersuchungen.
Bei schwangeren HUCD52 -transgenen Mäusen verabreichten Alemtuzumab in intravenösen Dosen von 3 oder 10 mg/kg/Tag während der Schwangerschaft und der Laktation eine Zunahme der Todesfälle während der Stillzeit bei 10 mg/kg. Bei beiden getesteten Dosen wurden bei den nachgewiesenen Dosen eine Abnahme der T-Lymphozyten- und B-Lymphozytenpopulationen und in der Antikörperantwort beobachtet.
Stillzeit
Risikozusammenfassung
Es gibt keine Daten über das Vorhandensein von Alemtuzumab bei der Milchwirkung auf die Milchproduktion oder des gestillten Kindes. Die Auswirkungen der lokalen Magen -Darm -Exposition und eine begrenzte systemische Exposition im gestillten Kind auf Alemtuzumab sind unbekannt. Alemtuzumab wurde in der Milch von transgenen HUCD52 -Mäusen nachgewiesen, die Alemtuzumab verabreicht wurden (siehe Daten ). Maternal IgG is known to be present in human milk Und when a drug is present in animal milk it is likely that the drug will be present in human milk.
Aufgrund des Potenzials für schwerwiegende unerwünschte Reaktionen von Campath in einem gestillten Kind, einschließlich einer verringerten Lymphozytenzahlen, empfehlen es, laktierende Frauen während der Behandlung mit Campath und mindestens 3 Monate nach der letzten Dosis nicht zu stillen.
Daten
Alemtuzumab wurde in der Milch von transgenen HUCD52-Mäusen nach intravenöser Verabreichung von Alemtuzumab bei einer Dosis von 10 mg/kg an postpartalen Tagen 8-12 nachgewiesen. Die Serumspiegel von Alemtuzumab waren in laktierenden Mäusen und Nachkommen am postpartalen Tag 13 ähnlich und waren mit Hinweisen auf die pharmakologische Aktivität (Abnahme der Lymphozytenzahlen) in den Nachkommen in Verbindung gebracht.
Frauen und Männer des Fortpflanzungspotentials
Campath may cause embryo-fetal harm when administered to pregnant women [see Verwendung in bestimmten Populationen ].
Schwangerschaft Testing
Schwangerschaft testing is recommended for females of reproductive potential prior to initiating Campath therapy.
Empfängnisverhütung
Frauen
Beraten Sie weibliche Patienten mit reproduktivem Potenzial, während der Behandlung mit Campath und mindestens 3 Monate nach der letzten Dosis eine wirksame Empfängnisverhütung einzusetzen.
Unfruchtbarkeit
Basierend auf Ergebnissen von Tierstudien kann Alemtuzumab die Fruchtbarkeit bei Frauen und Männern des Fortpflanzungspotentials beeinträchtigen [siehe Nichtklinische Toxikologie ]. The reversibility of the effect on fertility is unknown.
Hydrocortison Neomycin und Polymyxin B OTOTIC
Pädiatrische Verwendung
Sicherheit und Wirksamkeit von Campaths wurden bei pädiatrischen Patienten nicht festgestellt.
Geriatrische Verwendung
Von 147 zuvor unbehandelten B-CLL-Patienten, die mit Campath 35% behandelt wurden, waren ≥ 65 Jahre und 4% ≥ 75 Jahre. Von 149 zuvor behandelten Patienten mit B-CLL 44% waren ≥ 65 Jahre alt und 10% ≥ 75 Jahre. Die klinischen Studien über Campath umfassten nicht eine ausreichende Anzahl von Probanden ab 65 Jahren, um festzustellen, ob sie anders reagieren als jüngere Probanden. Andere gemeldete klinische Erfahrung haben keine Unterschiede in den Antworten zwischen älteren und jüngeren Patienten identifiziert.
Überdosierungsinformationen für Campath
In allen klinischen Erfahrungen betrug die gemeldete maximale Eingangsdosis 90 mg. Bei Patienten, die eine höhere Dosis erhielten als empfohlen, traten Knochenmark-Aplasie-Infektionen oder schwere Reaktionen infusionsbedingten Reaktionen auf.
Ein Patient, der eine 80 mg Dosis intravenös erhielt, erlebte akute Bronchospasmus -Husten und Dyspnoe, gefolgt von Anurie und Tod. Ein anderer Patient erhielt in der zweiten Behandlungswoche zwei 90 -mg -Dosen intravenös in einem Tag voneinander entfernt und erlebte einen raschen Beginn der Knochenmarkaplasie.
Es ist kein spezifisches Gegenmittel für die Überdosierung von Campaths bekannt. Campath einstellen und eine unterstützende Therapie bieten.
Kontraindikationen für Campath
Keiner.
Klinische Pharmakologie for Campath
Wirkungsmechanismus
Campath binds to CD52 an antigen present on the surface of B Und T lymphocytes a majority of monocytes macrophages NK cells Und a subpopulation of granulocytes. A proportion of bone marrow cells including some CD34+ cells express variable levels of CD52. The proposed mechanism of action is antibody-dependent cellular-mediated lysis following cell surface binding of Campath to the leukemic cells.
Pharmakodynamik
Herz Electrophysiology
Die Wirkung mehrerer Dosen von Alemtuzumab (12 mg/Tag für 5 Tage) auf das QTC-Intervall wurde in einer Einzelarmstudie bei 53 Patienten ohne Malignität bewertet. In der Studie wurden keine großen Veränderungen im mittleren QTC -Intervall (d. H.> 20 ms) nachgewiesen. Ein mittlerer Anstieg der Herzfrequenz von 22 auf 26 Schläge/min wurde mindestens 2 Stunden lang nach der anfänglichen Infusion von Alemtuzumab beobachtet. Dieser Anstieg der Herzfrequenz wurde bei nachfolgenden Dosen nicht beobachtet.
Nebenwirkungen von L-Lysin
Pharmakokinetik
Campath pharmacokinetics were characterized in a study of 30 previously treated B-CLL patients in whom Campath was administered at the recommended dose Und schedule. After 12 weeks of dosing patients exhibited a 7-fold increase in mean AUC.
Verteilung
Nach der letzten 30 mg Dosis betrug das mittlere Verteilungsvolumen im stationären Zustand 0,18 l/kg (Bereich 0,1 bis 0,4 l/kg).
Beseitigung
Campath pharmacokinetics displayed nonlinear elimination kinetics. Systemic clearance decreased with repeated administration due to decreased receptor-mediated clearance (i.e. loss of CD52 receptors in the periphery). Mean half-life was 11 hours (range 2 to 32 hours) after the first 30 mg dose Und was 6 days (range 1 to 14 days) after the last 30 mg dose.
Spezifische Populationen
Die Auswirkungen von Nieren- oder Leberbeeinträchtigungen auf die Pharmakokinetik von Campath wurden nicht untersucht.
Klinische Studien
Zuvor unbehandelte B-CLL-Patienten
Campath was evaluated in an open-label rUndomized (1:1) active-controlled study in previously untreated patients with B-CLL Rai Stage I-IV with evidence of progressive disease requiring therapy. Patients received either Campath 30 mg intravenously 3 times per week for a maximum of 12 weeks or chlorambucil 40 mg/m² orally once every 28 days for a maximum of 12 cycles.
Von den 297 Patienten randomisierten das Durchschnittsalter 60 Jahre 72% männlich 99% waren kaukasische 96% hatten einen WHO-Leistungsstatus 0-1 23% hatten einen maximalen Lymphknotendurchmesser von ≥ 5 cm 34%.
Patienten, die randomisierten Campaths erhielten, erlebten ein längeres progressionsfreies Überleben (PFS) im Vergleich zu Patienten, die Chlorambucil erhielten (Median PFS 14,6 Monate vs. 11,7 Monate). Die Gesamtantwortraten betrugen 83% und 55% (P. <0.0001) Und the complete response rates were 24% Und 2% (p <0.0001) for Campath Und chlorambucil arms respectively. The Kaplan-Meier curve for PFS is shown in Figure 1.
Abbildung 1: progressionsfreies Überleben bei zuvor unbehandelten B-CLL-Patienten*
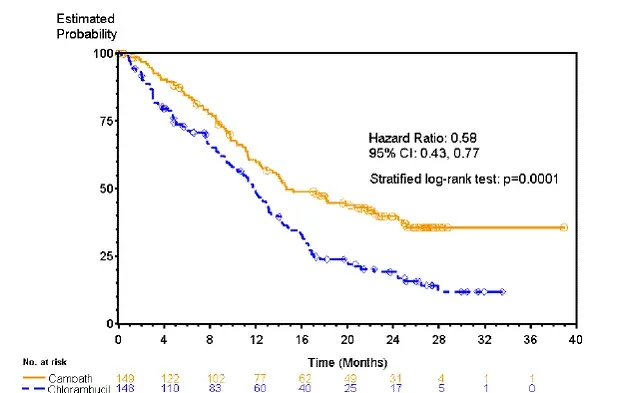 |
* Log-Rank-Test für die RAI-Stufe (I-II vs. III-IV) angepasst.
Zuvor behandelte B-CLL-Patienten
Campath was evaluated in three multicenter open-label single-arm studies of 149 patients with B-CLL previously treated with alkylating agents fludarabine or other chemotherapies. Patients were treated with the recommended dose of Campath 30 mg intravenously 3 times per week for up to 12 weeks. Partial response rates of 21% to 31% Und complete response rates of 0% to 2% were observed.
Patienteninformationen für Campath
Zytopenien
Raten Sie den Patienten, Anzeichen oder Symptome wie blutende blaue Petechien oder Purpura -Blässe oder Müdigkeit zu melden [siehe WARNUNGS AND VORSICHTSMASSNAHMEN Und Nebenwirkungen ].
Infusionsbedingte Reaktionen
Beraten Sie den Patienten über die Anzeichen und Symptome von infusionsbedingten Reaktionen und über die Notwendigkeit, Vorangebieten wie verschrieben zu nehmen [siehe WARNUNGS AND VORSICHTSMASSNAHMEN Und Nebenwirkungen ].
Immunsuppression/Infektionen
Die Patienten empfehlen, sofort Symptome einer Infektion (z. B. Pyrexie) zu melden und prophylaktische Anti-Infektiven für PCP (Trimethoprim/Sulfamethoxazol DS oder gleichwertig) und für Herpesvirus (Famciclovir oder Äquivalent) wie vorgeschrieben [siehe [siehe [siehe Famciclovir) zu nehmen [siehe [siehe) WARNUNGS AND VORSICHTSMASSNAHMEN Und Nebenwirkungen ].
Beraten Sie den Patienten, dass die Bestrahlung von Blutprodukten erforderlich ist [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Immunisierung
Raten Sie den Patienten, dass sie nicht mit lebenden viralen Impfstoffen immunisiert werden sollten, wenn sie kürzlich mit Campath behandelt wurden. Beraten Sie Frauen mit Säuglingen, die Campath in Utero ausgesetzt sind, um den Kinderarzt über die Exposition zu informieren [siehe WARNUNGS AND VORSICHTSMASSNAHMEN ].
Embryo-Fetal-Toxizität
Beraten Sie schwangere Frauen und Frauen des Fortpflanzungspotentials des potenziellen Risikos für einen Fötus. Raten Sie Frauen, ihren Gesundheitsdienstleister über eine bekannte oder vermutete Schwangerschaft zu informieren [siehe Verwendung in bestimmten Populationen ].
Beraten Sie weibliche Patienten mit reproduktivem Potenzial, während der Behandlung mit Campath und 3 Monaten nach der endgültigen Dosis eine wirksame Empfängnisverhütung einzusetzen [siehe Verwendung in bestimmten Populationen ].
Stillzeit
Beraten Sie die Frauen, während der Behandlung mit Campath und 3 Monaten nach der endgültigen Dosis nicht zu stillen [siehe Verwendung in bestimmten Populationen ].
Unfruchtbarkeit
Beraten Verwendung in bestimmten Populationen Und Nichtklinische Toxikologie ].
Glomeruläre Nephropathien
Beraten Sie Patienten über Anzeichen und Symptome von glomerulären Nephropathien, die Monate bis Jahre nach Erhalt des Campaths auftreten können [siehe Nebenwirkungen ].